Caesiumcarbonat
Caesiumcarbonat ist eine chemische Verbindung des Caesiums und zählt zu den Carbonaten. Sie wird überwiegend in der organischen Synthese als Base eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
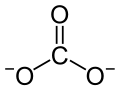 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caesiumcarbonat | ||||||||||||||||||
| Summenformel | Cs2CO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 325,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,07 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1139,7 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Caesiumcarbonat lässt sich aus Pollucit/Spodumen-Konzentraten gewinnen. Dazu wird dieses z. B. unter Druck mit einer Calciumhydroxid-Lösung auf 220 °C erhitzt (hydrothermal). Nach Filtration von unlöslichen Calcium-Silikaten, Ausfällung von überschüssigem Calcium- sowie im Mineral vorhandenen Lithium-Salzen mit Kohlenstoffdioxid als Carbonat, verbleibt eine alkalische Caesiumcarbonatlösung. Diese kann dann z. B. mit Schwefelsäure neutralisiert werden. Es wird ein Caesium-Aluminium-Alaun gebildet, der durch Umkristallisation noch weiter gereinigt wird. Aus diesem Salz wird dann wiederum Caesiumhydroxid hergestellt das letztendlich mittels Kohlenstoffdioxid zu reinstem Caesiumcarbonat umgesetzt wird.[5]
Eigenschaften
Caesiumcarbonat ist hygroskopisch[6] und löst sich leicht in Wasser. Wässrige Caesiumcarbonatlösungen reagieren analog den anderen Alkalicarbonaten basisch. Im Gegensatz zu den anderen Alkalicarbonaten außer dem teuren Rubidiumcarbonat ist Caesiumcarbonat auch in vielen organischen Lösungsmitteln löslich.[7] Caesiumcarbonat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c (Raumgruppen-Nr. 14) und mit den Gitterparametern a = 612,64 pm, b = 1027,65 pm, c = 814,76 pm, β = 95,85° sowie vier Formeleinheiten pro Elementarzelle.[8] Es dissoziiert im Vakuum oberhalb von 600 °C:[8]
Die Standardbildungsenthalpie von Caesiumcarbonat beträgt −1148,7 kJ·mol−1.[9]
Verwendung
Caesiumcarbonat wird in einer Reihe organischer Reaktionen als Reagenz eingesetzt. Beispiele sind Veresterungen und die Bildung von Makrocyclen, bei denen durch die Verwendung von Caesium- anstatt anderer Alkalimetallcarbonate deutlich höhere Ausbeuten erreicht werden können.[7]
Caesiumcarbonat kann als Reagenz in der Schutzgruppenchemie eingesetzt werden; es ist in der Lage, selektiv eine Estergruppe eines aromatischen Diesters abzuspalten. Weiterhin wird Caesiumcarbonat als Base in Horner-Wadsworth-Emmons-Reaktionen und Übergangsmetall-katalysierten Reaktionen eingesetzt.[7]
Andere Caesiumverbindungen wie Caesiumazid können aus Caesiumcarbonat synthetisiert werden.[10]
Caesiumcarbonat kann zur analytischen Trennung von Rubidium und Caesium verwendet werden, da es in Ethanol gut löslich ist, Rubidiumcarbonat jedoch kaum löslich ist.[2]
Einzelnachweise
- Datenblatt Caesiumcarbonat (PDF) bei Merck, abgerufen am 15. März 2010.
- K. A. Hofmann: "Lehrbuch der anorganischen Chemie", 2. Auflage 1919. Verlag F. Vieweg & Sohn, S. 439. Volltext
- Datenblatt Caesiumcarbonat bei Sigma-Aldrich, abgerufen am 15. März 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Patent EP0668845: Prozess for producing a high-density caesium and rubidium salt solution. Veröffentlicht am 30. August 1995, Erfinder: H. Prinz, H. Hofmann, K. Köbele, M. Wegner.
- Manfred Bick, Horst Prinz: Cesium and Cesium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a06_153).
- Timo Flessner, Sven Doye: Cesium carbonate: A powerful inorganic base in organic synthesis. In: Journal für praktische Chemie. 1999, 341, 2, S. 186–190 (doi:10.1002/(SICI)1521-3897(199902)341:2<186::AID-PRAC186>3.0.CO;2-6).
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 610f (eingeschränkte Vorschau in der Google-Buchsuche).
- Fania Moriseevna Perelman: "Rubidium and Caesium", Verlag Pergamon Press 1965. S. 46. (eingeschränkte Vorschau in der Google-Buchsuche), doi:10.1002/ange.19660780727.
- Fritz Blatter, Ernst Schuhmacher: Production of high purity caesium. In: Journal of the beg-Common Metals. 1986, 115, S. 307–313 (doi:10.1016/0022-5088(86)90153-0).
