Pulvinsäure
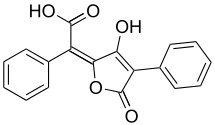
Die Pulvinsäure ist eine organische chemische Verbindung, die zu den Lactonen, Enolen und ungesättigten Carbonsäuren (auch Alkensäuren) zählt. Sie gab der bei Pilzen und Flechten weit verbreiteten Gruppe der Pulvinsäure-Farbstoffe ihren Namen. Im Vergleich zu ihrem Methylester Vulpinsäure besitzt die Pulvinsäure eine sehr viel geringere Toxizität.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pulvinsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H12O5 | ||||||||||||
| Kurzbeschreibung |
orangefarbene Prismen[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 308,29 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| pKS-Wert |
6,86 ± 0,05[3] | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte und Vorkommen
In Pilzen wie den Dickröhrlingsverwandten und Flechten kommen sehr viele verschiedene Farbstoffe vor, die entweder Derivate der Pulvinsäure (etwa die Gomphidsäure) oder aus mehreren Pulvinsäure-Einheiten zusammengesetzt sind (Beispiel für zwei Einheiten: Badione). 1831 wurde der Pulvinsäure-methylester Vulpinsäure bei der Untersuchung von Flechten durch den französischen Apotheker und Chemiker Antoine Bebert entdeckt, aber erst 1860 von Franz Möller und Adolph Strecker genauer untersucht und beschrieben.[7]
Chemische Eigenschaften
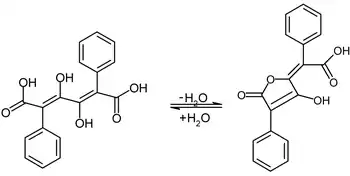
Pulvinsäure ist ein Lacton, also ein intramolekularer Ester der trans-1,4-Diphenyl-2,3-dihydroxy-1,3-butadien-1,4-dicarbonsäure und entsteht aus dieser durch Abspaltung von Wasser:
Die in vielen Dickröhrlingsverwandten vorkommenden Hydroxypulvinsäuren Xerocomsäure und Variegatsäure sind Ausgangsverbindungen der Blaufärbung des Fruchtkörpers bei Druck oder Verletzung, indem sie durch Enzyme (Oxidasen) zu blauen Chinonderivaten oxidiert werden.[8]
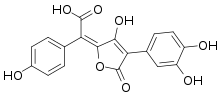 Xerocomsäure
Xerocomsäure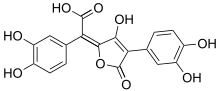 Variegatsäure
VariegatsäureXerocomsäure Variegatsäure
Darstellung
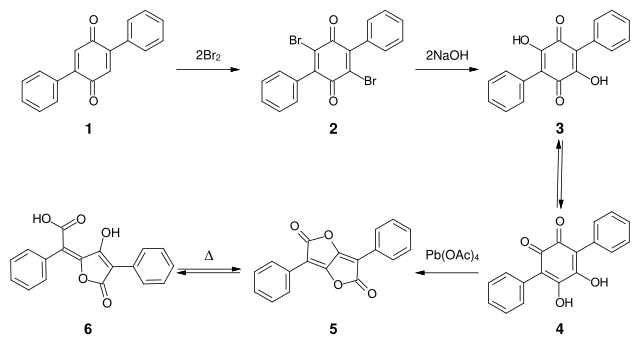
Jacob Volhard synthetisierte als erster sowohl die Pulvinsäure, als auch die Vulpinsäure. Durch Umsetzung mit Oxalsäurediethylester mit Phenylacetonitril im Molverhältnis 1:2 erhält man ein Kondensationsprodukt, das nach der sauren Hydrolyse Pulvinsäure ergibt.[9]
Eine weitere Laborsynthese geht von 2,5-Diphenyl-p-benzochinon 1 aus. Dieses wird in Eisessig mit Brom zu dem 3,6-Dibrom-2,4-diphenyl-p-benzochinon 2 umgesetzt. Aus der Dibromverbindung erhält man mit einer Natriumhydroxid-Lösung in Methanol bei Raumtemperatur die Polyporsäure 4. Oxidation der Polyporsäure mit Bleitetraacetat ergibt das Lacton 5, das nach saurer Hydrolyse die Pulvinsäure 6 liefert.[10]
Biosynthese
In Pilzen verläuft die Biosynthese über Tyrosin[8] oder auch Phenylalanin; daraus entsteht nach Desaminierung, Dimerisierung und Ringspaltung schließlich Pulvinsäure oder Hydroxypulvinsäure.[11]
Biologische Bedeutung
Viele gelbe Farbstoffe in Pilzen und Flechten leiten sich von der Pulvinsäure ab. Dabei wird zwischen Derivaten der Pulvinsäure sowie di- und oligomeren Stoffen unterschieden. Zu den Dimeren zählen die Badione; Derivate des Monomers sind etwa die Gomphidsäure und die Vulpinsäure. Die Vulpinsäure, der Methylester der Pulvinsäure, ist ein starkes Gift, das den produzierenden Pilzen und Flechten als Fraßschutz vor Schnecken und anderen Fressfeinden dient.
Einzelnachweise
- Eintrag zu Pulvinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2014.
- Claudia Synowietz (Hrsg.): Taschenbuch für Chemiker und Physiker. begründet von Jean d’Ans, Ellen Lax. 4. Auflage. Band II: Organische Verbindungen. Springer, Berlin 1983, ISBN 3-540-12263-X.
- M. C. Gaylord, L. R. Brady: Comparison of pigments in carpophores and saprophytic cultures of Paxillus panuoides and Paxillus atrotomentosus. In: Journal of Pharmaceutical Sciences. Band 60, Nr. 10, 1971, S. 1503–1508, doi:10.1002/jps.2600601013.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Acta Pharmacologica et Toxicologica, Vol. 2, 1946, S. 109.
- National Academy of Sciences, National Research Council, Chemical-Biological Coordination Center, Review. Vol. 5, S. 0, 1953.
- Canstatt's Jahresbericht über die Fortschritte in der Pharmacie und verwandte Wissenschaften in allen Ländern, Harvard-Universität, Jahrgang 10 (1861).
- Tilo Lübken: Hygrophorone. Neue antifungische Cyclopentenonderivate aus Hygrophorus-Arten (Basidiomycetes). (PDF; 3,3 MB) Universität Halle, Halle a. d. Saale 2006, S. 11–12.
- J. Volhard: Synthese und Constitution der Vulpinsäure. In: Justus Liebig's Annalen der Chemie. Band 282, Nr. 1-2, 1894, S. 1, doi:10.1002/jlac.18942820102.
- Robert L. Frank, George R. Clark, James N. Coker: The Synthesis of Vulpinic Acid from Polyporic Acid. In: Journal of the American Chemical Society. Band 72, Nr. 4, April 1950, S. 1824, doi:10.1021/ja01160a121.
- L. Zechmeister: Fortschritte Der Chemie Organischer Naturstoffe. 1971, Springer-Verlag, ISBN 3-211-81024-2.