Suboxide
Suboxide (von lat. sub = unter) sind chemische Verbindungen des Sauerstoffs zu elektropositiveren Elementen, in denen weniger Sauerstoffatome gebunden sind, als nach der Wertigkeit des Sauerstoffs zu erwarten wären. Die formale Oxidationsstufe des anderen Elements liegt damit in diesen Verbindungen bei unter +1. Um dies auszugleichen, liegen in dieser Verbindungsklasse Element-Element-Bindungen vor. Suboxide sind vor allem von den Alkalimetallen Rubidium und Caesium sowie von Bor und Kohlenstoff bekannt.
Suboxide sind in der Regel sehr instabil und zerfallen unter Bildung der stabileren Oxide.
Alkalimetallsuboxide
Als einzige Alkalimetalle bilden die schweren Rubidium und Caesium Suboxide. Es sind sehr reaktive, farbige Feststoffe, die elektrische Leitfähigkeit zeigen. Hergestellt werden die Suboxide aus den elementarem Alkalimetallen und geringen, genau definierten Mengen Sauerstoff. Dies kann beispielsweise durch Zersetzung geeigneter Oxide wie Silber- oder Quecksilberoxid geschehen.
Alle Alkalimetallsuboxide reagieren sehr leicht mit Wasser, Sauerstoff oder Kohlenstoffdioxid und bilden dabei die stabileren Oxide oder Hyperoxide.
Rubidiumsuboxide
Das wichtigste Rubidiumsuboxid besitzt die Verhältnisformel Rb9O2. Es ist ein kupferfarbener Feststoff mit einem Schmelzpunkt von 40,2 °C.[1] Die Struktur besteht aus einzelnen Rb9O2-Clustern. In diesen sind die neun Rb-Atome in zwei flächenverknüpften Oktaedern angeordnet. Die Sauerstoff-Atome befinden sich jeweils in der Mitte der Oktaeder.
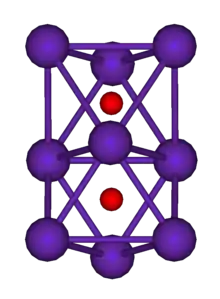 Rb9O2-Cluster (Rb blau, O rot)
Rb9O2-Cluster (Rb blau, O rot)
Es kann auch weiteres Rubidium um die einzelnen Cluster gelagert sein, beim bronzefarbenen Rb6O sind es beispielsweise drei Rubidiumatome pro Cluster. Diese sind aber instabiler, so zersetzt sich Rb6O schon bei −7,7 °C[1]
Caesiumsuboxide
Caesium bildet ebenfalls eine Anzahl Suboxide. Das wichtigste Caesium-Suboxid besitzt die Formel Cs11O3. Es ist ein violetter Feststoff mit einem Schmelzpunkt von 52,5 °C.[1] Die Struktur besteht wie beim Rubidium aus flächenverknüpften Oktaedern, in deren Mitte sich die Sauerstoffatome befinden. Es sind allerdings beim Caesium drei Oktaeder anstatt zwei wie beim Rubidium.
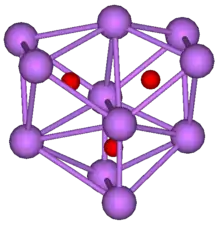 Cs11O3-Cluster (Cs violett, O rot)
Cs11O3-Cluster (Cs violett, O rot)
Wie beim Rubidium können auch beim Cäsium zusätzliche Metallatome eingebaut werden. Es sind Verbindungen mit bis zu 10 weiteren Caesiumatomen bekannt, was einer Verhältnisformel von Cs7O entspricht.
Caesiumsuboxide entstehen in bestimmten Photokathoden, den sogenannten S1-Photokathoden, die aus dünnen Silber- Caesium- und Caesiumoxid-Schichten bestehen. Dabei sind die durch Reaktion von Caesium mit Caesiumoxid entstehenden Suboxide dafür verantwortlich, dass die Kathode auch im Infrarot-Bereich Licht adsorbieren und entsprechend Elektronen emittieren kann.[2]
Kohlenstoffsuboxide
Kohlenstoffsuboxid C3O2 unterscheidet sich deutlich von den Alkalimetallsuboxiden. Es ist eine molekular aufgebaute, gasförmige Verbindung, die leicht zu einem braunroten Feststoff polymerisiert. Auch Pentakohlenstoffdioxid C5O2 ist bekannt.[3]
Borsuboxide
Es sind mehrere Borsuboxide bekannt. Das trigonale Suboxid B6O ist eines der härtesten bekannten Materialien mit einer dem kubischen Bornitrid vergleichbaren Härte.[4] Ein weiteres Borsuboxid ist Bor(I)-oxid (B2O)x, das isoelektronisch zu Graphit ist und eine dementsprechende Struktur besitzt.[5]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1286.
- Arndt Simon: Chemie und Physik von Festkörpern – verschiedene Blickwinkel, gleiche Anliegen. In: Chemie in unserer Zeit, 1988, 22, 1, S. 1–8, doi:10.1002/ciuz.19880220102.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 901.
- Duanwei He et al.: Boron suboxide: As hard as cubic boron nitride. In: Applied Physics Letters, 2002, 81, S. 643–645, doi:10.1063/1.1494860.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1105.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Arndt Simon: Group 1 and 2 suboxides and subnitrides - metals with atomic size holes and tunnels. In: Coordination Chemistry Reviews, 1997, 163, S. 253–270, doi:10.1016/S0010-8545(97)00013-1.