Gallium(III)-fluorid
Gallium(III)-fluorid ist eine chemische Verbindung des Galliums aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
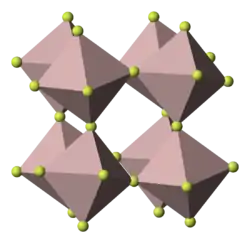 | ||||||||||||||||
| _ Ga3+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Gallium(III)-fluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | GaF3 | |||||||||||||||
| Kurzbeschreibung |
farbloser geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 126,718 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,47 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
> 1000 °C[2] | |||||||||||||||
| Löslichkeit |
sehr wenig löslich in Wasser (24 mg·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1163 kJ·mol−1 [3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Gallium(III)-fluorid kann durch Reaktion von Gallium mit Fluorwasserstoff gewonnen werden.[1]
Auch die Herstellung durch Thermolyse von Ammoniumhexafluoridogallat in einem Fluorgasstrom ist möglich.[1]
Das Trihydrat GaF3·3H2O lässt sich durch Reaktion von Gallium(III)-hydroxid oder Gallium(III)-oxid mit Fluorwasserstoff gewinnen.[4]
Eigenschaften
Gallium(III)-fluorid ist ein farbloser Feststoff, der gegen kaltes und heißes Wasser beständig ist. In Wasser ist Gallium(III)-fluorid (im Gegensatz zu seinem Trihydrat) sehr wenig löslich. Es lässt sich in einer Stickstoff-Schutzatmosphäre oberhalb von 800 °C unzersetzt sublimieren. Durch Entwässern von Trihydrat lässt sich weder an Luft, noch im Vakuum, noch in einem Fluorgasstrom oxidfreies Gallium(III)-fluorid herstellen.[1] Gallium(III)-fluorid besitzt analog zu Aluminiumfluorid eine polymere Kristallstruktur die einer verzerrten Rhenium(VI)-oxid Struktur gleicht (trigonale Struktur, Raumgruppe R3c (Raumgruppen-Nr. 167), a = 5,012 Å, c = 12,99 Å)[5]. Sie bildet wie Aluminiumoxid Komplexverbindungen.[4]
Verwendung
Gallium(III)-fluorid wird zur Herstellung von Fluorgallatgläsern für optische Zwecke verwendet.[2]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 239.
- Datenblatt Gallium(III) fluoride, 99.995% (metals basis) bei AlfaAesar, abgerufen am 1. Dezember 2019 (PDF) (JavaScript erforderlich).
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 1393 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1096.
- M. Roos, G. Meyer: Refinement of the crystal structure of gallium trifluoride, GaF3. In: Zeitschrift für Kristallographie, 2001, 216, S. 18.