Gallium(III)-oxid
Gallium(III)-oxid ist eine chemische Verbindung des Galliums und zählt zu den Oxiden. Der farblose, kristalline Feststoff kommt in fünf Modifikationen vor.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
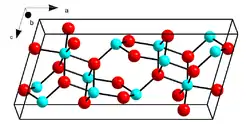 | ||||||||||||||||
| _ Ga3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Gallium(III)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Ga2O3 | |||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 187,5 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
5,88 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
1740 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Gallium(III)-oxid lässt sich durch Entwässerung von Galliumhydroxid bei 500 °C gewinnen.[3]
Eine Alternative ist die Zersetzung von Galliumnitrat bei 200 °C. Die beiden Darstellungswege führen zu unterschiedlichen Modifikationen, die sich bei höheren Temperaturen zur stabilsten β-Modifikation umsetzen.[3]
Eigenschaften
Die Modifikationen des Gallium(III)-oxid bezeichnet man mit den griechischen Buchstaben α bis ε. Die stabilste ist die monokline β-Modifikation. Wird Galliumhydroxid entwässert, bildet sich zunächst die γ-Modifikation, deren Struktur eine Spinellstruktur mit Galliumdefekten ist. Bei längerem Erhitzen geht diese in die α-Ga2O3-Modifikation mit Korundstruktur und schließlich in β-Ga2O3 über.[3][4]
Beim Reaktionsweg über Galliumnitrat bildet sich zunächst die Bixbyit-artige δ-Modifikation, die sich beim stärkeren Erhitzen über die orthorhombische ε-Phase ebenfalls in β-Ga2O3 umwandelt.[3][4]
Mehrere Galliumoxidmodifikationen zeigen fotokatalytische Aktivität bei der Zersetzung aromatischer Verbindungen wie Benzol oder Toluol. Sie ist höher als die des häufig eingesetzten Titan(IV)-oxids.[5]
Verwendung
Gallium(III)-oxid ist Ausgangsstoff für die Herstellung von Gadolinium-Gallium-Granat für Magnetblasenspeicher.[6]
Einzelnachweise
- digallium trioxide bei webelements.com.
- Datenblatt Gallium(III) oxide, Puratronic®, 99.999% (metals basis) bei AlfaAesar, abgerufen am 23. Dezember 2019 (PDF) (JavaScript erforderlich).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1196.
- S. Yoshioka, H. Hayashi, A. Kuwabara, F. Oba, K. Matsunaga, I Tanaka: Structures and energetics of Ga2O3 polymorphs. In: J. Phys.: Condens. Matter. 2007, 19, S. 346211–22, doi:10.1088/0953-8984/19/34/346211.
- Yidong Hou, Ling Wu, Xinchen Wang, Zhengxin Ding, Zhaohui Li, Xianzhi Fu: Photocatalytic performance of α-, β-, and γ-Ga2O3 for the destruction of volatile aromatic pollutants in air. In: Journal of Catalysis. 2007, 250, 1, S. 12–18, doi:10.1016/j.jcat.2007.05.012.
- Eintrag zu Gallium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.