Dichteanomalie
Bei den meisten Stoffen nimmt die Dichte mit abnehmender Temperatur zu, auch über eine Aggregatzustandsänderung hinweg. Ein chemischer Stoff zeigt eine Dichteanomalie, wenn sich seine Dichte unterhalb einer bestimmten Temperatur bei Temperaturabnahme verringert, der Stoff sich also bei Abkühlung ausdehnt (negative thermische Ausdehnung).

Dichteanomalien treten bei den chemischen Elementen Antimon, Bismut, Gallium, Germanium, geschmolzenem Lithium,[1] Plutonium, Silicium und Tellur[2] auf, ebenfalls bei Legierungen wie Woodsches Metall und Verbindungen wie Zirkoniumwolframat (ZrW2O8), ZrV2O7, HfV2O7 oder Zinkcyanid. Wasser ist der wichtigste Stoff, bei dem eine solche Anomalie auftritt, im Speziellen auch Anomalie des Wassers genannt.[3] Hier wird zum einen die maximale Dichte des flüssigen Wassers oberhalb von 0 °C erreicht, zum anderen besitzt Eis eine geringere Dichte als flüssiges Wasser.
Auch manche stark polaren Flüssiggase zeigen Dichteanomalien, z. B. Fluorwasserstoff und Ammoniak. Auch bei der Umwandlung von β-Zinn unterhalb 13,2 °C in eine andere Modifikation (α-Zinn) ändert sich dessen Dichte, hier aber unumkehrbar.
Anwendung
Stoffe mit Dichteanomalie können ihre ingenieurwissenschaftliche Anwendung als Kompensator thermischer Ausdehnung finden. Dabei bringt man Stoffe mit positiver thermischer Ausdehnung und Stoffe mit negativer thermischer Ausdehnung (also mit Dichteanomalie) zusammen, sodass sich bei einer Temperaturveränderung Ausdehnung und Kontraktion ausgleichen und das Material sein Volumen gar nicht oder genau definiert mit Temperatur verändert. Eine thermische Ausdehnung nahe Null garantiert unveränderte Performance bei verschiedenen Temperaturen.[4][5]
Ein gutes Beispiel aus dem Alltag für Materialien mit einer thermischen Ausdehnung nahe null sind Glaskeramik-Kochfelder wie z. B. Ceran. Diese weisen eine hohe Temperaturwechselbeständigkeit auf, sodass das Glas nicht springt, wenn es auf einer Seite erhitzt wird, während die andere Seite Raumtemperatur aufweist. Das liegt darin, dass manche in diesen Keramiken enthaltenen Phasen eine Dichteanomalie besitzen. Die Glaskeramik wird mit Hilfe der chemischen Zusammensetzung so eingestellt, dass die negative thermische Ausdehnung dieser Phasen bei einer Temperaturveränderung die positive thermische Ausdehnung anderer Phasen kompensiert. Dann weist das gesamte Kochfeld kaum thermische Ausdehnung auf und das Ceran springt nicht, wenn es nicht gleichmäßig überall erwärmt wird.
Gerade im Ingenieurwesen z. B. bei der Herstellung von Präzisionsinstrumenten ist man immer auf der Suche nach Materialien mit möglichst konstanter Performance in verschiedenen Temperaturbereichen. Dabei eignen sich dann gerade Materialien mit Dichteanomalie und kubischem Gitter, da diese isotrope negative thermische Ausdehnung aufweisen, d. h., dass ihre Ausdehnung in alle drei Raumrichtungen gleich ist. Beispiele dafür sind unter anderem , und .[4] Während über einen Temperaturbereich von 0,3 bis 1050 K negative thermische Ausdehnung besitzt,[6] zeigt sich bei und die Dichteanomalie allerdings nur in ihrer Hochtemperaturphase beginnend bei 350 bis 400 K.[7]
Es kann allerdings auch nützlich sein, Materialien mit einer genau definierten thermischen Ausdehnung zu designen. Bei Zahnimplantaten ist es wichtig, dass sich die Füllung nicht deutlich stärker oder schwächer mit Temperatur ausdehnt, wenn man z. B. ein heißes oder kaltes Getränk zu sich nimmt. Daher kann es von Vorteil sein, die Gesamtausdehnung des Implantats durch die Verwendung von Materialien mit positiver und negativer thermischer Ausdehnung auf die Ausdehnung der Zähne abzustimmen.
Beispiele
Wasser
.svg.png.webp)
Bei Normaldruck hat Wasser seine größte Dichte von ca. 1000 Kilogramm pro Kubikmeter bei 3,98 °C und ist flüssig. Unterhalb von 3,98 °C dehnt sich Wasser bei (weiterer) Temperaturverringerung – auch beim Wechsel zum festen Aggregatzustand – (wieder) aus. Die Anomalie des Wassers besteht also im Bereich zwischen 0 °C und 3,98 °C, das Eis verhält sich nicht anomal, wenn auch untypischerweise die Dichte des Eises geringer ist als die des flüssigen Wassers. Die derzeit genauesten publizierten Werte für die maximale Dichte liegen bei (999,974950 ± 0,00084) kg/m3 bei einer Temperatur von (3,983 ± 0,00067) °C. Die Werte stellen einen Mittelwert der von verschiedenen physikalischen Instituten veröffentlichten Zahlen dar (Stand 2005).
Die Berechnung der Dichte von luftfreiem Wasser DLF in Abhängigkeit von der Temperatur T ([T] = °C) kann mit Hilfe der folgenden Virialgleichung erfolgen:
- .
mit den Koeffizienten: a0 = 999,83952; a1 = 16,952577 (°C)−1; a2 = −7,9905127·10−3 (°C)−2; a3 = −4,6241757·10−5 (°C)−3; a4 = 1,0584601·10−7 (°C)−4; a5 = −2,8103006·10−10 (°C)−5 und b = 0,016887236. Für die Berechnung der Dichte von luftgesättigtem Wasser korrigiert man den Wert nach DLG/(g/l) = DLF/(g/l) − 0,004612 + 0,000106 (°C)−1·T.[8]
Im festen Aggregatzustand – in diesem Fall bei Eis – wird normalerweise eine hohe Fernordnung durch Ausbildung eines Kristallgitters im Zuge der Kristallisation erreicht. Im flüssigen Zustand herrscht eine Mischung von Ordnung und Chaos, wobei die Moleküle aufgrund ihrer höheren Geschwindigkeit ein größeres Volumen ausfüllen. Es erhöht sich also das Volumen, die Dichte wird damit geringer. Im gasförmigen Zustand ist die maximale Unordnung erreicht, d. h. die Moleküle verteilen sich dementsprechend gleichmäßig über den maximal zur Verfügung stehenden Raum.
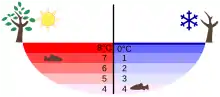
Der Grund der Anomalie des Wassers liegt in der Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen. Durch sie benötigt die Struktur im festen Zustand mehr Raum als bei beweglichen Molekülen. Die Strukturbildung ist ein fortschreitender Vorgang, das heißt, es sind schon im flüssigen Zustand so genannte Cluster aus Wassermolekülen vorhanden. Bei 3,98 °C ist der Zustand erreicht, bei dem die einzelnen Cluster das geringste Volumen einnehmen und damit die größte Dichte haben. Wenn die Temperatur weiter sinkt, wird durch einen stetigen Wandel der Kristallstrukturen mehr Volumen benötigt. Wenn die Temperatur steigt, benötigen die Moleküle wieder mehr Bewegungsfreiraum, wodurch das Volumen ebenfalls steigt.
Die Lebensdauer der einzelnen Cluster ist temperaturabhängig und liegt bei 4 °C in der Größenordnung von nur wenige billionstel Sekunden[9]. Bei weiterer Abkühlung wird der instabile Zustand der Cluster aufgrund der abnehmenden Wärmebewegung immer stabiler, bis sich beim Erstarren schließlich stabile hexagonale Kristallstrukturen gebildet haben (Eis). Das Volumen nimmt bei diesem Phasenübergang nochmals deutlich zu.
Die Dichteanomalie des Wassers ist wichtig für das Leben in Gewässern kälterer Klimazonen. Unterhalb einer Temperatur von etwa 4 °C sinkt Oberflächenwasser nicht nach unten. Statt des damit verbundenen Auskühlens tieferer Gewässerschichten und eines vollständigen Durchfrierens von unten her können sich thermische Schichten bilden. Wassertiere und -pflanzen können unter der Eisschicht überleben.
Die Temperatur, bei der Wasser die größte Dichte erreicht, sinkt mit steigendem Druck von 3,98 °C (1 bar) über ca. 2 °C (100 bar) auf ca. 0 °C (200 bar, wobei hier der Gefrierpunkt seinerseits auf −1,5 °C gesunken ist).[10]
Zahlenwerte zu Dichteanomalie und Ausdehnungskoeffizient von Eis und Wasser bei Normaldruck
Der berechnete Ausdehnungskoeffizient ist ein mittlerer Ausdehnungskoeffizient zwischen beiden Temperaturen.
| Substanz | / in [°C] | / in [g/cm³] | in [K] | mittlere Temperatur in [°C] | in [1/K] | Quellen |
|---|---|---|---|---|---|---|
| Wasser | 0 / 0 | 0,918 (Eis) / 0,999840 (Wasser) | 0 | 0 | - | ,[11][12] |
| 0 / 1 | 0,918 (Eis) / 0,999899 | 1 | 0,5 | -0,0819 | ||
| 0 / 1 | 0,999840 (Wasser) / 0,999899 | 1 | 0,5 | −0,000059006 | ||
| 1 / 2 | 0,999899 / 0,999940 | 1 | 1,5 | -0,0000410025 | ||
| 2 / 3 | 0,999940 / 0,999964 | 1 | 2,5 | -0,0000240009 | ||
| 3 / 3,983 (Dichtemaximum) | 0,999964 / 0,999975 | 0,983 | 3,4915 | -0,0000119051 | ||
| 3 / 4 | 0,999964 / 0,999972 | 1 | 3,5 | -0,00000800023 | ||
| 3,983 (Dichtemaximum) / 4 | 0,999975 / 0,999972 | 0,017 | 3,9915 | +0,000176476 | ||
| 3 / 5 | 0,999964 / 0,999964 | 2 | 4 (nah am Dichtemaximum) | 0 | ||
| 4 / 5 | 0,999972 / 0,999964 | 1 | 4,5 | +0,00000800028 | ||
| 5 / 6 | 0,999964 / 0,999940 | 1 | 5,5 | +0,0000240014 | ||
| 6 / 7 | 0,999940 / 0,999901 | 1 | 6,5 | +0,0000390039 | ||
| 17 / 19 | 0,998773 / 0,998403 | 2 | 18 | +0,0001853 | ||
| 19 / 21 | 0,998403 / 0,997991 | 2 | 20 | +0,0002064 | ||
| 24 / 26 | 0,997295 / 0,996782 | 2 | 25 | +0,0002573 | ||
Schmilzt Eis bei 0 °C zu Wasser, so nimmt dessen Volumen um etwa 8,19 % dabei ab. Beim Gefrieren nimmt es entsprechend um ca. 8,92 % zu.
Die mittleren Ausdehnungskoeffizienten wurden aus den Dichtewerten berechnet:
Dichteanomalie und (nicht isobarer) Ausdehnungskoeffizient von flüssigem Ammoniak
Bei jeder Temperatur hat das Flüssiggas einen anderen Dampfdruck, entsprechend seiner Dampfdruckfunktion. Daher erfolgt hier die temperaturbedingte Ausdehnung oder Kontraktion des Volumens nicht isobar.
Die negativen Ausdehnungskoeffizienten sind fett markiert.
Der berechnete Ausdehnungskoeffizient ist ein mittlerer Ausdehnungskoeffizient zwischen beiden Temperaturen.
| Substanz | / (°C) |
/ (kg/m³) |
(K) |
mittlere Temperatur (°C) |
(10−3/K) |
Quellen |
|---|---|---|---|---|---|---|
| flüssiges Ammoniak, siedend (beim eigenen Dampfdruck) | −70 / −68 | 725,27 / 720,36 | 2 | −69 | +3,408 | [13] |
| −68 / −66 | 720,36 / 720,67 | 2 | −67 | −0,215 | ||
| −66 / −64 | 720,67 / 718,39 | 2 | −65 | +1,587 | ||
| −64 / −62 | 718,39 / 716,08 | 2 | −63 | +1,613 | ||
| −50 / −48 | 702,00 / 699,64 | 2 | −49 | +1,687 | ||
| −30 / −28 | 677,64 / 675,17 | 2 | −29 | +1,829 | ||
| −28 / −26 | 675,17 / 672,63 | 2 | −27 | +1,888 | ||
| −26 / −24 | 672,63 / 674,63 | 2 | −25 | −1,482 | ||
| −24 / −22 | 674,63 / 685,87 | 2 | −23 | −8,194 | ||
| −22 / −20 | 685,87 / 665,03 | 2 | −21 | +15,668 | ||
| −2 / 0 | 641,27 / 638,57 | 2 | −1 | +2,114 | ||
| −2 / 2 | 641,27 / 635,85 | 4 | 0 | +2,131 | ||
| 0 / 2 | 638,57 / 635,85 | 2 | 1 | +2,139 | ||
| 18 / 20 | 613,20 / 610,28 | 2 | 19 | +2,392 | ||
| 18 / 22 | 613,20 / 607,31 | 4 | 20 | +2,425 | ||
| 20 / 22 | 610,28 / 607,31 | 2 | 21 | +2,445 | ||
| 24 / 26 | 604,38 / 601,32 | 2 | 25 | +2,544 | ||
| 48 / 50 | 566,28 / 563,06 | 2 | 49 | +2,859 |
- Hinweis
- Dichtewerte und Ausdehnungskoeffizienten des flüssigen Ammoniaks weisen im betrachteten Temperaturbereich zwei Dichteanomalien auf!
Die mittleren Ausdehnungskoeffizienten wurden aus den Dichtewerten berechnet:
Die Dichtequotienten sind den Volumenquotienten oder den Quotienten der spezifischen Volumina v (massenspezifisch oder molares Volumen) jeweils indirekt proportional!
Dichteanomalie und Ausdehnungskoeffizienten von geschmolzenem Lithium
Siehe dazu: Ausdehnungskoeffizient#Zahlenwerte von Metallschmelzen.
Einzelnachweise
- W. Fratzscher, H. P. Picht: Stoffdaten und Kennwerte der Verfahrenstechnik. Verlag für Grundstoffindustrie Leipzig, DDR 1979/BRD 1993, Daten von Metallschmelzen, Lithium S. 176.
- http://iffwww.iff.kfa-juelich.de/~jones/PhysRevB.81.094202.pdf Density variations in liquid tellurium: Roles of rings, chains, and cavities, S. 1.
- Anomalie des Wassers. In: Learnattack. Duden, abgerufen am 20. Januar 2022.
- Martin T Dove, Hong Fang: Negative thermal expansion and associated anomalous physical properties: review of the lattice dynamics theoretical foundation. In: Reports on Progress in Physics. Band 79, Nr. 6, 1. Juni 2016, ISSN 0034-4885, S. 066503, doi:10.1088/0034-4885/79/6/066503 (iop.org [abgerufen am 11. März 2020]).
- Koshi Takenaka: Negative thermal expansion materials: technological key for control of thermal expansion. In: Science and Technology of Advanced Materials. Band 13, Nr. 1, Februar 2012, ISSN 1468-6996, S. 013001, doi:10.1088/1468-6996/13/1/013001 (tandfonline.com [abgerufen am 11. März 2020]).
- R. Mittal, S. L. Chaplot: Lattice dynamical calculation of negative thermal expansion in ZrV 2 O 7 and HfV 2 O 7. In: Physical Review B. Band 78, Nr. 17, 7. November 2008, ISSN 1098-0121, S. 174303, doi:10.1103/PhysRevB.78.174303 (aps.org [abgerufen am 11. März 2020]).
- Tetsuo Hisashige, Teppei Yamaguchi, Toshihide Tsuji, Yasuhisa Yamamura: Phase Transition of Zr1-xHfxV2O7 Solid Solutions Having Negative Thermal Expansion. In: Journal of the Ceramic Society of Japan. Band 114, Nr. 1331, 2006, ISSN 0914-5400, S. 607–611, doi:10.2109/jcersj.114.607 (jst.go.jp [abgerufen am 11. März 2020]).
- PTB-Mitteilungen 100/3-90: Horst Bettin und Frank Spieweck: Die Dichte des Wassers als Funktion der Temperatur nach Einführung der Internationalen Temperaturskala von 1990. PTB-Mitteilungen 100 3/90, (1990) S. 195-196.
- tec-science: Dichteanomalie des Wassers. In: tec-science. 16. Februar 2019, abgerufen am 8. November 2020 (deutsch).
- Engineering ToolBox: Density and specific volume of a liquid versus change in pressure and temperature (englisch), 2009, abgerufen am 28. Dezember 2018.
- U. Hübschmann, E. Links: Tabellen zur Chemie. Verlag Handwerk und Technik, Hamburg 1991, ISBN 3-582-01234-4, Dichte von Quecksilber und Wasser bei verschiedenen Temperaturen und Luftdruck, S. 36.
- Formeln und Tabellen für die Sekundarstufen I und II. Paetec GmbH, 1996, ISBN 3-89517-253-7, S. 11
- W. Fratzscher, H. P. Picht: Stoffdaten und Kennwerte der Verfahrenstechnik. Verlag für Grundstoffindustrie Leipzig, DDR 1979/BRD 1993, S. 144–146 – Thermodynamische Daten von Ammoniak, Dichtewerte aus spezifischen Volumina v` berechnet.