Friedel-Crafts-Alkylierung
Die Friedel-Crafts-Alkylierung ist eine Namensreaktion in der organischen Chemie und benannt nach ihren Entdeckern Charles Friedel (1832–1899) und James Mason Crafts (1839–1917). Es handelt sich hierbei um eine elektrophile aromatische Substitution (kurz: SEAr). Unter katalytischer Wirkung einer Lewissäure (z. B. FeCl3, AlCl3, H2SO4, H3PO4, HF, HgSO4) wird bei der Friedel-Crafts-Alkylierung ein Aromat mit einem Alkylhalogenid, Alkohol, Alken oder Alkin[1] umgesetzt. Dabei entstehen Alkylaromaten.
 Übersicht 1 der Friedel-Crafts-Alkylierung
Übersicht 1 der Friedel-Crafts-Alkylierung
Die Alkylierung kann auch intramolekular erfolgen. Ein Beispiel ist die Synthese von Tetralin.[2]
 Übersicht 2 der Friedel-Crafts-Alkylierung
Übersicht 2 der Friedel-Crafts-Alkylierung
Reaktionsmechanismus
Der Mechanismus wird im folgenden Abschnitt an der Reaktion eines Alkylchlorids mit Benzol erläutert. Die Friedel-Crafts-Alkylierung wird dadurch eingeleitet, dass die Lewissäure an das Chlor des Alkylhalogenids 1 koordiniert und dadurch den benachbarten Kohlenstoff noch weiter positiviert (2). Der so gebildete Komplex kann als elektrophiles Reagenz wirken. Für den Fall, dass der Alkylrest in der Lage ist, ein stabiles Carbeniumion 3 zu bilden (z. B. tert.-Butyl-Kation), kann auch dieser den Aromaten (hier: Benzol) elektrophil angreifen. Dabei wird vorübergehend die Aromatizität des Rings aufgehoben. Nach der Abgabe eines Protons rearomatisiert das vorläufige Endprodukt 5.[3]
 Mechanismus der Friedel-Crafts-Alkylierung
Mechanismus der Friedel-Crafts-Alkylierung
Alkene als Alkylierungsreagenz und andere Varianten
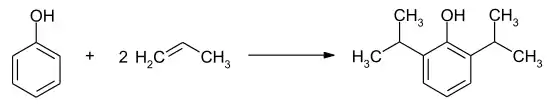
Als alternative Alkylierungsreagenzien (Edukte, Ausgangsstoffe) werden bei der Friedel-Crafts-Alkylierung auch Alkohole oder Alkene genutzt. Diese müssen jedoch zunächst durch Katalysatoren aktiviert werden. Neben Aluminiumchlorid können unter anderem auch Eisen(III)-chlorid und -bromid, Phosphorsäure, Schwefelsäure, Fluorwasserstoff oder Quecksilber(II)-sulfat als Katalysator verwendet werden. Die Herstellung von Propofol erfolgt durch eine Friedel-Crafts-Alkylierung von Phenol mit Propen:[4][5]
Auch die Synthese von Butylhydroxytoluol, eine vielseitige und technisch bedeutende Verbindung, erfolgt nach diesem Mechanismus.
Mehrfachsubstitution
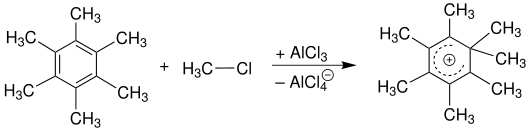
Eine bereits vorhandene Alkylgruppe am Aromaten aktiviert den Ring gegenüber weiteren Substitutionsreaktionen. Der Grund dafür ist ihr positiver Induktiver Effekt (+I). Das hat zur Folge, dass bei Alkylierungen oft mehrfachsubstituierte Produkte isoliert werden können. Polyalkylaromaten können durch einen Überschuss an Alkylierungsreagenz gewonnen werden. Im Fall von Benzol ist dabei zu beachten, dass durch das Einführen eines Alkylrestes in einen unsubstituierten Ring die Äquivalenz der Positionen am Ring abhandenkommt. Substituenten haben einen sogenannten dirigierenden Einfluss auf die Position der nachfolgenden Substitutionsreaktion. Man spricht von ortho-, meta- und para-dirigierenden Substituenten (siehe dazu: Konstitution, Konstitutionsisomerie). Die Mehrfachsubstitution ist meist unerwünscht, da aufgrund des geringen induktiven Effekts der Alkylgruppe oftmals ein Produktgemisch aus mehreren Isomeren erhalten wird. Wegen der durch jede neu hinzugefügte Alkylgruppe gesteigerten Affinität des Aromaten gegenüber Elektrophilen ist es beispielsweise möglich, bei Hexamethylbenzol eine siebte Methylgruppe einzuführen. Die Reaktion endet dann mit einem relativ stabilen Phenoniumion.
Um einfachsubstituierte Produkte zu erhalten, kann unter anderem mit einem Überschuss des Aromaten gearbeitet werden. Die Überreaktion unterbleibt in diesem Fall, weil aus statistischen Gründen nur das überschüssige Ausgangsmaterial und nicht das einfachsubstituierte Produkt angegriffen wird. Auch kann eine Mehrfachsubstitution verhindert werden, wenn das Primärprodukt aus sterischen Gründen keine weitere Alkylgruppe aufnehmen kann, und zu guter Letzt bieten auch noch intramolekulare Friedel-Crafts-Alkylierungen die Möglichkeit einer selektiven Monoalkylierung. Reaktionen dieses Typs sind Ringschlussreaktionen. Die wenigen Möglichkeiten zur selektiven Monoalkylierung sind der Grund dafür, dass die Friedel-Crafts-Alkylierung für teure Benzolderivate nicht geeignet ist.
Problem durch Umlagerung
Probleme tauchen besonders bei der Umsetzung primärer Alkylhalogenide und Alkohole auf. Das hieraus durch Einwirkung des Katalysators entstandene primäre Carbeniumion neigt dazu, sich durch Umlagerung zu stabilisieren. Meist tritt hierbei die Wagner-Meerwein-Umlagerung auf. Das hieraus entstandene isomere Carbeniumion kann nun ebenfalls als Elektrophil dienen, was zur Bildung unerwünschter Nebenprodukte führt.
Transalkylierung
Die Friedel-Crafts-Alkylierung ist eine reversible Reaktion. Daher lassen sich Alkylreste von Alkylaromaten durch Erhitzen und unter Einfluss eines Katalysators auf andere Aromaten übertragen.
Kinetische und thermodynamische Kontrolle
Unter relativ milden Reaktionsbedingungen sind Alkylgruppen ortho- und para-dirigierend. Es entsteht das kinetisch kontrollierte Endprodukt. Bei höherer Temperatur oder mit starken Lewis-Säuren entstehen bevorzugt die thermodynamisch stabileren meta-Produkte.
Literatur
- Magnus Rueping, Boris J Nachtsheim: A review of new developments in the Friedel–Crafts alkylation – From green chemistry to asymmetric catalysis. In: Beilstein Journal of Organic Chemistry. Band 6, 20. Januar 2010, doi:10.3762/bjoc.6.6.
Einzelnachweise
- Eintrag zu Friedel-Crafts-Reaktion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Oktober 2013.
- G. A. Olah: Friedel-Crafts and Related Reactions. Wiley, New York 1963–1964, Band 1 und 2.
- T. Laue, A. Plagens: Namens- und Schlagwort-Reaktionen der Organischen Chemie. 5. Auflage, Teubner Studienbücher Chemie, 2006, ISBN 3-8351-0091-2, S. 133.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2001, ISBN 1-58890-031-2.
- A. J. Kolka, J. P. Napolitano, G. G. Ecke: The ortho-Alkylation of Phenols. In: J. Org. Chem. 21, 1956, S. 712–713, doi:10.1021/jo01112a621.