Charakteristische Röntgenstrahlung
Die charakteristische Röntgenstrahlung ist ein Linienspektrum von Röntgenstrahlung, welches bei Übergängen zwischen Energieniveaus der inneren Elektronenhülle entsteht und für das jeweilige Element kennzeichnend ist. Sie wurde durch Charles Glover Barkla entdeckt, der dafür 1917 den Nobelpreis für Physik erhielt.
Entstehung
Die charakteristischen Linien des Röntgenspektrums (, ,…) entstehen im Bild des Schalenmodells wie folgt:
- Eines der freien, energiereichen Elektronen des Elektronenstrahles schlägt ein entsprechend der Elektronenkonfiguration in der inneren Schale seines Atoms gebundenes Elektron heraus. Dabei muss auf das gestoßene Elektron mindestens soviel Energie übertragen werden, wie zum Sprung auf eine noch unbesetzte Schale nötig ist. Meist ist die Stoßenergie größer als die vorherige Bindungsenergie des Elektrons und das Atom wird ionisiert.
- Die entstandene Lücke wird durch ein Elektron einer weiter außen liegenden Schale geschlossen. Dazu muss das höherenergetische Elektron der weiter außen liegenden Schale die Differenz seiner Energie beim Wechsel auf eine weiter innen gelegene Schale abgeben. Es strahlt ein Photon (Strahlungsquantum) ab.
Die Photonenenergie liegt typischerweise in der Größenordnung 1–100 keV entsprechend der Energiedifferenz der Elektronenhülle in den beiden Zuständen (fehlendes Elektron in innerer Schale und in äußerer Schale) und liegt daher im elektromagnetischen Spektrum im Röntgenbereich. Die Strahlungsquanten besitzen also die Energiedifferenz zwischen höherer (z. B. L-) und niedrigerer (z. B. K-)Schale. Da diese Energiedifferenz elementspezifisch ist, nennt man diese Röntgenstrahlung Charakteristische Röntgenstrahlung.
Die Wellenlänge und damit die Energie der emittierten Strahlung kann mit dem moseleyschen Gesetz berechnet werden.
Bezeichnung der Spektrallinien
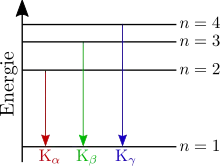
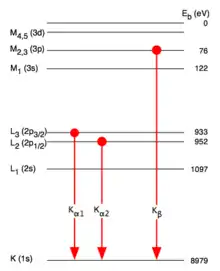
Zur Bezeichnung der Röntgenlinien gibt man zunächst die innere Schale an, in die das Elektron bei der Emission übergegangen ist, z. B. K, L, M usw. Ein griechischer Buchstabe als Index gibt die Differenz zur Hauptquantenzahl n der äußeren Schale an, aus der das Elektron kam. Z. B. entspricht
- ein Index einem von 1, d. h. der nächsthöheren Schale (für die K-Serie ist das die L-Schale)
- ein Index einem von 2 (für die K-Serie ist das die M-Schale) usw.
Bei den L- und M-Serien sowie bei Atomen mit höherer Ordnungszahl ist diese Zuordnung nicht mehr eindeutig. Hier spielt die Feinstrukturaufspaltung eine Rolle. Zusätzlich zum griechischen Index wird dann noch ein numerischer Index zur Unterscheidung der Linien verwendet.
Auftreten mehrerer Spektrallinien nach einer Elektronenanregung
Atome mit höherer Ordnungszahl haben mehrere äußere Schalen, die zur Auffüllung des Lochs in der inneren Schale ein Elektron liefern können. Auch kann das Loch in verschiedenen inneren Schalen entstehen. Dementsprechend können diese Atome auch Röntgenstrahlen unterschiedlicher Energie aussenden.
- Nachdem ein Elektron z. B. von der L- auf die K-Schale gefallen ist, ist wiederum die L-Schale unterbesetzt. Ein weiteres Elektron aus einer noch höheren Schale fällt herunter unter Aussendung eines weiteren Photons. Dieses zweite Photon ist von niedrigerer Energie und trägt in diesem Beispiel zur L-Linie bei.
- Neben der Röntgenemission bildet – besonders bei leichten Atomen mit Ordnungszahlen – die Übertragung der Energie auf weiter außen gelegene Elektronen eine andere Möglichkeit für den Ausgleich der Energiedifferenz (siehe Auger-Effekt).
Erzeugung in der Röntgenröhre
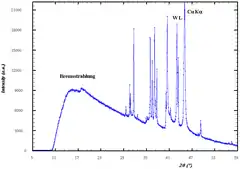
In einer Röntgenröhre treffen energiereiche Elektronen auf eine Anode und erzeugen dort sowohl charakteristische Röntgenstrahlung als auch Bremsstrahlung. Im graphisch dargestellten Spektrum erscheinen die Linien der charakteristischen Röntgenstrahlung als hohe Erhebungen (Peaks) auf dem kontinuierlichen Untergrund der Bremsstrahlung.
Anwendung
Die charakteristische Röntgenstrahlung wird mit Detektoren beobachtet, die die Energie oder die Wellenlänge der Röntgenquanten bestimmen. Aus dem Spektrum kann qualitativ auf die Elementzusammensetzung der Probe geschlossen werden, durch eine ZAF-Korrektur ist außerdem auch eine quantitative Analyse möglich. Dieses Prinzip wird bei der Röntgenfluoreszenzanalyse, der energiedispersiven (EDX/EDS) und der wellenlängendispersiven Röntgenspektroskopie (WDX/WDS) angewandt.
Weblinks
- Datenbank (X-Ray Transition Energies Database) für die Energien der charakteristischen Röntgenstrahlung (theoretisch und experimentell) verschiedener Stoffe (engl.)
- LP: Charakteristische Strahlung, Georg-August-Universität Göttingen. Hinweise insbesondere auch zur Notation.