Ammoniumparawolframat
Ammoniumparawolframat (APW bzw. APT für engl. ammonium paratungstate) ist ein farbloses, kristallines Wolfram-Salz mit der chemischen Formel (NH4)10(H2W12O42)·4 H2O.[3]
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
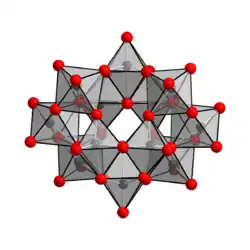 | |||||||||||||
| Anion [H2W12O42]10− in der Kristallstruktur von Ammoniumparawolframat _ W6+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumparawolframat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | (NH4)10(H2W12O42)·4 H2O | ||||||||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 3132,5 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
2,3 g·cm−3[1] | ||||||||||||
| Siedepunkt |
Zersetzung über 200 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||

Herstellung
Ammoniumparawolframat ist ein Zwischenprodukt bei der Aufbereitung von wolframhaltigen Erzen und wird durch Fällung von Wolframat-Ionen mit Ammoniumionen erhalten. Unterhalb von 50 °C bildet sich das Undecahydrat, während bei Temperaturen oberhalb 50 °C das „Pentahydrat“ ausfällt.[4] Ersteres kristallisiert triklin in Form von Plättchen oder Prismen, während Letzteres pseudo-orthorhombische Nadeln bildet.
Wolframhaltige Erze wie Scheelit (CaWO4) oder Wolframit ((Mn,Fe)WO4) werden zunächst durch Vermahlung und Flotation auf Konzentrationen von 10 bis 75 % angereichert. Das angereicherte Erz wird anschließend in einer oxidierenden Atmosphäre bei 500–600 °C calciniert, um Verunreinigungen, wie Additive aus dem Flotationprozeß, zu entfernen. Wolframit-Erze werden danach mit Natronlauge, Scheelit-Erze mit einer Natriumcarbonat-Lösung umgesetzt, wobei sich Natriumwolframat Na2WO4 bildet, welches danach durch eine Reihe von Umfällungen gereinigt wird. Aus der erhaltenen gereinigten Lösung wird durch Flüssig-Flüssig-Extraktion oder Ionenaustausch das Ammoniumparawolframat gewonnen. Wolframhaltige Schrotte wie Hartmetall-Schrott können nach einer Oxidation ebenfalls in Natriumwolframat und danach in Ammoniumwolframat überführt werden.[5]
Ammoniumparawolframat ist die weltweit allgemein übliche Handelform für wolframhaltige Rohstoffe und wird in der Regel in MTU's (metric ton unit) gehandelt, wobei eine MTU 10 kg WO3 enthält.
Struktur
In neuerer Literatur wird das Anion in Ammoniumparawolframat als [H2W12O42]10−, welches zwei Wasserstoffatome innerhalb eines Käfigs enthält, beschrieben. Der Wolfram-Sauerstoff-Käfig, welcher das Zentrum das Anions bildet, enthält 42 Sauerstoffatome. Entsprechend ist die korrekte Summenformel von Ammoniumparawolframat (NH4)10[H2W12O42]·4 H2O und nicht wie früher in der Literatur beschrieben ein „Pentahydrat“ vom Typ (NH4)10[W12O41]·5H2O mit fünf Kristallwasser. Das [H2W12O42]10−-Anion wird als Parawolframation vom Typ B bezeichnet, im Gegensatz zum Parawolframation, Typ A, welches die Summenformel [W7O24]6−, entsprechend dem Paramolybdation, besitzt. Die Existenz des Parawolframat-Typ-A-Anions, konnte durch NMR-Spektroskopie bisher nicht nachgewiesen werden.[6] Ammoniumparawolframat kristallisiert monoklin, Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2), mit den Gitterparametern a = 15,08 Å, b = 14,45 Å, c = 11,00 Å und β = 109,4°.[7]
Reaktionen
Ammoniumparawolframat kann durch thermische Zersetzung bei einer Temperatur von 600 °C in Wolfram(VI)-oxid WO3 umgewandelt werden.
Die thermische Zersetzung von APW erfolgt in 4 Schritten:[2]
- 1. Schritt (endotherme Reaktion zwischen 50 und 190 °C): Im ersten Schritt wird ausschließlich das gebundene Kristallwasser aber kein Ammoniak freigesetzt. Das Maximum der Freisetzung liegt bei 159 °C.
- 2. Schritt (endotherme Reaktion zwischen 190 und 250 °C): Im nächsten Schritt kommt es zu einer Freisetzung von Ammoniak aus den Ammoniumionen unter Zurücklassung von Protonen.
- 3. Schritt (endotherme Reaktion zwischen 250 und 380 °C): Im dritten Schritt kommt es zu einer weiteren Freisetzung von 6,3 mol Ammoniak zusammen mit einer korrespondierenden Menge von 4,5 mol Wasser. In diesem Schritt bricht die – bis dahin weitgehend intakte – Kristallstruktur des Anions zusammen, wodurch das Produkt röntgenamorph wird.
- 4. Schritt (exotherme Reaktion oberhalb 380 °C): Im letzten Schritt werden die restlichen Mengen an Ammoniak und Wasser freigesetzt und das verbleibende Wolframtrioxid kristallisiert unter Freisetzung von Wärme.
Verwendung
APW dient vor allen Dingen als Zwischenprodukt bei der Aufbereitung von wolframhaltigen Erzen zu Wolfram oder Wolframverbindungen. Es wird technisch durch Reduktion in einer Wasserstoff-Atmosphäre unter Abspaltung von Wasserdampf in elementares Wolfram-Pulver überführt, aus welchem durch Sintern verschiedene Formen, wie Drähte oder Blöcke hergestellt werden können.[8] Durch Carburierung erhält man Wolframcarbid, das insbesondere in der Hartmetallindustrie verwendete wird.
Einzelnachweise
- Datenblatt Ammonium (para)tungstate hydrate bei Sigma-Aldrich, abgerufen am 23. Januar 2013 (PDF).
- M. J. G. Fait, H.-J. Lunk, M. Feist, M. Schneider, J. N. Dann, T. A. Frisk: Thermal decomposition of ammonium paratungstate tetrahydrate under non-reducing conditions: Characterization by thermal analysis, X-ray diffraction and spectroscopic methods. In: Thermochimica Acta. Band 469, Nr. 6, 2008, S. 12–22, doi:10.1016/j.tca.2007.12.007.
- Free Online Dictionary: Ammonium paratungstate – What does APT stand for?
- K. Hempel,M. Saradshow: Löslichkeit und stabile Kristallhydrate im System Ammoniumparawolframat–Wasser. In: Kristall und Technik, Vol. 2, Bd. 3, S. 437–445, 1967 doi:10.1002/crat.19670020316.
- Sverker Wahlberg: Nanostructured Tungsten Materials by Chemical Methods. Dissertation 2011, urn:nbn:se:kth:diva-42702
- A. Earnshaw, Norman Greenwood: Chemistry of the Elements. 2. Auflage. Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4, S. 1012–1014.
- H. d'Amour, R. Allmann: Die Kristallstruktur des Ammoniumparawolframat-tetrahydrats (NH4)10H2W12O42(H2O)4. In: Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie, 136, 1972, S. 23–47, doi:10.1524/zkri.1972.136.1-2.23.
- D. J. Jones: Practical aspects of sintering tungsten and molybdenum. In: Journal of the Less Common Metals. Band 2, Nr. 2–4, April 1960, S. 76–85, doi:10.1016/0022-5088(60)90002-3. Zitiert nach: J.C. Bailar Jr. et al.: Comprehensive Inorganic Chemistry. Vol. 3, 1973, S. 744.
