Sterilisation
Mit Sterilisation, Sterilisierung und Entkeimung bezeichnet man Verfahren, durch die Materialien und Gegenstände von lebenden Mikroorganismen einschließlich ihrer Ruhestadien (z. B. Sporen) befreit werden. Den damit erreichten Zustand der Materialien und Gegenstände bezeichnet man als „steril“.


Die ebenfalls an Stelle von „steril“ verwendete Bezeichnung „keimfrei“ ist nicht präzise genug ausgedrückt, weil es sich bei der Sterilisation nicht nur um die Entfernung oder Abtötung von bestimmten Entwicklungsstadien der Mikroorganismen, nämlich Keimen, handelt, sondern um die Entfernung oder Abtötung aller Mikroorganismen in jedem Entwicklungsstadium. Die Bezeichnung „keimfrei“ hängt zusammen mit der falschen Bezeichnung „Keim“ für Mikroorganismen in jedem Entwicklungsstadium.
Bei der Sterilisation von Materialien (z. B. Lebensmittel, Pharmazeutika, Lösungen), medizinischen Instrumenten, Implantaten, Gegenständen, Verpackungen, Geräten (z. B. Endoskope) und Gefäßen (z. B. zur Kultur von Mikroorganismen) werden (im Idealfall) alle enthaltenen oder anhaftenden Mikroorganismen einschließlich deren Dauerformen (beispielsweise Sporen) abgetötet sowie Viren, Prionen (infektiöse Proteine), Plasmide und andere DNA-Fragmente zerstört.
In der Praxis gelingt eine vollständige Sterilisation nicht mit 100%iger Sicherheit. Es wird deshalb eine Reduktion der Anzahl an vermehrungsfähigen Mikroorganismen um einen je nach Anwendungsbereich bestimmten Faktor (in Zehnerpotenzen) gefordert oder eine bestimmte Wahrscheinlichkeit der vollständigen Sterilisation. Zum Beispiel wird gefordert, dass der Restgehalt an vermehrungsfähigen Mikroorganismen in einer Einheit des Sterilisierguts höchstens 10−6 beträgt, das heißt: In einer Million gleichbehandelten Einheiten des Sterilisierguts darf nur ein vermehrungsfähiger Mikroorganismus enthalten sein.
Die Sterilisation erfolgt durch physikalische (thermisch, Bestrahlung) oder chemische Verfahren.
In der technischen Abgrenzung zur Desinfektion wird bei der Sterilisation in der Regel eine um eine Zehnerpotenz höhere Wahrscheinlichkeit der vollständigen Sterilisation gefordert.
Thermische Sterilisation
Für die Sterilisation durch Erhitzen ist die Absterbe-Kinetik von Mikroorganismen von Bedeutung. Das Absterben in einer Mikroorganismen-Population ähnelt dem Zerfall radioaktiver Elemente insofern, als die Anzahl der Überlebenden bei sich nicht vermehrenden Mikroorganismen exponentiell mit der Zeit abnimmt (so wie die Anzahl der noch nicht zerfallenen Atome eines radioaktiven Elements). In jeder Zeiteinheit ist der Anteil der abgestorbenen Individuen einer Population gleich.
Dezimalreduktionszeit
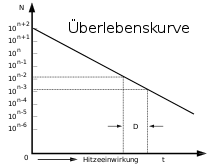
Man bezeichnet die Zeit, in der neun Zehntel der Population absterben, die Population also auf ein Zehntel reduziert wird, als Dezimalreduktionszeit D (D-Wert). Diese Zeit ist stark von der Art oder dem Stamm des Mikroorganismus, der Temperatur und weiteren Bedingungen abhängig, vor allem der Wasseraktivität, dem pH-Wert sowie der Ionenstärke. Die Dezimalreduktionszeit wird als und typischerweise mit der Temperatur als Index bezeichnet. Nimmt man an, dass die Sterbegeschwindigkeit proportional zur Anzahl der Keime ist, dann ist der Restkeimgehalt gegeben durch:
mit Anfangskeimzahl , Keimzahl und der Sterilisationszeit .
Typischerweise wird für die Sterilisation gefordert, dass die Anzahl der lebenden Individuen um sechs Zehnerpotenzen (also auf ein Millionstel, ) vermindert wird, daher muss die Dauer der Sterilisation mindestens das Sechsfache der Dezimalreduktionszeit betragen. Für Desinfektion wird zum Vergleich eine Reduktion auf gefordert. Die konkrete Anzahl der Organismen ist dabei von der Ausgangzahl abhängig, die je nach Aufgabe schwer oder unmöglich zu ermitteln sein kann. Daher ist es besser die Dezimalreduktionszeit als Überlebenswahrscheinlichkeit zu deuten. Ein Mikroorganismus hat eine Überlebenswahrscheinlichkeit von 10 %, wenn er den Bedingungen ausgesetzt wird. Theoretisch ist die Überlebenswahrscheinlichkeit nie null.
Die Dezimalreduktionszeit unter standardisierten Bedingungen ist umgekehrt ein Maß für die Resistenz eines Mikroorganismus gegen die Sterilisationsbedingungen. Beispiele für Dezimalreduktionszeiten von Bakterien-Endosporen in Wasser (Wasseraktivität ), bei 121 °C in Minuten
| Bakterien-Art | D121 °C / Minuten |
|---|---|
| Bacillus subtilis | 0,4–0,8 |
| Bacillus cereus | 0,03–2,3 |
| Bacillus stearothermophilus | 2,0–5,0 |
| Bacillus polymyxa | ~0,005 |
| Clostridium botulinum | 0,1–0,2 |
| Clostridium sporogenes | 0,1–1,5 |
| Clostridium thermosaccharolyticum | 69–70 |
| Desulfotomaculum nigrificans | 2,0–3,0 |
Die Dezimalreduktionszeiten liegen bei Bakterien-Endosporen im trockenen Zustand wesentlich höher. Deshalb sind zum Sterilisieren im trockenen Zustand höhere Temperaturen und längere Einwirkzeiten erforderlich (siehe unten „Erhitzen im trockenen Zustand“).
Für ein Individuum bedeutet diese Absterbekinetik: Die Wahrscheinlichkeit, dass es beim Erhitzen während der Zeitdauer D abgetötet wird, beträgt immer 90 %, die Wahrscheinlichkeit des Überlebens beträgt 10 %. Die Wahrscheinlichkeit, dass es in der nächsten Zeitspanne D abgetötet wird, ist wieder 90 %, die Wahrscheinlichkeit, dass es in der Zeit 2 D abgetötet wird, beträgt also immer 99 %.
Daraus geht hervor: Eine vollständige Sicherheit, dass nach einer bestimmten Erhitzungsdauer alle Mikroorganismen in einem Sterilisiergut abgetötet sind, kann nicht erreicht werden. Ist nach einer Erhitzung nur noch 1 vermehrungsfähiges Individuum vorhanden, so ist nach weiterem Erhitzen für die Dauer von D nicht sicher, dass dieses Individuum abgetötet ist, sondern die Wahrscheinlichkeit beträgt nur 90 %, in 10 % der Fälle überlebt das Individuum dieses Erhitzen. Ein weiteres Erhitzen über eine Zeit von 2 D erhöht die Wahrscheinlichkeit des Abtötens nur auf 99 %, in 1 % der Fälle überlebt das Individuum auch dieses Erhitzen, und so fort. Eine Sterilisation eines Sterilisierguts kann also nur mit einer gewissen Wahrscheinlichkeit erreicht werden.
Beispielsweise können Dosenkonserven niemals mit vollständiger Sicherheit durch Erhitzen sterilisiert werden. Aus dem oben Gesagten geht hervor, dass hierbei der anfängliche Gehalt an hitzeresistenten Bakterien-Endosporen von großem Einfluss ist. Die erforderliche Zeit der Erhitzung auf eine bestimmte Temperatur richtet sich nach der gewünschten Wahrscheinlichkeit der vollständigen Sterilisation und nach dem Ausgangsgehalt an Bakterien-Endosporen. Sind anfänglich etwa 104 Endosporen je Dose enthalten, so wird nach einer Erhitzungsdauer von 4 D im Mittel je Dose eine Endospore überleben, ein völlig unzureichendes Ergebnis. Bei 5 D sind mehr als 90 % der Dosen steril, bei 6 D 99 %. Dies mag bei Dosenkonserven unter Umständen ausreichend sein, bei anderem Sterilisiergut ist das oft unzureichend, zum Beispiel bei Infusionslösungen für die medizinische Anwendung. Bei einem Ausgangsgehalt von 105 Endosporen ist zum Erreichen derselben Sicherheit eine Erhitzungsdauer von 7 D erforderlich.
12D-Konzept
Bei der Hitzesterilisation von Dosenkonserven wird oft das sogenannte 12D-Konzept angewendet. Dabei nimmt man an, dass je Portion (Dose) vor der Sterilisation nicht mehr als etwa 106 Bakterienendosporen (die hitzeresistentesten Lebensformen) enthalten sind, und dass die Portionen mit einer Wahrscheinlichkeit von 1 × 106 steril sein sollen (das bedeutet, unter einer Million Portionen soll nur eine Portion noch lebende Mikroorganismen enthalten, der Mikroorganismengehalt je Portion soll also 10−6 sein). Dann ist also der Gehalt an Endosporen durch das Erhitzen um 12 Zehnerpotenzen zu vermindern. Die bei der Temperatur T erforderliche Erhitzungsdauer tT ist also
Zur Wahl des Werts für DT: In der Praxis liegen im Sterilisiergut fast immer Mischpopulationen vor, deren Komponenten verschiedene DT-Werte besitzen. Da weiterhin in der Praxis die Mikroorganismengehalte über eine große Anzahl von Zehnerpotenzen vermindert werden müssen, muss die Erhitzungsdauer mit dem höchsten DT-Wert derjenigen Mikroorganismen berechnet werden, die in einer nicht zu vernachlässigenden Konzentration enthalten sind, auch wenn der Gehalt an deutlich hitzeempfindlicheren Mikroorganismen, also mit deutlich niedrigerem DT, wesentlich höher ist. Beispiel: Angenommen, der Gehalt an Mikroorganismen mit einem DT = 1,0 ist 106, der an Mikroorganismen mit einem DT = 2,0 ist 101. Dann sind für die Verminderung auf einen Gehalt von jeweils 10−6 die zugehörigen Erhitzungszeiten tT für die einzelnen Gruppen 12 × 1,0 = 12 min und 7 × 2,0 = 14 min. Obwohl der Gehalt an hitzeempfindlicheren Mikroorganismen (DT = 1,0) hunderttausendmal höher ist als der der doppelt hitzeresistenteren (DT = 2,0), muss dennoch der F-Wert mit dem D-Wert der hitzeresistenteren Mikroorganismen berechnet werden, da sonst nicht die gewünschte Wahrscheinlichkeit der Sterilität erreicht wird.
z-Wert
Die Absterberate von Mikroorganismen nimmt mit der Temperatur zu, der D-Wert also ab. Die Abhängigkeit des D-Werts von der Temperatur wird durch den z-Wert charakterisiert. Er gibt an, um welchen Betrag die Temperatur erhöht werden muss, um den D-Wert auf ein Zehntel zu vermindern, also um den Abtötungseffekt auf das Zehnfache zu steigern. Dafür gilt folgende Formel:
Wie der D-Wert ist auch der z-Wert charakteristisch für verschiedene Mikroorganismen.
F-Wert
Beim Sterilisieren durch Erhitzen ist eine Aufheiz- und eine Abkühlungsphase zu durchlaufen, während derer auch letale Temperaturen erreicht werden, die aber nicht so wirksam sind wie die höhere Temperatur der Haltephase. Diese Phasen tragen aber auch zum Sterilisationseffekt bei. Um für den Gesamteffekt ein einfaches Maß zu haben, wurde der F-Wert eingeführt. Er ist ein Maß für die Summe aller Abtötungseffekte während des gesamten Erhitzungsprozesses einschließlich Aufheiz-, Halte- und Abkühlungsphase, angegeben als Zeitäquivalent für eine Referenztemperatur. Die Abtötungseffekte sind in der Aufheiz- und der Abkühlungsphase wegen der geringeren Temperaturen geringer als in der Haltephase, und zwar abhängig vom z-Wert, der für die jeweiligen Mikroorganismen charakteristisch ist.
In der Praxis wählt man als Referenztemperatur 121,1 °C (entspricht 250 °F) und als z-Wert 10. Der sich daraus ergebende Wert wird als F0-Wert bezeichnet. Er wird in Minuten angegeben. Ein F0-Wert von 8 bedeutet also, dass der gesamte Erhitzungsvorgang auf Mikroorganismen mit dem z-Wert 10 den gleichen Abtötungseffekt hat wie eine Erhitzung von 8 min bei 121,1 °C.[1]
C-Wert
Wichtig in diesem Zusammenhang ist noch der C-Wert (cooking). Es gilt C(z) = t X 10^((T-RT)/z), wobei z der z-Wert, t die Zeit in Minuten, T die Behandlungstemperatur, RT die Referenztemperatur und C der Kochwert in Minuten ist.
Erhitzen im feuchten Zustand: Dampfsterilisation
.JPG.webp)
Die Dampfsterilisation (Erhitzen im Autoklaven) ist das Standardverfahren in den meisten Labors und Krankenhäusern (ZSVA) und wird auch bei der Haltbarmachung von Lebensmitteln in Konservendosen und Glasverpackungen angewendet. Dabei wird das Sterilisier- oder Füllgut 20 Minuten auf 121 °C bei zwei bar Druck in Wasserdampf erhitzt oder 5 Minuten auf 134 °C bei 3 bar. Zur Zerstörung von Prionen wird 18 Minuten auf 134 °C bei 3 bar erhitzt.[2]
Die Luft im Inneren des Autoklaven wird dabei vollständig durch Wasserdampf ersetzt. Die tatsächliche Dauer eines Sterilisationsvorganges hängt von verschiedenen technischen Ausführungen der Autoklaven ab, wie Größe, Heizleistung, Vakuumpumpen und weiteren technischen Faktoren. Die Autoklaven fallen unter die Druckgeräterichtlinie und Medizinproduktegesetz bzw. Medizinprodukte-Betreiberverordnung und bedürfen daher einer ständigen technischen Überwachung und Sicherheitskontrolle.
| Resistenzstufe | Organismus/Krankheitserreger | Temperatur (°C) | Zeit (min) |
|---|---|---|---|
| I | Pathogene Streptokokken, Listerien, Polioviren | 61,5 | 30 |
| II | die meisten vegetativen Bakterien, Hefen, Schimmelpilze, alle Viren außer Hepatitis-B | 80 | 30 |
| III | Hepatitis-B-Viren, die meisten Pilzsporen | 100 | 5–30 |
| IV | Bacillus-anthracis-Sporen | 105 | 5 |
| V | Bacillus-stearothermophilus-Sporen | 121 | 15 |
| VI | Prionen | 132 | 60 |
Erhitzen im trockenen Zustand: Heißluftsterilisation


- Das Ausglühen von metallischen Gegenständen durch Rotglut, etwa 500 °C, ist gebräuchlich bei mikrobiologischen Laborarbeiten.
- Das Abflammen (Flambieren) ist ein kurzes Ziehen des Gegenstandes durch eine Flamme.
- Heißluftsterilisation für Glas, Metalle, Porzellan („backen“), bei
- 180 °C mindestens 30 min,
- 170 °C mindestens 60 min,
- 160 °C mindestens 120 min.
Geräte, die hierfür benutzt werden:
- Heißluft-Sterilisationsschrank für diskontinuierliche Sterilisation
- Heißluft-Sterilisationstunnel für kontinuierliche Sterilisation
- konventionelle Heizung, 240 bis 320 °C
- eingedüste Heißluft, 300 bis 400 °C
- Laminar-Flow-Heißluft
Fraktionierte Sterilisation
Die Fraktionierte Sterilisation wird nach dem irischen Physiker John Tyndall auch Tyndallisation benannt. Sie kann nur bei einem Sterilisiergut verwendet werden, in dem hitzeresistente Stadien der darin vorhandenen Mikroorganismen (z. B. Bakterienendosporen) auskeimen können. Das Sterilisiergut wird an mehreren aufeinander folgenden Tagen jeweils auf etwa 100 °C erhitzt und dazwischen bei Raumtemperatur gelagert. Bei der Zwischenlagerung sollen die durch das Erhitzen nicht abgetöteten Sporen auskeimen und die dadurch entstandenen, nicht hitzeresistenten Mikroorganismen-Stadien sollen beim Erhitzen am nächsten Tag abgetötet werden. Die Prozedur muss wiederholt werden, damit sichergestellt wird, dass alle Sporen auskeimen und gegebenenfalls zwischen zwei Erhitzungen eventuell neu gebildete Sporen ebenfalls wieder auskeimen und abgetötet werden.
Chemische Sterilisation

Mit dem Ausdruck Chemische Sterilisation (auch Gassterilisation genannt) bezeichnet man eine Sterilisation mit bestimmten chemischen Stoffen, wie Formaldehyd, Ethylenoxid oder Peressigsäure. Hierbei ist zu beachten, dass das aufzubereitende Sterilisiergut sauber und trocken ist und darüber hinaus in speziell gasdurchlässige Folien gepackt wurde. Die chemische Sterilisation wird in der Regel bei thermolabilen Materialien, wie Endoskop-Optiken eingesetzt. Bei thermostabilen Materialien ist immer eine Dampfsterilisation einer chemischen Sterilisation vorzuziehen.
Nassantiseptik
Die Abtötung der Mikroorganismen erfolgt durch Chemikalien, welche in flüssiger Form auf die zu sterilisierenden Gegenstände aufgebracht werden. Zum Beispiel wird in der Getränketechnik per Kaltentkeimung von Getränken oder der Sterilisation von Behältern mit Wasserstoffperoxid, gelöstem Ozon oder Peressigsäure sterilisiert. Ein kritischer Parameter bei allen nassantiseptischen Verfahren ist die Temperatur der sterilisierenden Lösung. In der Regel kann durch Erhöhung der Temperatur die zur Sterilisation nötige Einwirkzeit drastisch verkürzt werden. Um die Chemikalien vom sterilisierten Objekt zu entfernen, wird typischerweise anschließend mit sterilem Wasser gewaschen.
Trockenantiseptik


Mit „Trockenantiseptik“ bezeichnet man eine nicht scharf definierte Gruppe von Sterilisationsverfahren. Die Abtötung erfolgt mit Gasen, die auf die trockenen, zu sterilisierenden Gegenstände einwirken. Gassterilisation erfolgt beispielsweise mit Formaldehyd, Ethylenoxid, Ozon oder Wasserstoffperoxid.
Sie kommt vielfach in der kaltantiseptischen Abfüllung von Lebensmitteln, insbesondere Getränken, zur Anwendung: Die zu sterilisierenden Objekte, meist Kunststoffflaschen aus PET oder HDPE, werden vor ihrer Befüllung zunächst mit abtötenden Chemikalien, wie insbesondere Peressigsäureprodukten, ausgewaschen (Nassantiseptik); daraufhin erfolgt eine weitere Abtötung von Mikroorganismen mit Gasen, vorzugsweise mittels gasförmig zugeführtem Wasserstoffperoxid. Die zu sterilisierenden Oberflächen sind, im Gegensatz zur Nassantiseptik, nach der Sterilisation trocken, was einen erheblichen Vorteil darstellt. Apparativer Aufwand und Betriebskosten sind bei Trockenantiseptik in der Regel geringer als bei Nassantiseptik. Jedoch sind die Verfahren technisch schwieriger zu beherrschen und erfordern deutlich mehr Know-how.
Siehe hierzu beispielsweise die Wasserstoffperoxid-Sterilisation, ein trockenantiseptisches Sterilisationsverfahren, das selbst an extrem resistenten Endosporen eine Reduktion der Überlebenden von weit über 106 in Sekundenbruchteilen bewirkt, jedoch im Vakuum.
Physikalische Sterilisation
Hochdrucksterilisation
Die Hochdrucksterilisation beruht auf dem Zerstören von Organismen durch hohen Druck.
Strahlensterilisation
Sterilisation mit Ionisierender Strahlung: entweder mit UV-, Röntgenstrahlung, Gammastrahlung (hauptsächlich radioaktive 60Co-Quellen) oder Elektronenbeschuss (Elektronenstrahlsterilisation; Strahlenergie zwischen 3 und 12 MeV, typische Dosis 25 kGy). Bei der industriellen Auftragssterilisation (z. B. von medizinischen Einwegartikeln) werden Gamma- oder Elektronenbestrahlung in größerem Umfang eingesetzt.
Plasmasterilisation
Die sterilisierende Wirkung von Plasmen ist wissenschaftlich in einer Vielzahl von Untersuchungen prinzipiell nachgewiesen. Dies gilt für Niederdruckentladungen angeregt durch Hochfrequenz oder Mikrowellen bis hin zu Normaldruckentladungen.
Die sterilisierende Wirkung ist dabei einerseits auf die im Plasma generierte UV-Strahlung andererseits auf die Bildung chemisch aggressiver Stoffe (freie Radikale) sowie den Beschuss der Mikroorganismen mit Ionen zurückzuführen. Trotz der prinzipiellen Eignung sind in der Realität (z. B. Auftragssterilisation, Praxen, Lebensmittelindustrie) Plasma-basierte Sterilisationsverfahren noch wenig verbreitet. In Krankenhäusern hat die Plasmasterilisation die Gassterilisation weitgehend abgelöst.[3]
Entsprechende kommerzielle Systeme, die zur Sterilisation von medizinischen Gerätschaften eingesetzt werden und Plasmageneratoren enthalten, verwenden als Reagenzien dampfförmiges Wasserstoffperoxid oder Peressigsäure, so dass die Sterilisationswirkung in nennenswertem Umfang auf an sich mikrobizide Gase zurückgeführt werden kann. In der Lebensmittelindustrie werden aktuell vermehrt Plasmageräte entwickelt, die in der Lage sind, bei Atmosphärendruck zu sterilisieren, z. B. Verpackungsfolien aus Kunststoff.
Bei der Sterilisation von Oberflächen mittels Plasma ist zu beachten, dass die Oberfläche aktiviert wird und gegebenenfalls nach dem Vorgang veränderte Eigenschaften aufweist. Dies ist besonders im Zusammenhang mit der Biokompatibilität von Implantaten relevant. Ein weiteres Problem ist die Tatsache, dass die freien Radikale auch Polymere wie Klebstoffe zersetzen können. Entsprechende Materialkompatibilitätsuntersuchungen sind daher unabdingbar.
Sterilfiltration
Bei der Sterilfiltration werden die Mikroorganismen aus dem Sterilisiergut durch Filtration abgeschieden. Als Filter werden meistens Membranen mit einem Porendurchmesser von 0,22 µm verwendet. Allerdings kann es sinnvoll sein, kleinere Porendurchmesser, etwa 0,1 µm, zu verwenden. Dies ist zum Beispiel der Fall, wenn man zur Herstellung naturnaher bakterieller Kulturmedien Standortwasser wie Meerwasser von den natürlich vorkommenden Bakterien befreien möchte, um es für gezielte Wachstumsexperimente mit bestimmten Bakterienkulturen einzusetzen. Denn Bakterien aus natürlichen, nährstoffarmen Habitaten, wie Böden und Gewässer, sind oft mit Durchmessern von unter 0,22 µm wesentlich kleiner als die in nährstoffreicheren Materialien vorkommenden mit Durchmessern von etwa 0,5 µm.
Bei der Filtration können nur kleine Moleküle die Membran passieren, größere Partikel wie Bakterien werden zurückgehalten. Bakterien der Gattung Mycoplasma passieren allerdings die Membran, weil sie wegen Fehlens einer Zellwand verformbar sind. Auch sehr dünne Spirochaeten, also fadenförmige Bakterien, können sozusagen der Länge nach die Poren der Filtermembran passieren. Sterilfiltration wird oftmals zur Sterilisierung hitzeempfindlicher Lösungen, beispielsweise serumhaltiger Gewebekulturlösungen, eingesetzt. Hauptanwendungen sind die Sterilfiltration von wässrigen Lösungen, hitzeempfindlichen Nährlösungen, Vitaminlösungen, Seren, Virusimpfstoffen, Plasmafraktionen und Proteinlösungen. Nach erfolgter Sterilfiltration ist nach europäischem Arzneibuch auf ausreichende Integrität des Filters mit Hilfe des Bubble-Point-Tests zu prüfen.
Siehe auch
- Aqua ad iniectabilia, steriles Wasser für Injektionszwecke
- Reinigungs- und Desinfektionsgerät
Literatur
- H. Sielaff: Technologie der Konservenherstellung. 1. Auflage. Behr's Verlag, Hamburg 1996, ISBN 3-86022-283-X.
- G. Hartwig, H. von der Linden, H. P. Skrobisch: Thermische Konservierung in der Lebensmittelindustrie. 2. Auflage. Behr’s Verlag, Hamburg 2014, ISBN 978-3-95468-038-2.
Einzelnachweise
- Johannes Krämer, Alexander Prange, Prange, Alexander 1974-: Lebensmittel-Mikrobiologie. 7. Auflage. Verlag Eugen Ulmer, Stuttgart 2017, ISBN 3-8252-4658-2, S. 162.
- Ph. Eur. 5. Ausgabe Seite 652.
- Rainer Klischies, Ursula Panther, Vera Singbeil-Grischkat: Hygiene und medizinische Mikrobiologie Lehrbuch für Pflegeberufe ; mit 62 Tabellen. Schattauer Verlag, 2008, ISBN 978-3-7945-2542-3, S. 207 (eingeschränkte Vorschau in der Google-Buchsuche).