Cannizzaro-Reaktion
Die Cannizzaro-Reaktion ist eine Namensreaktion aus der Organischen Chemie. Sie wurde nach ihrem Entdecker – dem italienischen Chemiker Stanislao Cannizzaro (1826–1910) – benannt. Aldehyde, die an dem Kohlenstoffatom, das in α-Position zur Carbonylgruppe steht, kein Wasserstoffatom gebunden haben, reagieren in dieser Reaktion im stark basischen Medium zu dem Salz einer Carbonsäure und einem Alkohol. Ein stark basisches Medium ist beispielsweise konzentrierte Natronlauge, dann entsteht das Natriumsalz einer Carbonsäure und der Alkohol.
| Aldehyde |
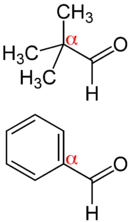 2,2-Dimethylpropionaldehyd (Pivalaldehyd) und Benzaldehyd sind geeignete Edukte für die Cannizzaro-Reaktion, da sie kein Wasserstoffatom am α-Kohlenstoffatom neben der Carbonylgruppe enthalten. |
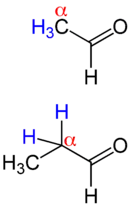 Aldehyde mit blau markierten Wasserstoffatomen am α-Kohlenstoffatom neben der Carbonylgruppe. Diese Aldehyde sind enolisierbar und reagieren unter alkalischen Bedingungen zu Aldolen, eine Cannizzaro-Reaktion läuft nicht ab. |
Ist ein α-ständiges Wasserstoffatom im Aldehyd vorhanden, läuft bevorzugt die Aldolreaktion ab.
Übersichtsreaktion
Bei der Reaktion disproportionieren Aldehyde, die kein Wasserstoffatom in α-Stellung zum aldehydischen Kohlenstoffatom besitzen, in Gegenwart von starken Basen.
 Übersichtsreaktion der Cannizzaro-Reaktion
Übersichtsreaktion der Cannizzaro-Reaktion
Als Oxidationsprodukt entsteht das entsprechende Salz einer Carbonsäure, als Reduktionsprodukt der Alkohol. Die Reste an dem Aldehyden können Alkyl- oder Aryl-Gruppen sein. Die Alkyl-Gruppe darf kein α-Wasserstoffatom besitzen. Darüber hinaus können die Reste identisch sein.[1][2][3]
Reaktionsmechanismus
In diesem Mechanismus wird die Cannizzaro-Reaktion anhand eines allgemeinen Aldehyds, ohne α-Wasserstoffatom, erklärt. Die Reaktion findet beispielhaft in einer wässrigen Lösung konzentrierter Natronlauge statt.
 Mechanismus zur Cannizzaro-Reaktion
Mechanismus zur Cannizzaro-Reaktion
Ein Hydroxidion greift den Aldehyd 1 nucleophil an, so dass sich das einfach deprotonierte Diol 2 bildet. Dieses wird durch ein weiteres Hydroxidion zum Dianion 3 deprotoniert. Unter Ausbildung einer Carbonylgruppe wird ein Hydrid-Ion abgespalten, welches nun wiederum einen Aldehyd an der Carbonylgruppe angreift. Die intermolekulare Hydridwanderung wird durch den elektronenschiebenden Einfluss der O−-Substituenten ermöglicht. Die Hydridübertragung muss innerhalb eines Molekül-Komplexes erfolgen, da die Hydrid-Ionen ansonsten mit den stets in Wasser vorhandenen Protonen zu Wasserstoff reagieren würden. Als Zwischenprodukt entsteht das dem Aldehyd entsprechende Alkoholat 4 und Carboxylat 5. Das Zwischenprodukt 4 wird durch das Lösungsmittel, in einer Säure-Base-Reaktion zum Alkohol 6 protoniert. Das Carboxylat 5 kann nun mit dem Natriumion der Natronlauge als Natriumsalz der entsprechenden Carbonsäure ausfallen (nicht immer).[3][4][5]
Gekreuzte Cannizzaro-Reaktion
Da Carbonsäuren auf anderen Wegen leichter zu synthetisieren sind, wird die Cannizzaro-Reaktion in der Regel zur Gewinnung des Alkohols eingesetzt. Da immer aus einem Mol eines Aldehydes zur Hälfte der Alkohol und zur anderen Hälfte die Carbonsäure entstehen, ist die Atomökonomie der klassischen Cannizzaro-Reaktion gering (nur maximal 50 % des Aldehyds werden zum gewünschten Alkohol reduziert, die anderen 50 % werden oxidiert). Deshalb wird häufiger die „gekreuzte Cannizzaro-Reaktion“ eingesetzt, bei der als zusätzliche Komponente Formaldehyd verwendet wird.
Der Formaldehyd wird von der Base angegriffen und gibt dann ein Hydridion an den zweiten Aldehyd ab, der so zum Alkohol reduziert wird, während aus dem Formaldehyd oxidativ ein Formiat (Salz der Ameisensäure) entsteht:
 Cannizzaro-Reaktion am Beispiel von Formaldehyd
Cannizzaro-Reaktion am Beispiel von Formaldehyd
Diese Maßnahme erhöht die Ausbeute an Alkohol. So entsteht beispielsweise der vierwertige, vier Hydroxygruppen tragende Alkohol Pentaerythrit durch dreifache Aldolreaktion aus Formaldehyd und Acetaldehyd mit anschließender gekreuzter Cannizzaro-Reaktion.
Literatur
- Organikum. 16. Auflage, VEB Deutscher Verlag der Wissenschaften, Berlin 1985, ISBN 3-326-00076-6, S. 490.
- T. A. Geissman: The Cannizzaro Reaction. In: Organic Reactions. 2, Nr. 3, 1944, S. 94–113, doi:10.1002/0471264180.or002.03
Weblinks
Einzelnachweise
- S. Cannizzaro: Ueber den der Benzoësäure entsprechenden Alkohol. In: Justus Liebigs Annalen der Chemie. Band 88, Nr. 1, 1953, S. 129–130, doi:10.1002/jlac.18530880114.
- K. List, H. Limpricht: Ueber das sogenannte Benzoëoxyd und einige andere gepaarte Verbindungen. In: Justus Liebigs Annalen der Chemie. Band 90, Nr. 2, 1854, S. 190–210, doi:10.1002/jlac.18540900212.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington / San Diego / London 2005, ISBN 978-0-12-429785-2, S. 74.
- Peter Sykes: Reaktionsmechanismen – eine Einführung. 8. Auflage. VCH, Weinheim 1982, ISBN 3-527-21090-3 S, S. 244–246.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken NJ 2009, ISBN 978-0-471-70450-8, S. 1477.