Tetanospasmin
Das Tetanustoxin oder Tetanospasmin ist das wichtigste der von Clostridium tetani gebildeten Exotoxine.[2][3] Es ist ein 150 kDa schweres Protein und wird sowohl aktiv von den Bakterien sezerniert als auch bei Lyse von Bakterien freigesetzt. Es wirkt direkt neurotoxisch durch Proteolyse der SNARE-Proteine.
| Tetanospasmin | ||
|---|---|---|
| Masse/Länge Primärstruktur | 1314 = 456+858 Aminosäuren | |
| Kofaktor | Zn2+ | |
| Präkursor | (1315 aa) | |
| Bezeichner | ||
| Gen-Name(n) | tetX | |
| Externe IDs |
| |
| Transporter-Klassifikation | ||
| TCDB | 1.C.8.1.2 | |
| Bezeichnung | Tetanustoxin Familie | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.24.68, Metalloprotease | |
| MEROPS | M27.001 | |
| Reaktionsart | Hydrolyse | |
| Substrat | 76-Gln-+-Phe-77 in Synaptobrevin 2 | |
| Produkte | Spaltprodukte | |
| Vorkommen | ||
| Homologie-Familie | Botulinumtoxin | |
| Übergeordnetes Taxon | Clostridium | |
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| CAS-Nummer |
676570-37-9 | ||||||
| |||||||
Aufbau
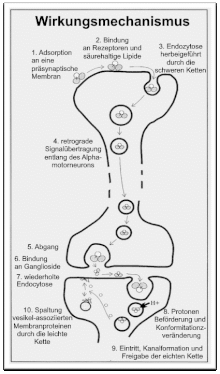
Das Toxin besteht aus zwei Untereinheiten und wird aus einem Proto-Polypeptid während der logarithmischen Wachstumsphase intrazellulär gebildet. Nach Autolyse wird das Prototoxin durch Proteasen in seine aktive Form überführt.[4] Die schwere Proteinkette (100 kDa mit zwei Domänen) ist verantwortlich für die Bindung des Toxins an Ganglioside von Nervenzellen (also Bindung an die Membran und Translokation durch die Membran), während die leichte Kette (50 kDa) die Neurotoxizität vermittelt. Die leichte und schwere Kette sowie die beiden Domänen der schweren Proteinkette sind jeweils durch eine Disulfidbrücke miteinander verbunden.
Der C-Terminus der schweren Kette bindet an Rezeptoren für eine Endozytose notwendig.[4] Der N-Terminus vermittelt den intra-axonalen Transport und in zentralen Interneuron auch die Translokation des Toxins in das Cytosol des Neurons. Die leichte Kette ist für die toxinspezifischen Eigenschaften nötig.
Die Gene für das Toxin sind hochkonserviert und sein Regulatorgen befindet sich auf einem Plasmid.[4]
Wirkung
Das Toxin hemmt präsynaptisch die inhibitorischen Synapsen an den spinalen Motoneuronen sowie die Freisetzung der Neurotransmitter Glycin und GABA. Klinisch zeigt sich dies in einer spastischen Paralyse.
Ähnliche Toxine
Es ist nach dem Botulinum-Toxin das zweitstärkste bakterielle Toxin. Man schätzt, dass die minimale tödliche Dosis für Menschen weniger als 2,5 ng pro kg Körpergewicht beträgt.[5] Es spaltet wie dieses das Vesikel-Membranprotein Synaptobrevin. Außerdem wirkt Tetanospasmin ähnlich wie das Pflanzengift Strychnin, das ebenfalls die Wirkung von Glycin verhindert.
Sonstiges
Der Nachweis von Tetanospasmin erfolgt bei dringendem Verdacht im Tierversuch. Mäuse zeigen typischerweise eine Robbenstellung. Bereits 0,1 ng/kg Körpergewicht Tetanospasmin töten eine Maus, 0,3 ng/kg KW ein Meerschweinchen.[4] Während Mäuse, Meerschweinchen, Affen, Schafe und Ziegen sehr empfindlich auf das Toxin reagieren, sind Katzen, Hunde, Vögel und auch wechselwarme Tiere resistenter.
Tetanospasmin lässt sich durch Formalin inaktivieren, man erhält so den Toxoidimpfstoff, der als wirksamer Bestandteil eines Tetanusimpfstoffs bei der aktiven Tetanus-Impfung eingesetzt wird.
Der deutsche Toxikologe Ernst Habermann leistete Pionierarbeit bei der Aufklärung von Struktur und Wirkungsweise des Tetanospasmins.
Einzelnachweise
- Datenblatt Tetanustoxin, aus Clostridium tetani bei Sigma-Aldrich, abgerufen am 29. Juli 2017 (PDF).
- R. Pellizzari et al.: Tetanus and botulinum neurotoxins: mechanism of action and therapeutic uses. In: Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. Band 354, Nr. 1381, 28. Februar 1999, S. 259–268, doi:10.1098/rstb.1999.0377, PMID 10212474, PMC 1692495 (freier Volltext).
- Thomas Binz et al.: Clostridial neurotoxins: mechanism of SNARE cleavage and outlook on potential substrate specificity reengineering. In: Toxins. Band 2, Nr. 4, April 2010, S. 665–682, doi:10.3390/toxins2040665, PMID 22069605, PMC 3153214 (freier Volltext).
- Tetanus Toxoid: Martha H. Roper et al. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin’s Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 1052 ff., doi:10.1016/B978-0-323-35761-6.00058-4.
- NUTZENDOKUMENTATION VON STANDARDIMPFSTOFFEN: TETANUS. Arznei-Telegramm, 19. Februar 2016, S. 17–20, abgerufen am 10. Dezember 2019.
