Amide
Als Amide werden sehr unterschiedliche chemische Verbindungen bezeichnet. Überwiegend sind Amide in die Gruppe der kovalenten organischen Verbindungen einzuordnen, aber es gibt auch ionische anorganische Amide, die als Metallamide bezeichnet werden.
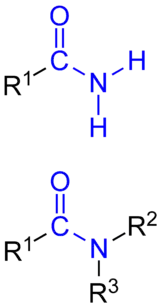
Allgemeine Struktur von Carbonsäureamiden.
R1, R2 und R3 stehen für ein Wasserstoffatom oder einen Organyl-Rest. Blau markiert ist oben die Carbamoyl-Gruppe und unten die durch die Reste R2 und R3 substituierte Carbamoyl-Gruppe.
R1, R2 und R3 stehen für ein Wasserstoffatom oder einen Organyl-Rest. Blau markiert ist oben die Carbamoyl-Gruppe und unten die durch die Reste R2 und R3 substituierte Carbamoyl-Gruppe.
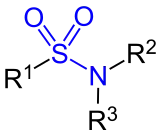
Sulfonsäureamide:
R1, R2 und R3 stehen für ein Wasserstoffatom oder einen Organyl-Rest
R1, R2 und R3 stehen für ein Wasserstoffatom oder einen Organyl-Rest
Rein formal betrachtet leiten sich alle Amide vom Ammoniak dadurch ab, dass ein oder mehrere Wasserstoffatome im Ammoniakmolekül durch andere Atome oder Atomgruppen ersetzt werden. Dabei sind
- Kovalente Amide Derivate (Abkömmlinge) von organischen Carbonsäuren, Sulfonsäuren oder von anorganischen Oxosäuren (z. B. Schwefelsäure, oder Phosphorsäure), in deren jeweiligen Molekülen formal eine oder mehrere der aciden Hydroxygruppe(n) in der Carboxygruppe bzw. in der anorganische Oxosäure durch eine eventuell mit Alkylresten substituierte Aminogruppe ersetzt ist.[1]
- Ionische Amide (Metallamide) als Salze von Ammoniak (NH3) aufzufassen, die dadurch entstehen, dass ein Proton im Ammoniakmolekül durch ein Metallkation ersetzt wird. Reaktionen zur Herstellung solcher Metallamide laufen (in Abwesenheit von Wasser!) unter Entwicklung von Wasserstoff ab, wenn man Alkalimetalle mit flüssigem Ammoniak in Kontakt bringt. Dabei entstehen Alkalimetall-Amide, z. B. Natriumamid (NaNH2). Mit deren Hilfe können dann andere Metallamide, z. B. Silberamid, hergestellt werden.
Kovalente Amide
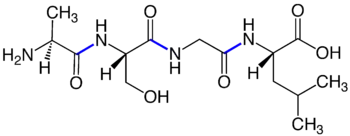
Kovalente Amide findet man unter anderem als
- Carbonsäureamide als Derivate von Carbonsäuren,
- Peptide und Proteine (Eiweiße) sind in der Natur weit verbreitet und enthalten Peptidbindungen. Peptidbindungen sind zugleich auch Amidbindungen; Peptide und Proteine sind zugleich Carbonsäureamide.
- Polyamide in bestimmten Kunststoffen und synthetischen Fasern,[2]
- Sulfonsäureamide als Derivate von Sulfonsäuren in einigen Arzneistoffen,
- Phosphorsäureamide (Arzneistoffe wie zum Beispiel Cyclophosphamid, Ifosfamid) als Derivate verschiedener Phosphorsäuren und
- Polyaminoamide, die unter anderen als Härterkomponenten für Epoxidharze eingesetzt werden.
Eine tautomere Struktur, bei der die Doppelbindung nicht zwischen Kohlenstoff und Sauerstoff, sondern zwischen Kohlenstoff und Stickstoff liegt und gleichzeitig eine Hydroxygruppe vorliegt, bilden die Imidsäuren.[3]
Weblinks
Commons: Amide – Sammlung von Bildern, Videos und Audiodateien
Einzelnachweise
- Eintrag zu amides. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00266 – Version: 2.3.3.
- M. D. Lechner, K. Gehrke, E. H. Nordmeier: Makromolekulare Chemie. Ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker. 4. Auflage, Birkhäuser, Basel / Boston, Mass. / Berlin 2010, ISBN 978-3-7643-8890-4, S. 121–125.
- Eintrag zu Imidsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Februar 2019.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.