Acetylaceton
Acetylaceton (IUPAC-Name: Pentan-2,4-dion) ist eine organisch–chemische Verbindung, die der Stoffgruppe der 1,3-Diketone zuzuordnen ist und deren einfachsten Vertreter sie darstellt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
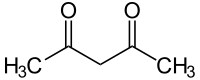 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Acetylaceton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H8O2 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit mit angenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,98 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
−23 °C[2] | |||||||||||||||
| Siedepunkt |
ca. 140 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
leicht in Wasser (122 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4494 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte
Erstmals wurden die Herstellung und Eigenschaften der Verbindung 1887 in der Dissertation des französischen Chemikers Alphonse Combes beschrieben.[8][9][10] Er nutzte die damals vom deutschen Chemiker Ludwig Claisen neu eingeführte Methode der Claisen-Esterkondensation.[11]
Darstellung und Gewinnung
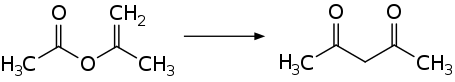
Eine technische Synthese erfolgt durch eine metallkatalysierte thermische Umlagerung von Isopropenylacetat.[1]
Eigenschaften
Physikalische Eigenschaften
Acetylaceton ist eine farblose, angenehm riechende, entzündliche Flüssigkeit. Der Siedepunkt bei Normaldruck liegt bei 140 °C.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend lg(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 6,85511, B = 1313,8808 und C = 192,744 im Temperaturbereich von 32 bis 165 °C.[12] Die Flüssigkeit ist wenig flüchtig, jedoch bilden sich bei erhöhter Umgebungstemperatur Dämpfe, die schwerer als Luft sind. Die Mischbarkeit mit Wasser ist begrenzt.[1] Mit steigender Temperatur steigt die Löslichkeit von Acetylaceton in Wasser bzw. steigt die Löslichkeit von Wasser in Acetylaceton.[13] Mit Alkoholen, Ketonen, Ethern, Estern, aliphatischen und aromatischen Kohlenwasserstoffen und Chlorkohlenwasserstoffen ist die Verbindung unbegrenzt mischbar.[1]
Löslichkeiten zwischen Acetylaceton und Wasser[13] Temperatur °C 0 9,6 19,8 29,8 39,7 50,1 60,6 70,5 80,3 90,5 Acetylaceton in Wasser in Ma-% 14,1 14,9 16,1 17,6 18,9 21,02 24,4 27,0 32,2 40,3 Wasser in Acetylaceton in Ma-% 1,7 2,1 2,8 3,5 4,4 5,8 7,8 10,0 13,5 19,9
Chemische Eigenschaften
Acetylaceton besitzt eine relativ starke CH-Acidität an der Methylengruppe zwischen den beiden Carbonylgruppen. Folglich kann es durch starke Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Enolat-Ion gebildet wird:

Die relativ hohe Säurestärke lässt sich durch den von beiden Carbonylgruppen ausgehenden induktiven Effekt und mesomeren Effekt (negative Ladung des Anions über 5-atomiges π-System delokalisiert) erklären. Die Anordnung der Carbonylgruppen begünstigt auch die Enolisierung, da die Doppelbindung des Enols mit der benachbarten Carbonylgruppe konjugiert ist und die OH-Gruppe eine Wasserstoffbrücke zur Carbonylgruppe ausbildet:
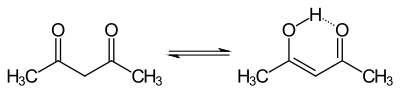
Daher liegt Acetylaceton im flüssigen Zustand zu 80 % als Enol vor. Die Enolisierungsreaktion verläuft mit einer Reaktionswärme von −10 kJ·mol−1 schwach exotherm.[14]
Sicherheitstechnische Kenngrößen
Acetylaceton bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 34 °C.[2] Die unteren Explosionsgrenze (UEG) liegt bei ca. 1,7 Vol.‑% (71 g/m3).[2] Die Grenzspaltweite wurde mit 0,92 mm (50 °C) bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 340 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Acetylaceton ist als zweizähniger Ligand ein Komplexbildner (Acetylacetonat, acac). Zudem dient es als Synthesebaustein für heterocyclische Verbindungen, z. B. Arzneimittel wie das bei Bakterien folsäuresynthesehemmende Sulfamethazin oder Nicarbazin. Acetylaceton findet auch Anwendung in der Herstellung von Rostumwandlern und Korrosionsschutzmitteln. Es wird darüber hinaus als Reagenz beim Acetylaceton-Verfahren, einem standardisierten Verfahren zur quantitativen Bestimmung von Formaldehyd, verwendet.[15]
Durch asymmetrische Hydrierung kann 2,4-Pentandiol gewonnen werden.[16]
Acetylacetonate
Acetylaceton besitzt einen pKs-Wert von 8,99 ± 0,06 (25 °C, I=0), d. h., es reagiert beim Mischen mit Wasser leicht sauer.
Acetylacetonat findet häufig Anwendung als Ligand für Übergangsmetalle. Diese Metallacetylacetonate werden häufig als Katalysator eingesetzt. In der Summenformel eines Komplexes wird Acetylacetonat mit acac abgekürzt, z. B. Rh(CO)2acac.
Beispiele für gebräuchliche Metallacetylacetonate sind:
- Aluminiumacetylacetonat Al(acac)3
- Bariumacetylacetonat Ba(acac)2
- Calciumacetylacetonat Ca(acac)2
- Chrom(III)-acetylacetonat Cr(acac)3
- Cobalt(II)-acetylacetonat Co(acac)2
- Eisen(III)-acetylacetonat Fe(acac)3
- Galliumacetylacetonat Ga(acac)3
- Iridium(III)-acetylacetonat Ir(acac)3
- Kupfer(I)-acetylacetonat Cu(acac)
- Kupfer(II)-acetylacetonat Cu(acac)2
- Mangan(III)-acetylacetonat Mn(acac)3
- Magnesiumacetylacetonat Mg(acac)2
- Nickel(II)-acetylacetonat Ni(acac)2
- Vanadylacetylacetonat V(O)(acac)2
- Zink(II)-acetylacetonat Zn(acac)2
Sicherheitshinweise
Der Einsatz der früher als Aromastoff verwendeten Substanz ist seit 2005 innerhalb der EU in Lebensmitteln verboten, da Hinweise auf Genotoxizität bestehen.[17]
Einzelnachweise
- Eintrag zu Acetylaceton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Dezember 2021.
- Eintrag zu Pentan-2,4-dion in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Olmstead, W. N.; Bordwell, F. G., "Ion-pair association constants in dimethyl sulfoxide", J. Org. Chem., (1980) 45, 3299–3305. doi:10.1021/jo01304a033
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-416.
- Eintrag zu Pentane-2,4-dione im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 123-54-6 bzw. Acetylaceton), abgerufen am 2. November 2015.
- WEKA Gefahrstoffdatenbank, WEKA Media GmbH & Co. KG, 2009.
- A. Combes: Nouvelle réaction du chlorure d'aluminium. - Synthèses dans la série grasse in Annales de Physique at de Chimie, Ser.6, T12 (1887) 199-274, speziell 201.
- A. Combes: Sur les synthèses dans la série quinoléique au moyen de l’acétylacétoneet de ses dérivés in Bulletin de la Société chimique de Paris 49 (1888) 89–92, Volltext.
- Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 6 pdf.
- L. Claisen: Beiträge zur Kentniss der 1,3‐Diketone in Ann. Chem. Pharm. 277 (1893) 162–206.
- Carl L. Yaws: The Yaws Handbook of Vapor Pressure - Antoine Coefficients, 2nd Edition Elsevier 2015, ISBN 978-0-12-802999-2, S. 24, doi:10.1016/B978-0-12-802999-2.00004-0.
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992), S. 80–95, doi:10.1021/je00005a024.
- Thompson, D.W.; Allred, A.L.: Keto-enol equilibria in 2,4-Pentanedione and 3,3-dideuterio-2,4-pentanedione in J. Phys. Chem. 75 (1971) 433–435, doi:10.1021/j100673a025.
- VDI 3862 Blatt 6:2004-02 Messen gasförmiger Emissionen; Messen von Formaldehyd nach dem Acetylaceton-Verfahren (Gaseous emission measurement; Measurement of formaldehyde by the acetylacetone method). Beuth Verlag, Berlin, S. 5.
- J. Michael Chong: (2R,4R)-2,4-Pentanediol. In: Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rp029.
- Entscheidung der EU-Kommission vom 18. Mai 2005 zur Änderung der Entscheidung 1999/217/EG in Bezug auf das Verzeichnis der in oder auf Lebensmitteln verwendeten Aromastoffe. (PDF).

