Henry-Reaktion
Die Henry-Reaktion, auch Kamlet-Reaktion oder Nitroaldol-Reaktion genannt, ist eine Namensreaktion der organischen Chemie. Charakteristisch für diese Reaktion ist die Kupplung eines α-Kohlenstoffatoms einer aliphatischen Nitroverbindung mit einer Carbonyl-Verbindung zu einem β-Nitroalkohol unter Ausbildung einer C–C-Bindung.
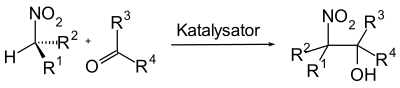
Die Henry-Reaktion findet in der Regel Anwendung als Reaktionszwischenschritt bei der Synthese von komplexen organischen Molekülen. Sie wird unter verhältnismäßig milden Reaktionsbedingungen durchgeführt und bietet mit der Bildung des β-Nitroalkohols eine funktionalisierte Ausgangsverbindung für weitere Transformationen wie Oxidationen, Reduktionen oder die Nef-Reaktion.
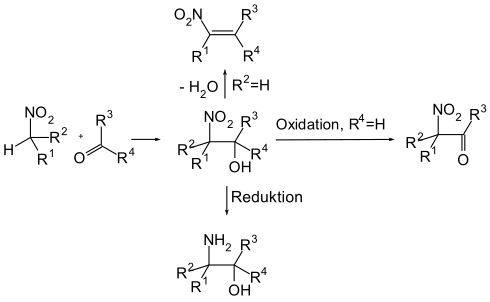
Wegen der milden Reaktionsbedingungen bleiben auch labile Schutzgruppen und funktionelle Gruppen erhalten.
Mechanismus
Der Reaktionsmechanismus der Henry-Reaktion ist dem der Aldol-Reaktion sehr ähnlich, weshalb sie auch des Öfteren als Nitroaldol-Reaktion bezeichnet wird. Der Unterschied zur Aldol-Reaktion besteht darin, dass bei der Henry-Reaktion die C–H-acide Carbonyl-Verbindung durch eine Nitro-Verbindung ersetzt wurde.
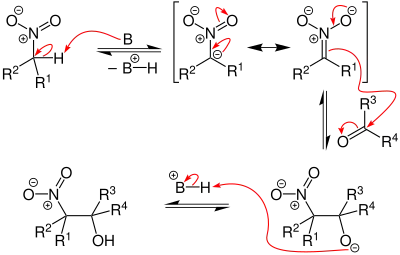
Aliphatische Nitro-Verbindungen, welche ein α-Wasserstoff-Atom tragen, sind sehr C–H-acide und können durch starke Basen deprotoniert werden. Dabei bildet sich ein Nitronat-Ion. Das Nitronat-Ion kann nun die Carbonyl-Verbindung am Carbonyl-Kohlenstoff-Atom angreifen, wodurch sich das Anion des β-Nitroalkohols bildet. Durch anschließende Protonierung entsteht der β-Nitroalkohol.[1]
Stereochemie
Bei der Henry-Reaktion werden in der Regel aus einem prochiralen Aldehyd oder Keton durch die Umsetzung mit dem Nitronation eine chirale Verbindung hergestellt. Eine Ausnahme ist die Verwendung von symmetrischen Carbonylverbindungen wie beispielsweise Aceton, da diese Verbindungen nicht prochiral sind und daher kein Stereozentrum gebildet wird. Das Gleiche gilt für die Nitrokomponente. Bei der Verwendung von Nitromethan entsteht ebenfalls kein neues Stereozentrum.
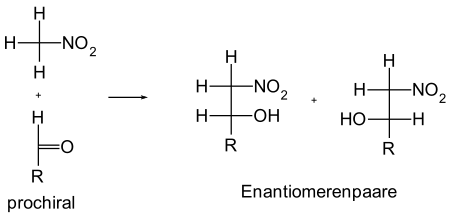
Bei einem neu gebildeten Stereozentrum erhält man ein zwei mögliche Enantiomere. Bei zwei neu gebildeten Stereozentren erhält man dagegen vier mögliche Verbindungen – zwei Enantiomerpaare und zwei Diastereomerpaare. Bei den Diastereomerenpaaren unterscheidet man zwischen der threo- und der erythro-Form (abgeleitet von der Threose und der Erythrose). Liegen beide Substituenten in der Fischer-Projektion auf einer Seite, handelt es sich hierbei um die erythro-Form, liegen beide Substituenten auf der gegenüberliegenden Seite, handelt es sich um die threo-Form.
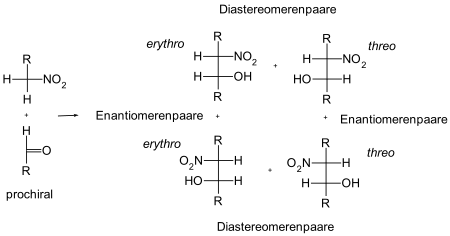
Sind alle an der Reaktion beteiligten Verbindungen achiral bzw. liegen als Gemisch der Stereoisomere vor, so wird in der Henry-Reaktion, wie generell bei solchen Reaktionen, kein Stereoisomer bevorzugt gebildet, und das heißt, man erhält immer ein einheitliches Gemisch aller möglichen Enantiomere. Anders verhält es sich bei den Diastereomerpaaren, die, durch sterische Effekte bedingt, auch bei Abwesenheit einer enanatiomer-angereicherten Verbindung durchaus eine Präferenz aufweisen können, weshalb man hier häufig das Verhältnis threo:erythro bestimmt, um Aussagen über die Selektivität einer Reaktion zu machen.
Einen recht komplizierten Fall hat man vorliegen, wenn in einem oder beiden Substraten schon Stereozentren enthalten sind (z. B. Zucker oder Aldehyde welche von Aminosäuren abgeleitet sind), da hier noch mehr Kombinationen an Enantiomeren- und Diastereomerpaaren denkbar sind und die Stereozentren auch die Selektivitäten selber beeinflussen.
Katalysatoren
Die Henry-Reaktion kann durch eine Vielzahl von Katalysatoren und Reaktionsbedingungen katalysiert werden. Organische Basen, anorganische Basen, quartäre Ammoniumsalze, protische und unprotische Lösungsmittel und lösungsmittelfreie Bedingungen wurden erfolgreich angewandt. Dadurch können die Reaktionsbedingungen an die Substrate angepasst werden, was z. B. Schutzgruppen, Löslichkeiten und Labilität von funktionellen Gruppen betrifft.
Die ersten Katalysatoren, die bei der Henry-Reaktion eingesetzt wurden, waren sowohl Alkoxide als auch Hydroxide in alkoholischen oder wässrigen Lösungsmitteln.[2] Eine spätere Entwicklung war die Verwendung von 1,1,3,3-Tetramethylguanidin (TMG) als Katalysator, welches mehrfach Einsatz gefunden hat.[3][4][5]
Auf dessen Basis wurden dann bicyclische und sogar an polymere Harze gebundene Guanidine eingesetzt.[6]
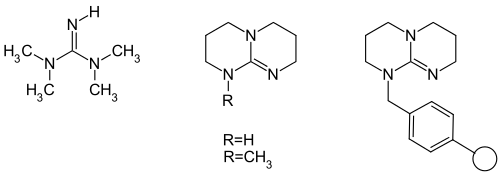
Verkade entwickelte dann Proazaphosphatane als effektive Katalysatoren für die Henry-Reaktion bei der Umsetzung von Nitroalkanen mit Aldehyden und Ketonen.[7]
Bei der Verwendung von Ketonen als Carbonyl-Komponente ist die Kondensation der Ketone untereinander (Aldolkondensation) die hauptsächliche Nebenreaktion. Durch Verwendung der Proazaphosphatane kann diese Nebenreaktion wirkungsvoll unterdrückt werden. Für optimale Bedingungen wird in dem Reagenzsystem von Vekaden Magnesiumsulfat als Lewissäure benutzt.
Auch mit Lithiumaluminiumhydrid als Katalysator wurden zahlreiche Nitroaldol-Reaktionen zwischen aromatischen und aliphatischen Aldehyden und Nitromethan, Nitroethan und 1-Nitropropan publiziert.[8]
Von R. Ballini wurde der Ionentauscher Amberlyst A-21 unter lösungsmittelfreien Bedingungen in der Herstellung von Nitrodiolen durch Reaktion von Aldehyden mit 4-Nitro-butanol vorgestellt.[9] Aus der gleichen Arbeitsgruppe stammt die Anwendung des Phasentransferkatalysators Cetyltrimethylammoniumchlorid in Wasser und in Anwesenheit von Natriumhydroxid.[10]
M.J. Shibasaki publizierte Katalysatoren auf der Basis von Seltenen Erden. Hier besonders zu erwähnen, weil es die Grundlage zu den chiralen Katalysatoren liefert, ist Samariumtrihexamethylsilazid [Sm(HDMS)3], welches leicht aus Samarium(III)-chlorid (SmCl3) und Natriumhexamethyldisilazid (NaHMDS) herzustellen ist.[11]
Asymmetrische Katalyse
Ziel der asymmetrischen Katalyse ist es, zu ermöglichen, dass ein möglichst hoher Anteil an einem Enantiomer synthetisiert werden kann. Da die meisten Wirkstoffe in vivo eine unterschiedliche Wirkung aufweisen, ist es für die großtechnische Synthese von großem Interesse möglichst selektive Synthesemethoden zur Hand zu bekommen.
Die erste katalytische asymmetrische Henry-Reaktion wurde 1992 von H. Shibasaki et al. publiziert. Dabei kamen die Erfahrungen, die mit den Katalysatoren der Seltenen Erden gemacht wurden, zum Einsatz und es wurde zunächst Lanthan als Metall verwendet. Als chirales Auxiliar bzw. Ligand wurde hierbei enantiomerreines β-Binaphthol benutzt.[12] In einer späteren Publikation wurde die Synthese des Katalysatorsystems vereinfacht und statt der Lanthanquelle Trilanthanhepta-tert-butylat wurde als Lanthan-Quelle nun das einfacher zu handhabende Lanthan(III)-chlorid benutzt. Der erreichte Enantiomerenüberschuss wurde mit 79–91 % angegeben.[13]
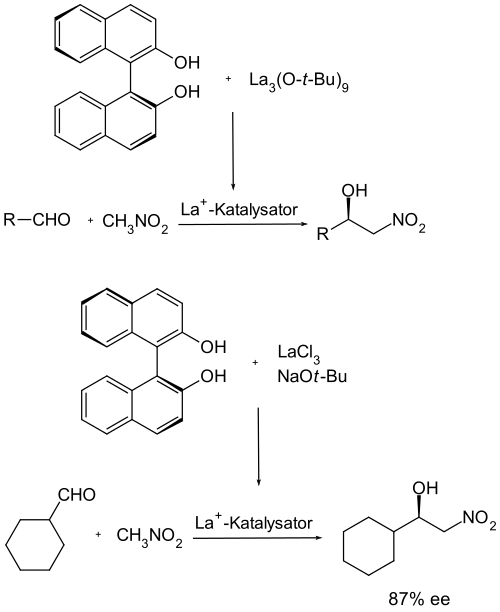
Ebenfalls mittlere bis hohe Enantiomerenüberschüsse (70–95 %) wurden bei einer Verwendung von Samarium als Metall, und auch hier Binaphthol als chiraler Ligand, erreicht.[14]
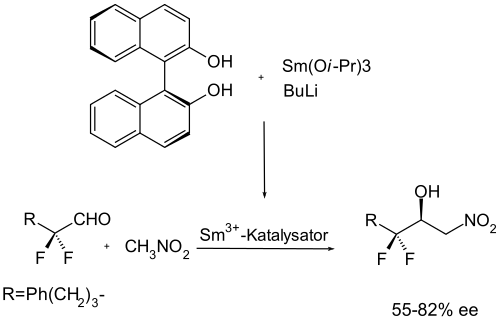
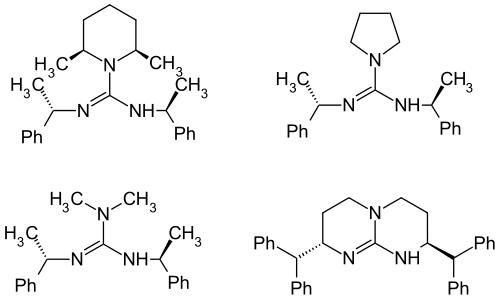
Aufgrund der bisherigen Erfahrungen mit Binaphthol als chiraler Ligand und den Guanidinen als achirale Ligenaden lag es nahe, zur Optimierung der Liganden auf dieser Basis weiter zu arbeiten. Bei diesen Arbeiten kamen diverse chirale Guanidine zum Einsatz.[15][16]
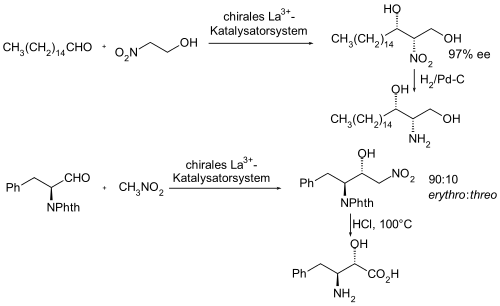
Beispielhaft sind im Folgenden zwei asymmetrische Synthesen mittels einer asymmetrisch katalysierten Henry-Reaktion als Partialsynthese von pharmakologisch interessanten Verbindungen aufgezeigt.[17][18]
Variationen der Henry-Reaktion
Nitronat-Kondensation
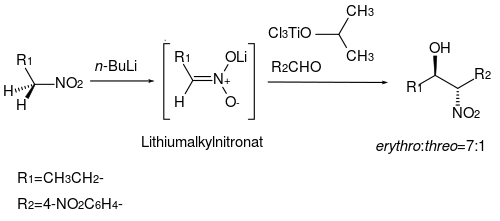
Wird ein Nitroalkan mit n-Butyllithium umgesetzt, so erhält man ein Lithioalkylnitronat, welches sich in Anwesenheit von Isopropyloxytitantrichlorid mit vielen Aldehyden bei sehr milden Bedingungen (THF, −78 °C) zu den entsprechenden β-Aminoalkanolen umsetzen lässt.[19] Die In-situ-Bildung eines Dichlorisopropylnitronats unterstützt die hohe Diastereoselektivität der Nitroalkanol-Produkte (erythro:threo=7:1).
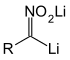
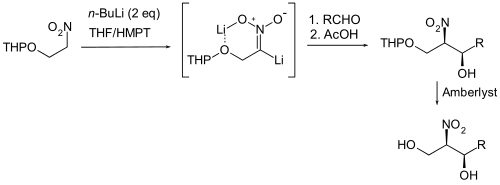
Von Seebach und Eyer stammt eine Variante, bei der eine dilithiiertes Nitronat als aktive Nitronat-Spezies in einer Henry-Reaktion benutzt wird. Das Potential dieser Methode konnte in einer Reihe von Reaktanten wie Benzylhalogeniden oder Dimethylcarbonat als Carbonyl-Komponente demonstriert werden. Als Beispiel sei hier ein Tetrahydropyranyl-geschütztes Nitroethanol angeführt, welches mit einem zweifachen Überschuss an n-Butyllithium in THF/HMPT versetzt wird, um das Nitronat zu erhalten. Bei dem Nitronat handelt es sich um ein unintramolekular-chelatisiertes Nitronatdianion. Dieses wurde mit einer Reihe Aldehyden umgesetzt und nach saurer Behandlung (Amberlyst) erhält man die Dihydroxynitroalkane. Man fand heraus, dass es sich bei den Reaktionsprodukten bevorzugt um die der threo-Serie handelt. Nach Abspaltung der THP-Schutzgruppe konnten die reinen Diastereomere durch Kristallisation erhalten werden.[20]
Retro-Henry-Reaktion
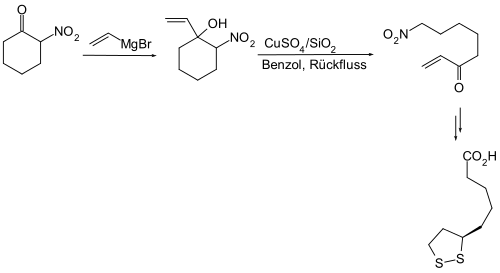
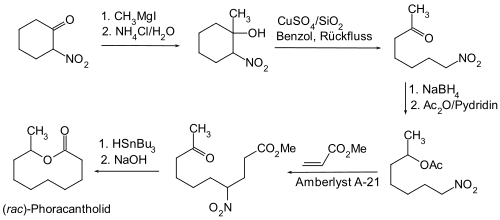
In Analogie zur verwandten Aldolreaktion ist die Henry-Reaktion eine reversible Reaktion. Dies kann man ausnutzen, wenn man auf einem anderen Weg als eine Henry-Reaktion eine β-Hydroxnitro-Verbindung herstellt und sie dann einer Retro-Henry-Reaktion unterwirft. Für diesen Zweck eignen sich besonders β-Nitroketone, welche man durch Umsetzung mit Grignard-Reagenzien unter C-C-Verknüpfung in eine solche β-Hydroxnitro-Verbindung überführt.[21][22]
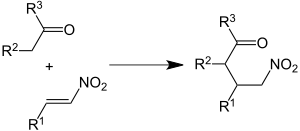
Michael-Henry-Reaktion
Die Michael-Reaktion ist eine vinyloge Aldolreaktion. In Analogie hierzu gibt es auch eine Michael-Henry-Reaktion (Nitro-Michael-Reaktion). Hier reagiert die α-β-ungesättigte Nitrogruppe wie der Michael-Akzeptor in der Michael-Reaktion.
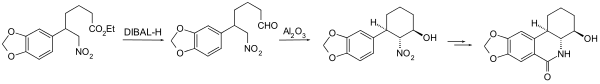
Intramolekulare Henry-Reaktion
Die Henry-Reaktion kann, wie viele andere organische Reaktionen, auch intramolekular durchgeführt werden. Dabei sind Nitro-Komponente und Carbonyl-Komponente innerhalb des gleichen Moleküls vorhanden und die Henry-Reaktion führt zu einer Ringschluss-Reaktion. In der Regel werden entweder die Nitro-Komponente oder die Carbonyl-Komponente in einem einleitenden Schritt hergestellt und diese Verbindung dann einer Cyclisierungsreaktion unterworfen. Hier sei ein Beispiel aus der Naturstoffsynthese aufgeführt. Die Carbonyl-Komponente wird aus einem Ester durch Dibal-Reduktion (DIBAL-H) zum Aldehyd gewonnen. Durch Aluminiumoxid wird dann die Cyclisierung eingeleitet.[23]
Ein ähnliches Gerüst kann durch eine Kombination aus Henry-Michael-Reaktion und Henry-Reaktion aufgebaut.[24]
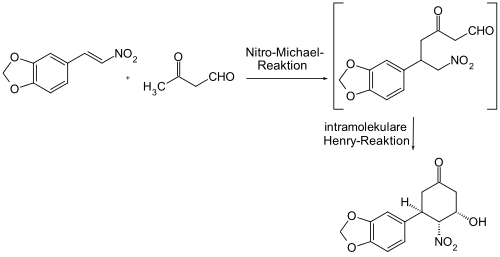
Bei einer Variante der intramolekularen Henry-Reaktion wird zunächst intermolekular durch eine Henry-Reaktion die aktive Spezies aus Carbonyl-Komponenten und Nitro-Komponenten aufgebaut. Dazu wird eine Dicarbonyl-Verbindung benötigt, welche durch Oxidation eines Diols oder aus Olefinen durch Oxidation zum Glycol und anschließender Periodat-Spaltung bzw. direkt durch eine Ozonolyse zugänglich ist. Die Umsetzung mit einem Nitroalkan führt zu einer Verbindung, die im Molekül eine Nitrogruppe und eine Carbonylgruppe enthält und der intramolekularen Henry-Reaktion unterworfen werden kann.[25]

Literatur
- Louis Henry: Formation synthétique d’alcools nitrés. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 120, 1895, S. 1265–1268 (Digitalisat auf Gallica).
- Patent US2151517: Preparation of arylnitroalkanols. Veröffentlicht am 21. März 1939, Erfinder: J. Kamlet (vgl. Chem. Abstr. Vol. 33, Nr. 9, 1939, S. 5003).
- H. B. Hass, Elizabeth F. Riley: The Nitroparaffins. In: Chemical Reviews. 32, Nr. 3, 1943, S. 373–430, doi:10.1021/cr60103a003.
- Dieter Seebach, Ernest W. Colvin, Friedrich Lehr, Thomas Weller: Nitroliphatic Compounds—Ideal Intermediates in Organic-synthesis. In: Chimia. 33, Nr. 1, 1979, S. 1–18.
- Goffredo Rosini: The Henry (Nitroaldol) Reaction. In: Barry M. Trost (Hrsg.): Comprehensive Organic Synthesis. Vol. 2 Additions to CX π-Bonds, Part 2, Pergamon, Oxford 1991, S. 321–340 doi:10.1016/B978-0-08-052349-1.00032-9.
- Frederick A. Luzzio: The Henry reaction: recent examples. In: Tetrahedron. 57, Nr. 6, 2001, S. 915–945, doi:10.1016/S0040-4020(00)00965-0.
Einzelnachweise
- Mundy, Bradford P., Michael G. Ellerd, and Frank G. Favaloro Jr. Name reactions and reagents in organic synthesis. John Wiley & Sons, 2005. S. 300–301
- Louis Frederick Fieser, Mary Fieser, Tse-Lok Ho: Reagents for Organic Synthesis. Vol. 1, Wiley, New York 1967, ISBN 0-471-25875-X, S. 739.
- Angus C. Forsyth, R. Michael Paton, Ian Watt: Highly selective base-catalysed additions of nitromethane to levoglucosenone. In: Tetrahedron Letters. 30, Nr. 8, 1989, S. 993–996, doi:10.1016/S0040-4039(00)95299-7.
- Richard W. Fitch, Frederick A. Luzzio: The aluminum amalgam reduction of 2-nitroalkanols promoted by ultrasound. In: Tetrahedron Letters. 35, Nr. 33, 1994, S. 6013–6016, doi:10.1016/0040-4039(94)88062-X.
- Daniele Simoni, Francesco Paolo Invidiata, Stefano Manfredini, Roberto Ferroni, Ilaria Lampronti, Marinella Roberti, Gian Piero Pollini: Facile synthesis of 2-nitroalkanols by tetramethylguanidine (TMG)-catalyzed addition of primary nitroalkanes to aldehydes and alicyclic ketones. In: Tetrahedron Letters. 38, Nr. 15, 1997, S. 2749–2752, doi:10.1016/S0040-4039(97)00461-9.
- Marco Bandini, Pier Giorgio Cozzi, Meri de Angelis, Achille Umani-Ronchi *: Zinc triflate–bis-oxazoline complexes as chiral catalysts: enantioselective reduction of α-alkoxy-ketones with catecholborane. In: Tetrahedron Letters. 41, Nr. 10, 2000, S. 1601–1605, doi:10.1016/S0040-4039(99)02339-4.
- Philip B. Kisanga, John G. Verkade: P(RNCH2CH2)3N: An Efficient Promoter for the Nitroaldol (Henry) Reaction In: The Journal of Organic Chemistry. 64, Nr. 12, 1999, S. 4298–4303, doi:10.1021/jo9818733.
- YSo Won Youn, Yong Hae Kim: Facile Synthesis of 2-Nitroalkanols Mediated with LiAlH4 as Catalyst. In: Synlett. 2000, Nr. 6, 2000, S. 880–882, doi:10.1055/s-2000-6730.
- Roberto Ballini, Giovanna Bosica: A New Stereoselective Synthesis of (E)-.alpha.,.beta.-Unsaturated-.gamma.-dicarbonyl Compounds by the Henry Reaction. In: The Journal of Organic Chemistry. 59, Nr. 18, 1994, S. 5466–5467, doi:10.1021/jo00097a061.
- Roberto Ballini, Giovanna Bosica: Nitroaldol Reaction in Aqueous Media: An Important Improvement of the Henry Reaction. In: The Journal of Organic Chemistry. 62, Nr. 2, 1997, S. 425–427, doi:10.1021/jo961201h.
- Hiroaki Sasai, Shigeru Arai, Masakatsu Shibasaki: Catalytic Aldol Reaction with Sm(HMDS)3 and Its Application for the Introduction of a Carbon-Carbon Triple Bond at C-13 in Prostaglandin Synthesis. In: The Journal of Organic Chemistry. 59, Nr. 9, 1994, S. 2661–2664, doi:10.1021/jo00088a068.
- Hiroaki Sasai, Takeyuki Suzuki, Shigeru Arai, Takayoshi Arai, Masakatsu Shibasaki: Basic character of rare earth metal alkoxides. Utilization in catalytic carbon-carbon bond-forming reactions and catalytic asymmetric nitroaldol reactions. In: Journal of the American Chemical Society. 114, Nr. 11, 1992, S. 4418–4420, doi:10.1021/ja00037a068.
- Hiroaki Sasai, Takeyuki Suzuki, Noriie Itoh, Masakatsu Shibasaki: Catalytic asymmetric nitroaldol reactions. A new practical method for the preparation of the optically active lanthanum complex. In: Tetrahedron Letters. 34, Nr. 5, 1993, S. 851–854, doi:10.1016/0040-4039(93)89030-T.
- Katsuhiko Iseki, Satoshi Oishi, Hiroaki Sasai, Masakatsu Shibasaki: Catalytic asymmetric nitroaldol reaction of α,α-difluoro aldehydes mediated by rare earth-lithium-BINOL complexes. In: Tetrahedron Letters. 37, Nr. 50, 1996, S. 9081–9084, doi:10.1016/S0040-4039(96)02090-4.
- Rafael Chinchilla, Carmen Nájera, Pablo Sánchez-Agulló: Enantiomerically pure guanidine-catalysed asymmetric nitroaldol reaction. In: Tetrahedron: Asymmetry. 5, Nr. 7, 1994, S. 1393–1402, doi:10.1016/0957-4166(94)80183-5.
- Anthony P. Davis, Kevin J. Dempsey: Synthesis and investigation of a hindered, chiral, bicyclic guanidine. In: Tetrahedron: Asymmetry. 6, Nr. 11, 1995, S. 2829–2840, doi:10.1016/0957-4166(95)00374-X.
- Hiroaki Sasai, Noriie Itoh, Takeyuki Suzuki, Masakatsu Shibasaki: Catalytic asymmetric nitroaldol reaction: An efficient synthesis of (S) propranolol using the lanthanum binaphthol complex. In: Tetrahedron Letters. 34, Nr. 5, 1993, S. 855–858, doi:10.1016/0040-4039(93)89031-K.
- Hiroaki Sasai, Won-Sup Kim, Takeyuki Suzuki, Masakatsu Shibasaki, Masaru Mitsuda, Junzo Hasegawa, Takehisa Ohashi: Diastereoselective catalytic asymmetric nitroaldol reaction utilizing rare earth-Li-(R)-BINOL complex. A highly efficient synthesis of norstatine. In: Tetrahedron Letters. 35, Nr. 33, 1994, S. 6123–6126, doi:10.1016/0040-4039(94)88093-X.
- Anthony G. M. Barrett, Chantal Robyr, Christopher D. Spilling: Dichloroisopropoxytitanium nitronates as reagents for stereoselective Henry reactions. In: The Journal of Organic Chemistry. 54, Nr. 6, 1989, S. 1233–1234, doi:10.1021/jo00267a001.
- Martin Eyer, Dieter Seebach: l-2-Nitro-1,3-alkanediols by stereoselective addition of nitroethanol to aldehydes. On the asymmetric electrophilic addition to double bonds. In: Journal of the American Chemical Society. 107, Nr. 12, 1985, S. 3601–3606, doi:10.1021/ja00298a033.
- Maitreyee (Sarma) Bezbarua, Anil K. Saikia, Nabin C. Barua, Dipak Kalita, Anil C. Ghosh: A Short Enantioselective Formal Synthesis of Methyl (S)-(-)-6,8-Dihydroxyoctanoate: A Key Intermediate for the Synthesis of R-(+)-α-Lipoic Acid. In: Synthesis. 1996, Nr. 11, 1996, S. 1289–1290, doi:10.1055/s-1996-4380.
- Anil K. Saikia, Monoj J. Hazarika, Nabin C. Barua, Maitreyee Sarma Bezbarua, Ram P. Sharma, Anil C. Ghosh: Direct Synthesis of Keto Nitroaliphatics via Retro-Henry Reaction of Cyclic 2-Nitroalcohols by Anhydrous Copper Sulfate Adsorbed on Silica Gel. A Short Synthesis of (±)-Phoracantholide I. In: Synthesis. 1996, Nr. 8, 1996, S. 981–985, doi:10.1055/s-1996-4318.
- James McNulty, Ruowei Mo: Diastereoselective intramolecular nitroaldol entry to lycoricidine alkaloids. In: Chemical Communications., Nr. 8, 1998, S. 933–934, doi:10.1039/A800097B.
- Thomas Weller, Dieter Seebach: Synthesis of (±)-1-desoxy-2-lycorinone and of a possible trans-dihydro-lycoricidine precursor. In: Tetrahedron Letters. 23, Nr. 9, 1982, S. 935–938, doi:10.1016/S0040-4039(00)86987-7.
- M. Eberle, M. Missbach, D. Seebach: Enantioselective Saponification with Pig Liver Esterase (PLE): (1S,2S,3R)-3-Hydroxy-2-nitrocyclohexyl Acetate In: Organic Syntheses. 69, 1990, S. 19, doi:10.15227/orgsyn.069.0019; Coll. Vol. 8, 1993, S. 332 (PDF).