Mannich-Reaktion
Die Mannich-Reaktion ist eine Namensreaktion in der Organischen Chemie, bei der eine Aminoalkylierung von CH-aciden Verbindungen mit einem Aldehyd und Ammoniak beziehungsweise einem primären oder sekundären Amin stattfindet. Die Reaktion ist nach ihrem Entdecker, dem deutschen Chemiker Carl Mannich benannt. Die Mannich-Reaktion wird zu den Kondensationsreaktionen gezählt, da Wasser abgespalten wird.
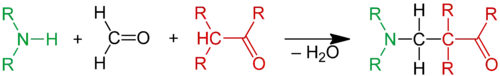
Reaktion
In der Mannich-Reaktion werden Ammoniak oder primäre beziehungsweise sekundäre Amine sowohl zur Aktivierung des Aldehyds als auch zum Einführen der gewünschten chemischen Reste in das zu bildende Produkt verwendet. Tertiäre Amine können nicht für die Mannich-Reaktion verwendet werden, da sie die Entstehung des Zwischenproduktes verhindern würden. Darüber hinaus ist die Aminoalkylierung von Enaminen und Iminen, sowie an elektronenreichen Aromaten wie Indol möglich. Auch Phenole lassen sich leicht aminoalkylieren.
Als α-CH-acide Verbindungen (Nukleophil) können Carbonylverbindungen,[1] Nitrile, Alkine,[2] Nitroalkane, α-Alkylpyridine oder tertiäre Iminiumsalze dienen. In der Übersichtsreaktion wird als α-CH-acide Verbindung ein Aldehyd (R1= H, R2= H oder Organylgruppe) oder ein Keton (R1= Organylgruppe, R2= H oder Organylgruppe) gezeigt:
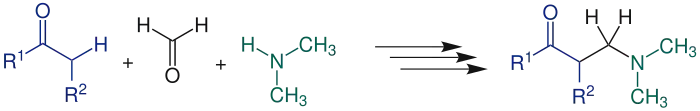
Die Mannich-Reaktion kann gegebenenfalls unter sehr milden Bedingungen durchgeführt werden; so gelang Schöpf die Synthese von Tropinon in wässriger Lösung bei Raumtemperatur und pH 5 in 90 % Ausbeute.[3] Die Produkte der Mannich-Reaktion werden Mannich-Basen[4] genannt und sind Amine, die weitere funktionelle Gruppen enthalten.
Mechanismus
Die Mannich-Reaktion erfolgt in mehreren Schritten, darunter die Bildung der Verbindung zur Aminoalkylierung und die Aminoalkylierung der CH-aciden Verbindung.
Im ersten Reaktionsschritt greift ein sekundäres Amin das Formaldehyd nukleophil an. Anschließend wird unter sauren Bedingungen die Hydroxygruppe protoniert und als Wasser-Molekül abgespalten. Es bildet sich ein mesomerie-stabilisiertes Carbenium-Iminium-Ion.
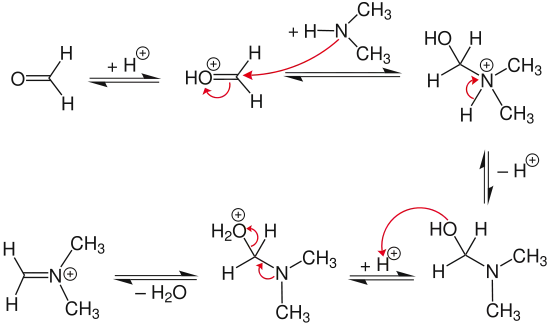
Im zweiten Schritt der Reaktion kommt es unter Einwirkung einer Säure oder Base zur Keto-Enol-Tautomerie. Das Enol greift daraufhin das Carbenium-Iminium-Ion nukleophil an. Nach abschließender Deprotonierung der Hydroxygruppe erhält man eine β-Aminocarbonylverbindung (Mannich-Base).[5]
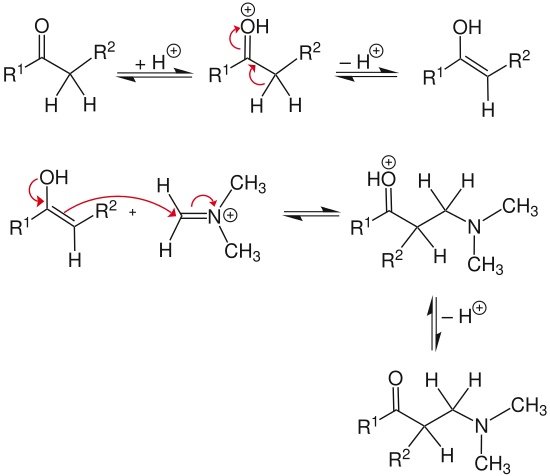
Anwendung
Die Mannich-Reaktion findet Anwendung in der Synthese von Naturstoffen, wie beispielsweise Peptid-Nukleosid-Antibiotika und Alkaloiden. Weitere Anwendungsbereiche sind die Herstellung von Arzneimitteln, der Pflanzenschutz sowie die Lack- und Polymerchemie (Farbstoffe, Reaktionsbeschleuniger, Härter und Vernetzer).[6]
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 365, ISBN 3-342-00280-8.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 261, ISBN 3-342-00280-8.
- Louis Frederick Fieser und Mary Fieser: Organische Chemie, Verlag Chemie, 2. Auflage, 1972, ISBN 3-527-25075-1.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 508–509, ISBN 3-7776-0406-2.
- László Kürti und Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 274–275, ISBN 978-0-12-429785-2.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 842–843.
Siehe auch
Weblinks
- Organische Chemie Kompakt: Namensreaktionen: Mannich-Reaktion (Memento vom 6. Juli 2013 im Internet Archive)