Impfstoff
Ein Impfstoff, auch das Vakzin oder die Vakzine genannt (lat. vaccinus „von Kühen stammend“; siehe Vakzination), ist ein Arzneimittel, das zur Impfung verwendet wird und vor Erkrankung schützen soll.
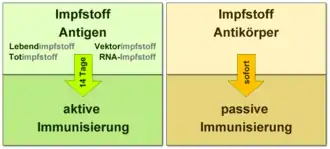
Die meisten verwendeten Impfstoffe sind Aktivimpfstoffe, die einen Wirkstoff enthalten, der eine adaptive Immunantwort im Immunsystem des Geimpften auslöst und über die Erzeugung von Gedächtniszellen langfristig wirkt. Hingegen schützen Passivimpfstoffe, die aus gereinigten Antikörpern geimpfter oder genesener Tiere (seltener: Menschen) bestehen bzw. rekombinant hergestellt werden, nur wenige Wochen vor einer Erkrankung.
Impfstoffe können sowohl gegen Infektionserreger (Pathogene), als auch gegen Krebs (Krebsimpfstoffe) oder zur Hyposensibilisierung mancher Allergene verwendet werden. Impfstoffe enthalten entweder ein Antigen oder eine DNA oder RNA, die für dieses Antigen codiert. Das Antigen (engl. von antibody-generating ‚antikörpererzeugend‘) ist der Bestandteil des Impfstoffs, der die adaptive Immunantwort hervorruft. Bei genauerer Betrachtung liegen auf dem Antigen ein oder mehrere Epitope, gegen die nach der Impfung eine adaptive Immunantwort erzeugt wird. Ein Impfstoff kann sowohl aus einem Antigen eines einzigen Erregers als auch aus einer Mischung mehrerer Antigene von verschiedenen Erregern oder Erregerstämmen bestehen. Eventuell enthält das Vakzin auch Zusatzstoffe, um seine Wirkung zu verstärken. In Folge der Impfung entstehen im Geimpften B-Gedächtniszellen und bei manchen Impfstofftypen auch T-Gedächtniszellen, die über Jahre erhalten bleiben und bei erneutem Kontakt zügig zur Zellteilung angeregt werden.
Geschichte
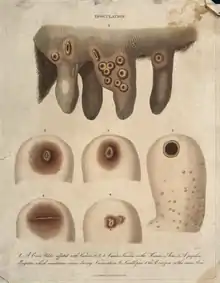

Die Pocken waren die erste Krankheit, bei der versucht wurde, Individuen durch absichtliche Infektion mit Erregern zu immunisieren (Variolation). Es wird angenommen, dass diese Versuche entweder in Indien oder China bereits um 1000 v. Chr. begannen.[1] Die erste gesicherte Dokumentation über Pockenimpfungen stammt aus dem Jahr 1549 vom chinesischen Arzt Wan Quan (1499–1582) in seinem Werk Douzhen xinfa (痘疹心法).[2] Bei dieser Impfung wurde gemahlener Pockenschorf in die Nase der Impflinge geblasen. Die daraus resultierende Immunität senkte die Letalität einer Pockenvirusinfektion von 20 bis 30 % auf unter zwei Prozent.
Lady Mary Wortley Montagu berichtete 1718, dass die Türken im Osmanischen Reich sich in ähnlicher Weise den Körperflüssigkeiten von leicht Infizierten aussetzten, und wendete diese Methode bei ihren eigenen Kindern an. Spätestens in den Jahren ab 1770 beobachteten sechs Personen, darunter Sevel, Jensen, Jesty (1774), Rendall und Plett (1791),[3] dass Melkerinnen gegen Menschenpocken immun geworden waren, nachdem sie die vergleichsweise harmlosen Kuhpocken überstanden hatten. Sie impften daraufhin im Familien- und Bekanntenkreis erfolgreich mit der Kuhpockenlymphe.
Der englische Landarzt Edward Jenner erfuhr von Ärzten, mit denen er in Kontakt stand, dass Personen anscheinend nicht auf eine Pocken-Variolation ansprachen, wenn sie vorher an Kuhpocken erkrankt waren.[4] Jenner stellte daher die Hypothese auf, dass eine Inokulation mit Kuhpocken dieselbe Immunität ermögliche wie eine überstandene Erkrankung an Kuhpocken und daher Schutz vor den Pocken böte. Jenner entnahm infektiöse Flüssigkeiten von der Hand der mit Kuhpocken infizierten Magd Sarah Nelmes und führte diese durch Injektion oder Kratzen in den Arm des acht Jahre alten, gesunden James Phipps ein. James entwickelte Symptome einer Kuhpocken-Infektion, von der er vollständig genas. 48 Tage später führte Jenner eine zu dieser Zeit etablierte Pocken-Variolation durch. Der Junge entwickelte keine Pockensymptome. Da Kuhpocken verwendet wurden, entstand die Bezeichnung Vakzination (von lat. vacca ‚Kuh‘). Die weltweiten Impfungen mit Pockenimpfstoffen in der zweiten Hälfte des 20. Jahrhunderts führten bis 1980 zur Eradikation der Pocken in der freien Wildbahn,[5] denn humane Pockenviren haben kein Reservoir in anderen Tierarten.[6] Das war die erste weltweite Eradikation einer Infektionskrankheit des Menschen.[7]

Neben der Verwendung von Pathogenen anderer Arten kamen in Folge weitere Methoden hinzu. Louis Pasteur untersuchte in den 1870er Jahren Impfstoffe gegen Hühnercholera und Milzbrand.[8] Im Jahr 1879 entdeckte er zufällig, dass die später als Attenuierung bezeichnete Gewöhnung von Erregern an neue Umgebungsbedingungen (an andere Wirte oder Zellkulturbedingungen) eine mildere Impfreaktion bzw. Infektion und dennoch eine Immunität hervorrief.[9] Er hatte eine Zellkultur von Hühnercholerabakterien über Nacht der Luft ausgesetzt und diese Kultur erfolgreich verimpft. Allerdings ging er irrtümlich davon aus, dass der Erreger durch den Luftkontakt dauerhaft geschwächt wurde.[9] Heute ist bekannt, dass Erreger unter neuen Umgebungsbedingungen nicht mehr benötigte Virulenzfaktoren verlieren können, wenn kein Selektionsdruck mehr darauf ausgeübt wird. Dadurch entstehen schlechter an den ursprünglichen Wirt angepasste Erreger, die sich in diesem Wirt schlechter vermehren, weniger Erkrankung erzeugen und trotzdem eine Immunität hervorrufen. Allerdings kann diese Gewöhnung bei nur kleinen Änderungen auch zurück erfolgen, was als Reversion bezeichnet wird und in sehr seltenen Fällen zur Erkrankung nach Impfung führen kann, wie es später beim attenuierten Polioimpfstoff von Albert Sabin beobachtet wurde.[10] Seit 1998 wird der Sabin-Lebendimpfstoff gegen Poliomyelitis nicht mehr von der ständigen Impfkommission empfohlen und seit 1999 nicht mehr in Europa verwendet, nur noch der inaktivierte Totimpfstoff nach Jonas Salk.[11]
Virale Impfstoffe der nächsten Generation bestanden aus Gründen der Arzneimittelsicherheit vermehrt aus inaktivierten (z. B. der Polioimpfstoff von Salk),[12] gespaltenen (z. B. der Influenzaimpfstoff) oder attenuierten Virionen, wie der 17D-Gelbfieberimpfstoff von Max Theiler,[13] der Impfstoff gegen das Poliovirus von Albert Sabin oder das Modified Vaccinia Ankara von Anton Mayr.[14][15] Max Theiler erhielt 1951 den Nobelpreis für Physiologie oder Medizin für seine „Entdeckungen über Gelbfieber und seine Bekämpfung“.[16]
Aus den Spaltimpfstoffen gingen die gereinigten Antigene (auch Untereinheiten-Impfstoffe, engl. subunit vaccines) wie das HBsAg des Hepatitis-B-Virus im Jahr 1981,[17] Konjugatimpfstoffe wie gegen Haemophilus influenzae im Jahr 1983[18] und auch die synthetisch erzeugten Peptidimpfstoffe hervor,[19][20] die durch eine Proteinreinigung bzw. im letzten Fall durch eine Peptidsynthese weniger Nebenwirkungen durch Kontaminationen erzeugten, weniger bzw. im letzten Fall kein Risiko einer Erkrankung besaßen und bei denen sich die Dosis leichter einstellen ließ, die jedoch auch oftmals weniger wirksam in Hinblick auf den Impfschutz waren. Diese Impfstoffe wirkten (mit Ausnahme der attenuierten Pathogene) vor allem außerhalb der Zelle auf die humorale Immunantwort, da nur eine geringe Aufnahme in Zellen und nur eine geringe anschließende Präsentation der Epitope an MHCI für eine zelluläre Immunantwort erfolgte. Bei intrazellulären Erregern ist eine ausschließliche humorale Immunantwort ineffektiv.[21] Daher wurden in den folgenden Jahren verstärkt genetische Impfstoffe entwickelt, deren Antigene im Zytosol erzeugt und anschließend in Peptide zerlegt an MHCI präsentiert werden, wodurch auch eine zelluläre Immunantwort entsteht.
Die erste Verwendung eines viralen Vektors zur Impfung – ein MVA-Virus, das für HBsAg codierte – wurde 1983 von der Arbeitsgruppe von Bernard Moss publiziert.[22][23] Im Jahr 1993 wurde DNA von Jeffrey Ulmer und Kollegen verimpft.[24] Der erste Einsatz von RNA zu Impfzwecken wurde 1993 von Frédéric Martinon, Pierre Meulien und Kollegen[25][26] und 1994 von X. Zhou, Peter Liljeström und Kollegen bei Mäusen beschrieben.[27][26] Martinon konnte zeigen, dass durch die Impfung mit einem RNA-Impfstoff eine zelluläre Immunantwort induziert wurde.[26] Im Jahr 1995 beschrieben Robert Conry und Kollegen, dass nach Impfung mit einem RNA-Impfstoff auch eine humorale Immunantwort hervorgerufen wurde.[28][26] Während DNA-Impfstoffe in den ersten Jahren aufgrund der einfachen Herstellung, geringen Kosten und hohen Stabilität gegenüber abbauenden Enzymen häufiger erforscht wurden, aber trotz enthaltener immunstimulierender CpG-Motive (binden an den Rezeptor TLR-9) teilweise geringe Impfantworten hervorbrachten,[29][30] erfolgte später vermehrt Forschung an RNA-Impfstoffen, deren Immunogenität aufgrund enthaltener anderer immunstimulierender Motive (RNA bindet unter anderem an manche Toll-like-Rezeptoren) oftmals besser war und bei denen im Gegensatz zu DNA-Impfstoffen[31] keine Insertion in das Genom des Geimpften möglich war. Dementsprechend waren die ersten für den Menschen zugelassenen Impfstoffe aus RNA oder DNA im Jahr 2020 der RNA-Impfstoff Tozinameran und im folgenden Jahr der DNA-Impfstoff ZyCov-D, die als SARS-CoV-2-Impfstoffe verwendet wurden. Virale Vektoren waren zuvor ab 2015 als Ebola-Impfstoffe zugelassen worden.
Wirkungsweise
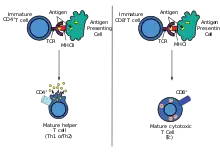
Die Immunreaktion gegen verimpfte Antigene und gegen die darauf liegenden Epitope des Antigens kann nach der Wirkungsweise und dem Wirkort innerhalb des Körpers in zwei Gruppen eingeteilt werden: MHC-I-präsentierte und MHC-II-präsentierte Epitope. Alle zugelassenen Impfstoffe weisen MHCII-präsentierte Epitope auf. Die Antigene werden von Zellen per Endozytose aus der Lymphe aufgenommen, teilweise in Peptide zerlegt und an MHCII, einem Protein zur Bindung dieser Bruchstücke, per Exozytose an die Zelloberfläche sezerniert und den CD4-tragenden T-Helferzellen des Immunsystems präsentiert, wodurch diese aktiviert werden, sich teilen und weitere Zellen des Immunsystems aktivieren. In Folge werden von B-Zellen Antikörper gebildet (humorale Immunantwort). Ein Teil der B-Zellen verbleibt als Gedächtniszellen im Geimpften.
Bei attenuierten und genetischen Impfstoffen entsteht dagegen das Antigen im Zytosol der Zelle, wodurch zusätzlich zur humoralen eine zelluläre Immunantwort entsteht. Im Zytosol wird das Antigen am Proteasom zerlegt. Die Bruchstücke (ebenfalls Peptide) werden vom Zytosol über den Antigenpeptid-Transporter in das endoplasmatische Retikulum importiert, wo sie an MHCI binden und anschließend an die Zelloberfläche sezerniert werden, um CD8-tragenden zytotoxischen T-Zellen präsentiert zu werden. Auch hier entstehen Gedächtniszellen. Membranproteine werden bei attenuierten und genetischen Impfstoffen (zusätzlich zur MHC-Präsentation der Peptide) in voller Länge an der Zelloberfläche präsentiert.
Zusammensetzung
Neben dem Impfstoff und meist Wasser als Lösungsmittel enthält ein als Arzneimittel formulierter Impfstoff oftmals weitere Bestandteile. Zur Senkung der notwendigen Dosis an Impfstoff, um eine definierte Impfwirkung zu erreichen, wird oftmals ein wirkungsverstärkender Zusatz (Adjuvans) verwendet.
Impfstoffe enthalten oftmals Konservierungsmittel, um eine Kontamination mit Bakterien oder Pilzen zu verhindern. Viele Impfstoffe benötigen Konservierungsmittel, um schwerwiegende unerwünschte Wirkungen zu verhindern, wie z. B. eine Staphylokokkeninfektion, an der 12 von 21 Kindern starben, die 1928 mit einem Diphtherieimpfstoff geimpft worden waren, der kein Konservierungsmittel enthielt.[32] Konservierungsstoffe können in verschiedenen Stadien der Impfstoffherstellung verwendet werden, und die Spuren von ihnen sind mit modernen Nachweisverfahren im Endprodukt messbar, ebenso wie in der Umwelt und der Bevölkerung.[33] Es gibt mehrere Konservierungsmittel, darunter Thiomersal, 2-Phenoxyethanol und Formaldehyd. Früher wurde das Konservierungsmittel Thiomersal (in den USA und Japan auch Thimerosal genannt) in vielen Impfstoffen verwendet, die keine replikationsfähigen Viren enthielten (Totimpfstoffe). Heutzutage wird es im Wesentlichen nur noch in pandemischen Impfstoffen in Mehrdosenbehältnissen verwendet. Thiomersal ist zwar wirksamer gegen Bakterien, hat eine bessere Haltbarkeit und verbessert die Stabilität, Wirksamkeit und Sicherheit des Impfstoffs. In den USA, der Europäischen Union und einigen anderen wohlhabenden Ländern wird Thiomersal jedoch aufgrund seines Quecksilbergehalts als Vorsichtsmaßnahme (per Vorsorgeprinzip) nicht mehr als Konservierungsmittel in Kinderimpfstoffen verwendet.[34] Obwohl Behauptungen aufgestellt wurden, dass Thiomersal zur Entstehung von Autismus beitrage, gibt es keine wissenschaftlichen Beweise für diese Behauptungen.[35] Darüber hinaus ergab eine 10-11-Jahres-Studie mit 657.461 Kindern, dass der MMR-Impfstoff keinen Autismus verursacht und das Autismusrisiko sogar um sieben Prozent reduziert.[36][37]
Oftmals enthalten Impfstoffe Puffersubstanzen zur Stabilisierung des pH-Werts. Auch Frostschutzmittel wie Saccharose (Rohrzucker) zur Verminderung der Zerstörung des Impfstoffs aufgrund von Scherkräften durch wachsende Eiskristalle beim Gefrieren können enthalten sein. Von den Inhaltsstoffen sind Hilfsstoffe bei der Herstellung abzugrenzen. So können Impfstoffe, die in embryonierten Hühnereiern hergestellt werden, wie manche Grippeimpfstoffe, nach der Proteinreinigung kaum nachweisbare Spuren an Hühnereiweiß ohne allergisierendes Potential enthalten. Eine bekannte Hühnereiweißallergie stellt daher in der Regel keine Kontraindikation dar.[38] Ebenfalls in sehr geringen, teilweise kaum mehr nachweisbaren Mengen können Spuren an Substanzen aus der Herstellung enthalten sein (z. B. Antibiotika).[39] Da manche Antibiotika Allergene sind, sollte die Verwendung dieser Impfstoffe bei Allergikern vermieden oder klinisch überwacht werden.[40] Berechtigte und unberechtigte Sorgen um Nebenwirkungen und um einzelne enthaltene Substanzen, die große Anzahl an unterschiedlichen Impfstoffen pro Patient sowie Fehlinformationen tragen zu einer Impfmüdigkeit bei, welche die WHO im Jahr 2019 als eine der zehn größten Gefahren für die öffentliche Gesundheit bezeichnete.[41][42][43]
Passive Immunisierung
Aktive Immunisierung – Impfstoff-Typen
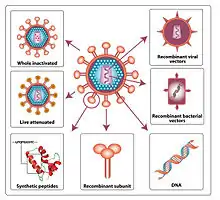
Vor allem in der Impfstoffentwicklung werden als Hauptgruppen Protein-Impfstoffe (Protein-basierte Impfstoffe) von Genetischen Impfstoffen (Genbasierte Impfstoffe) unterschieden. Totimpfstoffe enthalten inaktivierte oder abgetötete Viren oder Bakterien oder Bestandteile von Viren, Bakterien oder Toxinen. Diese können sich im Körper nicht mehr weitervermehren oder Krankheiten auslösen, wie es etwa das Cholerabakterium könnte, aber sie lösen ebenfalls eine Abwehrreaktion (Immunreaktion) aus. Beispiele sind die Impfstoffe gegen Influenza (Influenzaimpfstoff), Cholera, Beulenpest, Hepatitis A oder Hepatitis B (Hepatitis-B-Impfstoff). Totimpfstoffe bedürfen immunstimulierender Adjuvanzien, um eine ausreichende Immunantwort zu erreichen, meistens Alumiuniumsalze.
Gavi, die Impfallianz teilt die Impfstoffe in fünf Haupttypen ein:[44]
Ganzpartikel-Impfstoffe
Ganzpartikel-Impfstoffe werden in zwei Impfstoffklassen eingeteilt:[45]
- Lebendimpfstoffe sind abgeschwächte, infektiöse und teilweise replikationskompetente Erreger derselben Familie.
- Inaktivierte Impfstoffe sind Totimpfstoffe und damit weder infektions- noch replikationskompetent, da sie auf unterschiedlichen Wegen zerstört wurden oder nur einzelne Bestandteile enthalten. Hierzu gehören auch die Ganzvirus-Impfstoffe.
Lebend
Lebendimpfstoffe enthalten attenuierte, also aktive, doch abgeschwächte Bakterien oder Viren, die sich meistens noch vermehren können und eine Immunantwort auslösen, in der Regel jedoch keine Erkrankung. Auch ein attenuiertes Virus, das von einer Zelle noch vermehrt wird, nennt man „Lebendimpfstoff“. Die Bezeichnung hat sich durchgesetzt, obwohl sie streng genommen nicht korrekt ist, denn Viren sind keine Lebewesen.
Ein Lebendimpfstoff ist in der Regel deutlich wirksamer als ein Totimpfstoff. In seltenen Fällen kann es nach der Anwendung eines solchen Impfstoffes bei der möglichen Vermehrung der Erreger zu einer Mutation (Reversion) in Richtung der nicht abgeschwächten Ausgangsform (Wildtyp) kommen, durch die dann doch die Erkrankung eintreten kann.
Beispiele für attenuierte Impfstoffe sind die in Europa aufgegebene orale Polio-Schluckimpfung (OPV), der MMR(V)-Impfstoff, der Rotavirusimpfstoff, der damalige Pockenimpfstoff, der Bacillus Calmette-Guérin-Impfstoff sowie der Gelbfieberimpfstoff. Als Typhusimpfstoffe stehen sowohl Lebend- als auch Totimpfstoffe zur Verfügung. Die Attenuierung erfolgt meistens durch serielle Infektionen von artfremden Zellkulturen, embryonierten Hühnereiern oder Versuchstieren, bei dem sich der jeweilige Erreger an die neue Wirtsspezies anpasst und dabei oftmals gleichzeitig Anpassungen an die Art des Geimpften verliert, was sich in einer Verringerung der Pathogenität äußert.
Manche Lebendimpfstoffe werden durch weitere Methoden behandelt. Kälteadaptierte Stämme können sich nur bei Temperaturen um 25 °C vermehren, was die Viren auf die oberen Atemwege beschränkt. Bei temperatursensitiven Stämmen ist die Replikation auf einen Temperaturbereich von 38–39 °C beschränkt und es kommt auch hier nicht zum Befall der unteren Atemwege.
Attenuierte Ganzvirus-Impfstoffe stellen die einfachste Form von Impfstoffen dar und werden auch gegen das Pandemievirus SARS-CoV-2 entwickelt. Sie sind sehr immunogen und können schnell und einfach produziert werden, haben jedoch auch deutliche Nachteile. Der Erreger, gegen den man schützen möchte, wird zunächst in einer Zelllinie in Zellkultur angezüchtet und danach für den Impfstoff in aktiver (replikationsfähiger), aber abgeschwächter Form verwendet, die keine Krankheitssymptome mehr auslösen kann.[46] Beispiele hierfür sind der Masernimpfstoff oder einige Mumpsimpfstoffe.
Vor- und Nachteile
Lebendimpfstoffe sowie Totimpfstoffe lösen lang anhaltende bis lebenslange humorale Immunantworten aus, Lebendimpfstoffe[47] und genetische Impfstoffe auch eine zelluläre Immunantwort. Allerdings sind Lebendimpfstoffe etwas schlechter verträglich und bergen das – sehr geringe – Risiko einer Rückmutation in Krankheitserreger (Reversion) und damit der Auslösung einer (meist abgeschwächten) Form der Erkrankung, gegen die sie ursprünglich schützen sollten, beispielsweise zirkulierende, vom Impfstoff abgeleitete Polioviren (cVDPV) beim OPV.
Daher sollte nach aktuellen Empfehlungen des in Deutschland dafür zuständigen Robert Koch-Instituts eine Schwangerschaft mindestens einen Monat nach Impfung mit Lebendimpfstoffen vermieden werden.[48] Dagegen können fällige Impfungen mit Totimpfstoffen den werdenden Müttern im zweiten und dritten Drittel der Schwangerschaft bedenkenlos verabreicht werden; im ersten Drittel sollten zum Ausschluss jeglichen Risikos für das Kind dagegen nur diejenigen Totstoff-Impfungen vorgenommen werden, die individuell dringend indiziert sind. In der anschließenden Stillzeit sind Impfungen (außer gegen Gelbfieber) generell ohne Beschränkungen möglich.[48] Bei der Lebendimpfung mit dem Rotavirusimpfstoff sollte eine Stunde nach und vor dem Impfen nicht gestillt werden, um die Wirkung zu optimieren.
Unterschiedliche Lebendimpfstoffe können ohne Weiteres gleichzeitig (simultan) verabreicht werden.[49] Bei nicht gleichzeitiger Impfung soll der Abstand zwischen zwei Lebendimpfungen allerdings mindestens vier Wochen betragen. Totimpfstoffe oder eine Kombination mit ihnen betrifft dies nicht.
Inaktiviert
Inaktivierte Ganzpartikelimpfstoffe sind klassische Totimpfstoffe (inaktiviert bedeutet „nicht mehr vermehrungsfähig“). Bei ihnen erfolgt die Inaktivierung der Viren (inaktivierte Ganzvirus-Impfstoffe)[50] oder Bakterien durch Fixierung mittels einer kombinierten Anwendung von Formaldehyd, beta-Propiolacton und Psoralen.[51] Inaktivierte Ganzvirus-Impfstoffe werden durch chemische oder physikalische Methoden komplett inaktiviert. Es wird bei der Herstellung umfassend geprüft, ob die Inaktivierung tatsächlich vollständig ist und allein nach bestandener Überprüfung wird nur die jeweilige Impfstoff-Charge freigegeben.[46] Beispiele hierfür sind der FSME-Impfstoff oder der Tollwutimpfstoff.
Spalt
Eine Sonderrolle nehmen die Spaltimpfstoffe (englisch split virion vaccines) ein, dies sind ebenfalls Totimpfstoffe. Bei ihnen wird die Virusoberfläche mit Detergentien oder starken organischen Lösungsmitteln zerstört.[51]
Untereinheitenimpfstoffe
Untereinheitenimpfstoffe (englisch subunit vaccines) gehören zu den Protein-basierten Totimpfstoffen. Sie enthalten einzelne, gereinigte virale Proteine, die für eine Immunreaktion besonders bedeutsam sind.[52] Für die Herstellung wird die Oberfläche vollständig aufgelöst und spezifische Komponenten (Hämagglutinin- und Neuraminidase-Proteine) herausgereinigt. Eine andere Möglichkeit besteht darin, die Untereinheiten rekombinant herzustellen. Untereinheitenimpfstoffe sind nur wenig immunogen, besitzen dafür aber geringe Nebenwirkungen.[51] Häufig müssen solche Impfstoffe durch Adjuvanzien verstärkt werden.[52]
Protein
Protein-Untereinheitenimpfstoffe (englisch protein subunit vaccines).
Rekombinantes Protein
Bei diesen Impfstoffen werden Rekombinante Proteine verwendet. Dabei kann durch Kombination der Physiologie eines Mikroorganismus (Viren, Bakterien) mit der DNA eines anderen eine Immunität gegen Erreger mit komplexen Infektionsprozessen geschaffen werden.
Polysaccharid
Polysaccharid-Impfstoffe werden zum Beispiel gegen Pneumokokken eingesetzt.
Konjugiert
Bei konjugierten Impfstoffen wird zum Steigern der Immunogenität die Untereinheit an ein Proteinträgermolekül gekoppelt, z. B. bei Impfstoffen gegen bekapselte Bakterien wie Meningokokken.[51] Diese Bakterien, wie unter anderem auch Pneumokokken, verfügen über Polysaccharid-Außenhüllen, die nur schwache Immunantworten provozieren. Durch Verbindung dieser Außenhüllen mit Proteinen (wie Toxinen) kann das Immunsystem dazu gebracht werden, die Polysaccharide wie Proteinantigene zu erkennen.
Peptid
Bei Peptid-Impfstoffen (englisch peptide-based synthetic vaccines) werden statt ganzer Proteine lediglich kleinere Proteinfragmente, sogenannte Peptide, als Antigene eingesetzt.[53] Dabei handelt es sich um Peptide aus unterschiedlichen viralen Proteinen wie beispielsweise dem Spike- oder dem Nukleokapsid-Protein des SARS-CoV-2-Virus. Im Fall einer Infektion werden derartige Strukturen von einem trainierten Immunsystem sofort erkannt und eine effiziente Immunantwort in der Regel dann auch sehr schnell ausgelöst.[54][55]
Mit Effektor-Gedächtnis-T-Zell-Impfstoffen (engl. effector memory T-cell vaccines[56]) – nicht zu verwechseln mit der T-Zell-Vakzinierung – wird eine zelluläre Immunantwort induziert. Ziel dieser meist auf kurzen Peptiden basierenden Impfstoffe ist dabei die Generierung von cytotoxischen T-Zellen, von denen ein kleiner Teil (weniger als 5 %) nach der Vakzinierung als T-Gedächtniszellen im Organismus verbleiben. Bevorzugte Aufenthaltsorte der Gedächtniszellen sind dabei das Knochenmark, sowie nicht-lymphatisches und lymphatisches[57] Gewebe.[58] Effektor-T-Gedächtniszellen können noch Jahrzehnte nach der Vakzinierung innerhalb von wenigen Stunden nach einem erneuten Kontakt mit dem gleichen Antigen eine Immunantwort auslösen und so ggf. eine ausreichende Schutzwirkung entfalten.[59] Die Schutzwirkung der Gedächtniszellen kann über viele Jahre anhalten.[60][61] Entsprechende Impfstoffe, beispielsweise gegen das HI-Virus[56] oder das Humane Cytomegalievirus[62], befinden sich noch in der Entwicklung.
Virusartige Partikel
Bei diesen Impfstoffen werden virusartige Partikel (englisch virus-like particles, VLP) verwendet.[52] Diese bestehen aus viralen Struktur-Proteinen, die eine inhärente Eigenschaft zur Selbstorganisation besitzen und die sich spontan zu kleinen Bläschen zusammenlagern, die zumindest in Teilen die Morphologie des Erregers nachahmen und so eine Immunantwort zu provozieren vermögen.[63]
Toxoid-Impfstoffe
Toxoidimpfstoffe gehören zu den Totimpfstoffen und bestehen aus Toxoiden (Proteinen).[64] Dies sind entgiftete Toxine krankheitserregender Mikroorganismen. Diese Impfstoffe werden in Fällen verwendet, in denen nicht die Erreger selbst, sondern wie bei Tetanus und Diphtherie vor allem deren Toxine die Krankheitssymptome verursachen.
Nukleinsäure-Impfstoffe
Das besondere an diesen neuen Impfstoffen im Vergleich zu allen anderen ist, dass sich der Körper die Antigene, auf die er reagieren soll, selber herstellt. Es werden keine Viren oder Virusteile für den Impfstoff verwendet, sondern nur ein Teil des Virus-Erbgutes. Die darin enthaltene genetische Information in Form von DNA oder RNA beziehungsweise mRNA wird durch diesen Impfstoff in Zellen geschleust und dient dort als Bauplan für bestimmte Oberflächenproteine des zu bekämpfenden neuen Virus. Diese Proteine sind zwar ungefährlich, führen aber dazu, dass der Körper einen Immunschutz gegen die Proteine und damit die Viren aufbaut. Ein Vorteil von DNA- und mRNA-Impfstoffen ist, dass sie schnell in großen Mengen und zugleich auch günstig hergestellt werden können.[65]
DNA
Ein DNA-Impfstoff benötigt für die Impfung weder ein Trägervirus (Vektor) noch die Eiweißbestandteile (Antigene) des Erregers, sondern ein Gen mit der genetischen Information für den Bauplan des jeweiligen Antigens. Träger für diese genetische Information ist in der Regel ein ringförmiges DNA-Molekül (Plasmid), das in ungefährlichen Bakterien unter kontrollierten Bedingungen hergestellt wird[66] und im Impfstoff als flüssige Nanopartikel (Fetttröpfchen) enthalten ist.[67][68] So entstand in den letzten Jahren eine experimentelle Form der Impfung (DNA-Impfung), die per Injektion, Impfpflaster oder Genkanone angewendet wird. Hierbei wird virale oder bakterielle DNA in den Wirtsorganismus eingebracht und vor Ort exprimiert. Hierdurch wird sowohl eine humorale als auch eine zelluläre Immunreaktion bewirkt. Dabei entfallen nach bisherigem Stand der Forschungen die Nebenwirkungen der üblichen Impfmethoden. Theoretische Risiken sind allerdings die Möglichkeit einer Antikörperantwort auf das DNA-Molekül selbst sowie eine Integration der fremden DNA in das Genom, wobei aber die betroffene Zelle im Zuge der Immunantwort ohnehin über cytotoxische T-Zellen zerstört wird.
RNA
Bei einem RNA-Impfstoff / (mRNA-Impfstoff) wird wie auch beim DNA-Impfstoff kein Trägervirus, sondern der genetische Code verwendet, zumeist in Form von stabilisierter mRNA des jeweiligen Antigens.[69] Es gibt hierbei nicht-selbstreplizierende und selbstamplifizierende mRNA-Impfstoffe (RNA-Replikon).[70] Vorteile der Methode sind die Möglichkeit einer außerordentlich raschen Entwicklung, Anpassung und Produktion des Impfstoffs, eine sehr gute Verträglichkeit, eine überdurchschnittlich hohe Schutzwirkung sowie das im Vergleich zur DNA bessere Sicherheitsprofil, da eine Integration ins Erbgut ausgeschlossen ist und spezifische Antikörperantworten auf RNA-Moleküle nicht vorkommen.[71]
Ein weiterer Vorteil der stabilisierten mRNA ist die genaue Dosierbarkeit.[72] mRNA-Impfstoffe können ggf. intranasal verabreicht werden, müssen also nicht gespritzt werden.[73] Nachteilig war die anfangs bei manchen Produkten nötige aufwändige Kühlung mit Lagerungstemperaturen von −70 °C.
Verschiedene Methoden zur Intensivierung der Immunantwort wurden bereits erprobt, beispielsweise die Komplexierung mit Protamin. Einsatzgebiet war bis 2020 vor allem die Krebstherapie,[74] in der Corona-Pandemie wurden dann jährlich mehrere Milliarden mRNA-Impfdosen verabreicht.
Impfstoffe auf Basis viraler Vektoren
Bei Vektor-Impfstoffen werden entschärfte Trägerviren verwendet, die für den Menschen nicht schädlich sind, beispielsweise vermehrungsunfähige Adenoviren. Diese Trägerviren werden als virale Vektoren bezeichnet und dienen bei diesen Impfstoffen als eine Art Transporter für Teile des Virus-Erbmaterials, denn sie enthalten den Bauplan für bestimmte, spezifische Proteine des tatsächlich zu bekämpfenden Virus. Wenn diese genetischen Informationen in die Zelle gelangen, werden dort die entsprechenden viralen Proteine nachgebaut und an der Zelloberfläche präsentiert, woraufhin das Immunsystem genau auf diese Proteine reagiert und Antikörper zur Abwehr des betreffenden Virus bildet.[65]
Mosaik-Impfstoff – In den entschärften Trägerviren als Vektor sind mehrere antigene Varianten der Strukturgene enthalten, somit ein Patchwork von Gensequenzen, die bei verschiedenen Varianten des zu bekämpfenden Virus gefunden wurden.[75] Zielparameter sind selbstverständlich wie bei allen Vakzinen die Sicherheit, Verträglichkeit und Fähigkeit des Impfstoffes, eine deutliche Immunreaktionen auszulösen. So wurden beispielsweise erste positive Ergebnisse mit dem Mosaik-Impfstoff Ad26.Mos.HIV in Phase-I/ IIa-Studien gewonnen, der eine breite Immunantwort gegen viele der weltweit zirkulierenden HIV-1-Subtypen ermöglichen soll.[76] Auch gegen das Ebolafieber befindet sich schon ein Mosaik-Impfstoff in der Erprobung.[77]
Verabreichungsformen
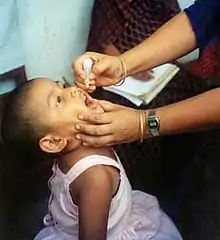
Die meisten Impfstoffe werden intramuskulär oder subkutan injiziert. Bei der intramuskulären Injektion wird ein größerer Muskel gewählt, der das Volumen des Impfstoffs besser aufnehmen kann. Für Lebendimpfstoffe eignen sich teilweise auch weniger invasive Verabreichungsformen, da sie sich im Geimpften replizieren bzw. repliziert werden, z. B. Tropfen für die Schleimhäute oder Aerosol-Inhalatoren. Als Polioimpfstoff war eine Schluckimpfung zugelassen. Der Pockenimpfstoff wird dagegen mit einer Bifurkationsnadel in die Haut eingeritzt. Experimentelle Applikationsformen umfassen unter anderem Impfpflaster, Genkanonen, Elektroporation, essbare transgene Pflanzen, fliegende Spritzen und Mikronadelanordnungen.
Im Bereich der Nutztierimpfung ist die nadellose, intradermale Impfung mittels Hochdruckimpfpistole etabliert.[78]
Kombinationsimpfstoffe
Kombinationsimpfstoffe enthalten im Gegensatz zu Monokomponentenimpfstoffen entweder eine spezifische Mischung von mehreren unterschiedlichen Krankheitserregern oder Bestandteilen verschiedener Erreger oder eine Mischung von deren inaktivierten Toxinen[79], sodass sie unterschiedliche Komponenten gegen verschiedene Infektionskrankheiten in sich vereinen und Schutz gegen diese Krankheiten mit einer Impfung gewährleisten können, zum Beispiel der DTP-Impfstoff. (Eine ausführlichere Liste findet sich am Ende des Artikels.) Empfohlen werden Impfungen mit diesen Kombinationsimpfstoffen, weil sie die Handhabung vereinfachen, die Zahl der Injektionen sowie der Impftermine verringern und daher auch die Kosten senken und die Durchimpfungsrate der Bevölkerung verbessern.
Wirtschaftliche Bedeutung
| Größte Impfstoffhersteller weltweit (2019)[80] | Marktanteil nach Umsatz | Marktanteil nach Stückzahl |
|---|---|---|
| GlaxoSmithKline | 40 % | 11 % |
| Pfizer | 17 % | unter Sonstige |
| MSD | 17 % | unter Sonstige |
| Sanofi | 15 % | 9 % |
| Serum Institute of India | 3 % | 28 % |
| Bharat Biotech | unter Sonstige | 9 % |
| Haffkine | unter Sonstige | 7 % |
| Sonstige | 9 % | 37 % |
Im Jahr 2019 wurden weltweit etwa 5,5 Milliarden Impfstoffdosen verabreicht, ohne die Reise- und Militärmedizin mitzuzählen.[80] Dies entspricht einem globalen Markt von 33 Milliarden US-Dollar und 2 % des globalen Markts für Arzneimittel.[80] Etwa 68 % des Impfstoffmarktes entfallen auf Länder mit hohem Einkommen.[80] Deutschlandweit betrugen die Ausgaben für Impfstoffe im Jahr 2018 1,3 Milliarden Euro.[81]
Die am häufigsten weltweit eingesetzten Impfstoffe waren 2019 Polio-, Diphtherie-, Tetanus- und Masernimpfstoffe.[80] Die Impfstoffherstellung erlebte angesichts der Bedrohung durch neu verbreitende Erreger, wie beispielsweise Vogelgrippe „H5N1“ und Schweinegrippe „H1N1“, sowie im Veterinärbereich die Blauzungenkrankheit und das Schmallenberg-Virus weltweit einen wirtschaftlichen Aufschwung.[82] So wurden 2001 weltweit 6,9 Milliarden US-Dollar umgesetzt. 2009 betrug der Markt rund 25 Milliarden US-Dollar.[83] Im Jahr 2014 betrug der Weltmarkt 26,7 Milliarden US-Dollar.[84]
Die Impfstoffherstellung ist angesichts der Komplexität und der höheren Kosten der Biologika unattraktiver als die Herstellung konventioneller Arzneimittel.[85] Impfstoffabriken kosten beim Bau zwischen 50 und 300 Millionen US-Dollar und dauern 4 bis 6 Jahre, wodurch der gesamte Zeitraum von den Anfängen der Impfstoffentwicklung bis zur Markteinführung zwischen 10 und 15 Jahren dauert.[86] Die Herstellung kann zwischen Monaten bis zu zwei Jahren dauern, die aufwändige Chargenprüfung stellt ein monetäres Risiko dar.[87] Zwischen 2006 und 2015 betrug die Erfolgsquote bei Biologika (einschließlich Impfstoffe) hinsichtlich der Arzneimittelzulassung in den USA nach Durchlaufen der erforderlichen klinischen Studien der Phasen I bis III 11,5 %.[88] Auch aufgrund wirtschaftlicher Erwägungen ist die Zahl der Impfstoffhersteller weltweit zurückgegangen.[89] Mehrfachimpfstoffe sind preislich günstiger als die korrespondierenden Einzelimpfstoffe zusammengerechnet.[90]
Weitere Impfstoffhersteller sind unter anderem IDT Biologika. Impfstoff-Hersteller aus Schwellenländern sind z. B. Panacea Biotec, Instituto Butantan, Bio-Manguinhos, Shanghai Pharma, Bharat Biotech, Poonawalla Group (Serum Institute of India), biofarma, Sinovac (China)[91] und Sinopharm. Hersteller in Entwicklungsländern beliefern zunehmend Entwicklungsländer, insbesondere bei älteren Impfstoffen in Brasilien, Indien und China.[86]
Rechtliche Stellung
In Deutschland zählen Impfstoffe zu den Arzneimitteln gemäß AMG:
„Impfstoffe sind Arzneimittel im Sinne des § 2 Abs. 1, die Antigene oder rekombinante Nukleinsäuren enthalten und die dazu bestimmt sind, bei Mensch oder Tier zur Erzeugung von spezifischen Abwehr- und Schutzstoffen angewendet zu werden und, soweit sie rekombinante Nukleinsäuren enthalten, ausschließlich zur Vorbeugung oder Behandlung von Infektionskrankheiten bestimmt sind.“
Damit unterliegt die Zulassung den im AMG beschriebenen allgemeinen Regeln, was über Prüfung der pharmazeutischen Qualität, Prüfung der Unbedenklichkeit und über klinische Prüfungen realisiert wird.[93] Der Arzt hat die Verantwortung zu entscheiden, welcher Impfstoff verwendet wird.
Auch in Österreich unterliegen Impfstoffe den Bestimmungen des Arzneimittelgesetzes und müssen infolgedessen wie andere Medikamente vor Gebrauch zugelassen werden.[94]
Der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur (EMA) definiert Impfstoffe als Fertigarzneimittel („medicinal product“).[95]
Liste von Impfstoffen
Im Folgenden eine grobe Übersicht aller aktuell verfügbaren oder in Entwicklung befindlichen Impfstoffe:[96]
Einteilung nach Art des Erregers
Impfstoffe können auch danach unterschieden werden, wogegen sie wirken sollen. So unterscheidet das Anatomisch-Therapeutisch-Chemische Klassifikationssystem (ATC) die Impfstoffe (ATC-Code J07) wie folgt:[96]
- Bakterielle Impfstoffe (ATC-Code J07A)
- Virale Impfstoffe (ATC-Code J07B)
- Kombinierte Impfstoffe, bakterielle und virale (ATC-Code J07C)
- Andere Impfstoffe (ATC-Code J07X)
Alle Impfstoffe sind den Antiinfektiva (ATC-Code J) zugeordnet (siehe auch „Liste von Impfstoffen“ in diesem Artikel).
Zugelassene Impfstoffe für Menschen
| Impfstoff | Erreger | Krankheit | Beispiele |
|---|---|---|---|
| Anthraximpfstoff | Bacillus anthracis (Anthraxtoxin) | Milzbrand | BioThrax |
| Bacillus Calmette-Guérin | Mycobacterium tuberculosis | Tuberkulose | |
| Choleraimpfstoff | Vibrio cholerae | Cholera | Dukoral, Vaxchora |
| Diphtherieimpfstoff | Corynebacterium diphtheriae (Diphtherietoxin) | Diphtherie | |
| Fleckfieberimpfstoff | Rickettsien | Fleckfieber | |
| Hib-Impfstoff | Haemophilus | Hib-Infektion | Hiberix |
| Meningokokkenimpfstoff | Meningokokken | Hirnhautentzündung, Blutvergiftung (Sepsis) u. a. | NeisVac-C, Nimenrix, Trumenba |
| Pertussisimpfstoff | Bordetella pertussis | Keuchhusten | |
| Pestimpfstoff | Yersinia pestis | Pest | |
| Pneumokokkenimpfstoff | Streptococcus pneumoniae | Lungenentzündung u. a. | Prevenar 13, Pneumovax 23, Synflorix |
| Q-Fieber-Impfstoff | Coxiella burnetii | Q-Fieber | |
| Tetanusimpfstoff | Clostridium tetani | Tetanus | |
| Typhusimpfstoff | Salmonella | Typhus | Typhim Vi, Viatim |
| Impfstoff | Beschreibung |
|---|---|
| Td-Impfstoff | Der Kombinationsimpfstoff enthält je eine Komponente gegen Tetanus und Diphtherie.[97] Die Kleinschreibung von d gibt an, dass der Antigengehalt dieser Komponente reduziert ist. |
| DTP-Impfstoff | Das ist ein Kombinationsimpfstoff, der in der Regel eine azelluläre Pertussis-Komponente aP bzw. Pa enthält. Er wird per Injektion zur Grundimmunisierung und Auffrischimpfung gegen drei unterschiedliche Infektionskrankheiten eingesetzt: Diphtherie, Tetanus und Keuchhusten (Pertussis). Der Impfstoff enthält keine vollständigen Bakterienzellen (w), sondern lediglich deren Bestandteile beziehungsweise inaktivierte Toxine. Wird einer der anderen Buchstaben in der Abkürzung klein geschrieben, ist die entsprechende Komponente reduziert. Ein TdPa-Impfstoff hat also einen verminderten Gehalt an inaktiviertem Diphtherietoxin (d). |
| Td-IPV-Impfstoff | Der Dreifach-Kombinationsimpfstoff enthält eine Komponente gegen je Tetanus, Diphtherie und Kinderlähmung (IPV). |
| TdPa-IPV-Impfstoff | Dieses Vakzin ist gegen 4 Infektionskrankheiten gerichtet: Diphtherie, Tetanus, Keuchhusten und Kinderlähmung. |
| DTPa-IPV+Hib-Impfstoff | Dieser Kombinationsimpfstoff ist gegen insgesamt 5 Infektionskrankheiten gerichtet: Diphtherie, Tetanus, Keuchhusten, Kinderlähmung und Haemophilus influenzae b-Infektion. Diese Impfung gehört zu den Basisimpfungen und wird Säuglingen entweder im 3+1-Impfschema (nach 2, 3, 4 und 11–14 Monaten) oder im reduzierten 2+1-Impfschema (Deutschland und einigen anderen EU-Ländern: im 2.+4. Monat, und 11. Monat, Schweiz: 2., 4. und 6. Monat) intramuskulär verabreicht.[98] |
| Hexavalenter Impfstoff | Im Vergleich zum pentavalenten Kombinationsimpfstoff enthält der Sechsfachimpfstoff noch zusätzlich eine Komponente gegen Hepatitis B (DTPa-HepB-IPV+Hib). Auch diese Impfung zählt zu den Basisimpfungen und wird im reduzierten 2+1-Impfschema (Deutschland und einigen anderen EU-Ländern) verabreicht. |
| MMR(V)-Impfstoff | Dieser Kombinationsimpfstoff ist eine Lebendimpfung mit einer Masern, Mumps- und Rötelnkomponente (gegebenenfalls zusätzlich eine Komponente gegen Varizellen) |
| Hepatitis A / Hepatitis B-Impfstoff | Ein Kombinationsimpfstoff gegen Hepatitis A und Hepatitis B. |
| Hepatitis A / Typhus-Impfstoff | Ein Kombinationsimpfstoff gegen Hepatitis A sowie gegen Typhus. |
Experimentelle Impfstoffe für Menschen
| Impfstoff | Erreger | Krankheit | Beispiele |
|---|---|---|---|
| Borreliose-Impfstoff | Borrelia burgdorferi | Lyme-Borreliose | |
| Lepra-Impfstoff | Mycobacterium leprae | Lepra | |
| Malariaimpfstoffe | Plasmodium | Malaria | RTS,S |
| Modified-Vaccinia-Ankara-Virus | Orthopoxvirus bovis | Kuhpocken | |
| HTLV-1-Impfstoff | Humanes T-lymphotropes Virus 1 | T-Zell-Leukämie, Tropische Spastische Paraparese | |
| Ehrlichiosis-Impfstoff | Anaplasma phagocytophilum | Humane Granulozytäre Anaplasmose | |
| Tripper-Impfstoff | Neisseria gonorrhoeae | Gonorrhoe („Tripper“) | |
| Onchozerkose-Impfstoff | Onchocerca volvulus | Onchozerkose („Flussblindheit“) | |
| Scharlach-Impfstoff | Streptococcus pyogenes | Scharlach u. a. | |
| Syphilis-Impfstoff | Treponema pallidum subspecies pallidum | Syphilis | |
| Staphylokokken-Impfstoff | Staphylococcus aureus | Erbrechen, Hautinfektionen u. a. | |
| Tularämie-Impfstoff | Francisella tularensis | Tularämie | |
| Karies-Impfstoffe | Streptococcus mutans | Karies |
| Impfstoff | Erreger | Krankheit | Beispiele |
|---|---|---|---|
| Hakenwurmimpfstoffe | Hakenwürmer | Anämie u. a. | |
| Schistosomiasisimpfstoffe | Pärchenegel | Schistosomiasis | |
| Trypanosomiasisimpfstoffe | Trypanosomen | Chagas-Krankheit, Schlafkrankheit | |
| Alzheimer-Impfstoffe | Alzheimer | Beta-Amyloid-Immuntherapie | |
| Krebsimpfstoffe | Krebs | Sipuleucel-T, Tecemotid, T-Vec | |
| Kokain-/Nikotin-Impfstoffe | Kokain-/Nikotin-Abhängigkeit | TA-CD, TA-NIC |
Zugelassene Impfstoffe für Tiere (Auswahl)
| Impfstoff | Erreger | Krankheit |
|---|---|---|
| Brucellose-Impfstoff | Brucella | Brucellose |
| Chlamydien-Impfstoff | Chlamydien | Chlamydiose |
| EEE-Impfstoff | Equine Encephalomyelitis-Virus | Östliche Pferdeenzephalomyelitis |
| Leishmaniose-Impfstofff | Leishmanien | Leishmaniose |
| Parvovirose-Impfstoff | Canine Parvovirus | Parvovirose |
| Staupe-Impfstoff | Canine Staupevirus | Staupe |
| Leptospirose-Impfstoff | Leptospira | Leptospirose |
| Bordetella-Impfstoff | Bordetella avium / Bordetella bronchiseptica |
Forschung und Entwicklung
Auf der Suche nach neuen oder besseren Impfstoffen werden fortlaufend neue Impfstoffkandidaten entwickelt und untersucht. Dabei werden unterschiedliche Verfahren des Impfstoffdesigns eingesetzt, um bestimmte Eigenschaften eines Impfstoffkandidaten zu verstärken oder abzuschwächen. Die zu optimierenden Eigenschaften umfassen die Impfstoffwirksamkeit und die Arzneimittelsicherheit bestehender oder neuer Impfstoffe.
Markerimpfstoffe
Bei Markerimpfstoffen (synonym DIVA-Impfstoffe, von englisch Differentiating Infected from Vaccinated Animals ‚Unterscheidung von infizierten und geimpften Tieren‘) fehlt ein Epitop, wodurch Geimpfte und Erkrankte unterschieden werden können. Bei Geimpften fehlt die Immunreaktion gegen dieses Epitop.
Siehe auch
Literatur
- Stanley Plotkin: History of vaccination. In: Proceedings of the National Academy of Sciences. Band 111, Nummer 34, August 2014, S. 12283–12287, doi:10.1073/pnas.1400472111, PMID 25136134, PMC 4151719 (freier Volltext).
- Kristen A. Feemster: Vaccines: What Everyone Needs to Know. Oxford University Press, New York 2017, ISBN 978-0-19-027790-1.
- Akiko Iwasaki, Saad B. Omer: Why and How Vaccines Work. In: Cell. Band 183, Nr. 2, 15. Oktober 2020, S. 290–295, doi:10.1016/j.cell.2020.09.040, PMID 33064982, PMC 7560117 (freier Volltext).
Weblinks
- Impfstoffe. Paul-Ehrlich-Institut, 21. November 2019.
- VIEW-hub. International Vaccine Access Center (IVAC), Johns Hopkins Bloomberg School of Public Health (englisch, Impfstoffe, Einführung und Verwendung von Impfstoffen, Impfgerechtigkeit, Impfstoff-Studien).
- Impfstoffe – wirksam und gut verträglich. In: kindergesundheit-info.de, BZgA: Bundeszentrale für gesundheitliche Aufklärung (BZgA) zu Impfungen von Kindern
- The History of Vaccines. The College of Physicians of Philadelphia: Informations- und Bildungswebsite der ältesten medizinischen Gesellschaft der USA.
- Emily K. Brunson: vaccine. In: britannica.com. Encyclopædia Britannica, 23. November 2021 (englisch).
Einzelnachweise
- K. Bourzac, D. Bernoulli: Smallpox: Historical Review of a Potential Bioterrorist Tool. In: Journal of Young Investigators. Band 6, Ausgabe 3, 2002.
- Joseph Needham: Science and Civilization in China. Band 6: Biology and Biological Technology. Teil 6: Medicine. Cambridge University Press, Cambridge 1999, S. 134.
- Sudhoffs Archiv. Band 90, Heft 2, 2006, S. 219–232.
- Arthur W. Boylston: The Myth of the Milkmaid. In: New England Journal of Medicine. Band 378, Nr. 5, Februar 2018, ISSN 0028-4793, S. 414–415, doi:10.1056/NEJMp1715349.
- H. Meyer, R. Ehmann, G. L. Smith: Smallpox in the Post-Eradication Era. In: Viruses. Band 12, Nummer 2, Januar 2020, S. , doi:10.3390/v12020138, PMID 31991671, PMC 7077202 (freier Volltext).
- M. K. Slifka, J. M. Hanifin: Smallpox: the basics. In: Dermatologic clinics. Band 22, Nummer 3, Juli 2004, S. 263–74, vi, doi:10.1016/j.det.2004.03.002, PMID 15207308.
- K. A. Simonsen, J. Snowden: Smallpox. 2021. In: StatPearls. StatPearls Publishing, PMID 29262186.
- Louis Pasteur, Übersetzer unbekannt: Translation of an address on the germ theory. In: The Lancet. Nr. 118, 1881, S. 271, doi:10.1016/S0140-6736(02)35739-8.
- Stanley A. Plotkin, Walter A. Orenstein: Vaccines. 5. Auflage, Saunders/ Elsevier, 2008. ISBN 978-1-4160-3611-1, S. 2–3.
- Wolfram Gerlich: Medizinische Virologie. Thieme, Stuttgart 2010, ISBN 3-13-113962-5. S. 466.
- Polio: Warum Spritzimpfung statt Schluckimpfung? Auf: gesundheit.de, aktualisiert am 25. Januar 2017, zuletzt abgerufen am 23. August 2021.
- J. E. Salk: Studies in human subjects on active immunization against poliomyelitis. I. A preliminary report of experiments in progress. In: Journal of the American Medical Association. 1953, Band 151, Nr. 13, S. 1081–1098, PMID 13034436.
- M. Theiler, H. H. Smith: The effect of prolonged cultivation in vitro upon the pathogenicity of Yellow Fever Virus. In: Journal of Experimental Medicine. 1937, Band 65, Nr. 6, S. 767–786, PMID 19870633, PMC 2133530 (freier Volltext).
- A. B. Sabin: Present status of attenuated live virus poliomyelitis vaccine. In: Bulletin of the New York Academy of Medicine. 1957, Band 33, Nr. 1, S. 17–39, PMID 13383294, PMC 1806054 (freier Volltext).
- A. Mayr, V. Hochstein-Mintzel, H. Stickl: Abstammung, Eigenschaften und Verwendung des attenuierten Vaccinia-Stammes MVA. In: Infection. 1975, Band 3, S. 6–14.
- Max Theiler: The Nobel Prize in Physiology or Medicine 1951. In: nobelprize.org. 6. Oktober 2021, abgerufen am 6. Oktober 2021 (englisch).
- R. H. Purcell, J. L. Gerin: Hepatitis B subunit vaccine: a preliminary report of safety and efficacy tests in chimpanzees. In: American Journal of the Medical Sciences. 1975, Band 270, Nr. 2, S. 395–399, PMID 828832.
- R. Schneerson, O. Barrera, A. Sutton, J. B. Robbins: Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. In: Journal of Experimental Medicine. 1980, Band 152, Nr. 2, S. 361–376, PMID 6967514, PMC 2185954 (freier Volltext).
- A. Nelde, H. G. Rammensee, J. S. Walz: The Peptide Vaccine of the Future. In: Molecular & cellular proteomics : MCP. Band 20, 2021, S. 100022, doi:10.1074/mcp.R120.002309, PMID 33583769, PMC 7950068 (freier Volltext).
- A. Patronov, I. Doytchinova: T-cell epitope vaccine design by immunoinformatics. In: Open Biology. 2013, Band 3, Nr. 1, S. 120139, doi:10.1098/rsob.120139, PMID 23303307, PMC 3603454 (freier Volltext).
- Eckhart Buddecke: Molekulare Medizin. ecomed-Storck, 2002, ISBN 3-609-16091-8. S. 162.
- G. L. Smith, M. Mackett, B. Moss: Infectious vaccinia virus recombinants that express hepatitis B virus surface antigen. In: Nature. Band 302, Nummer 5908, April 1983, S. 490–495, doi:10.1038/302490a0, PMID 6835382.
- C. Y. Yong, H. K. Ong, S. K. Yeap, K. L. Ho, W. S. Tan: Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus. In: Frontiers in Microbiology. Band 10, 2019, S. 1781, doi:10.3389/fmicb.2019.01781, PMID 31428074, PMC 6688523 (freier Volltext).
- J. B. Ulmer, J. J. Donnelly, S. E. Parker, G. H. Rhodes, P. L. Felgner, V. J. Dwarki, S. H. Gromkowski, R. R. Deck, C. M. DeWitt, A. Friedman: Heterologous protection against influenza by injection of DNA encoding a viral protein. In: Science. Band 259, Nummer 5102, März 1993, S. 1745–1749, doi:10.1126/science.8456302, PMID 8456302.
- F. Martinon, S. Krishnan, G. Lenzen, R. Magné, E. Gomard, J. G. Guillet, J. P. Lévy, P. Meulien: Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. In: European journal of immunology. Band 23, Nr. 7, Juli 1993, S. 1719–1722, doi:10.1002/eji.1830230749, PMID 8325342.
- Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt, Heleen Dewitte: Three decades of messenger RNA vaccine development. In: Nano Today. Nr. 28, 2019, S. 100766, doi:10.1016/j.nantod.2019.100766.
- X. Zhou, P. Berglund, G. Rhodes, S. E. Parker, M. Jondal, P. Liljeström: Self-replicating Semliki Forest virus RNA as recombinant vaccine. In: Vaccine. Band 12, Nr. 16, Dezember 1994, S. 1510–1514, doi:10.1016/0264-410x(94)90074-4, PMID 7879415.
- R. M. Conry, A. F. LoBuglio, M. Wright, L. Sumerel, M. J. Pike, F. Johanning, R. Benjamin, D. Lu, D. T. Curiel: Characterization of a messenger RNA polynucleotide vaccine vector. In: Cancer Research. Band 55, Nummer 7, April 1995, S. 1397–1400, PMID 7882341.
- D. Eusébio, A. R. Neves, D. Costa, S. Biswas, G. Alves, Z. Cui,.. S: Methods to improve the immunogenicity of plasmid DNA vaccines. In: Drug discovery today. [elektronische Veröffentlichung vor dem Druck] Juni 2021, doi:10.1016/j.drudis.2021.06.008, PMID 34214667.
- L. Li, N. Petrovsky: Molecular mechanisms for enhanced DNA vaccine immunogenicity. In: Expert review of vaccines. Band 15, Nummer 3, 2016, S. 313–329, doi:10.1586/14760584.2016.1124762, PMID 26707950, PMC 4955855 (freier Volltext).
- Matthias Giese: Molecular Vaccines. Springer Science & Business Media, New York 2013, ISBN 978-3-319-00978-0, S. 497.
- Thimerosal in vaccines. Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6. September 2007. Archiviert vom Original am 6. Januar 2013. Abgerufen am 1. Oktober 2007.
- Measurements of Non-gaseous air pollutants > Metals. In: npl.co.uk. National Physics Laboratory. Archiviert vom Original am 29. September 2007. Abgerufen am 28. Juni 2020.
- Bigham M, Copes R: Thiomersal in vaccines: balancing the risk of adverse effects with the risk of vaccine-preventable disease. In: Drug Safety. Band 28, Nr. 2, 2005, S. 89–101. doi:10.2165/00002018-200528020-00001. PMID 15691220.
- Offit PA: Thimerosal and vaccines – a cautionary tale. In: The New England Journal of Medicine. Band 357, Nr. 13, September 2007, S. 1278–1279. doi:10.1056/NEJMp078187. PMID 17898096.
- Reuters Updated March 5, 2019: Another study, this one of 657k kids, finds MMR vaccine doesn't cause autism | Montreal Gazette. 5. März 2019. Abgerufen am 13. März 2019.
- Jan Hoffman: One More Time, With Big Data: Measles Vaccine Doesn't Cause Autism. In: The New York Times, 5. März 2019. Abgerufen am 13. März 2019.
- Ist eine Impfung mit MMR-Impfstoff bei Hühnereiweißallergie möglich? In: RKI. 15. Dezember 2016, abgerufen am 1. November 2021.
- FAQ Impfstoffe. In: BASG. 13. September 2019, abgerufen am 1. November 2021.
- K. Weißer, I. Barth, B. Keller-Stanislawski: Sicherheit von Impfstoffen. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 52, Nr. 11, 1. November 2009, S. 1053–1064, doi:10.1007/s00103-009-0961-y.
- S. Geoghegan, K. P. O'Callaghan, P. A. Offit: Vaccine Safety: Myths and Misinformation. In: Frontiers in Microbiology. Band 11, 2020, S. 372, doi:10.3389/fmicb.2020.00372, PMID 32256465, PMC 7090020 (freier Volltext).
- P. Löffler: Review: Vaccine Myth-Buster - Cleaning Up With Prejudices and Dangerous Misinformation. In: Frontiers in immunology. Band 12, 2021, S. 663280, doi:10.3389/fimmu.2021.663280, PMID 34177902, PMC 8222972 (freier Volltext).
- I. Ullah, K. S. Khan, M. J. Tahir, A. Ahmed, H. Harapan: Myths and conspiracy theories on vaccines and COVID-19: Potential effect on global vaccine refusals. In: Vacunas. Band 22, Nummer 2, Mai-August 2021, S. 93–97, doi:10.1016/j.vacun.2021.01.001, PMID 33727904, PMC 7951562 (freier Volltext).
- Vaccines Explained. In: gavi.org. Gavi, die Impfallianz, 21. April 2021, archiviert vom Original am 7. Januar 2022; abgerufen am 6. Januar 2022 (englisch, Abschnitt „What different types of vaccines are there?“): „Whole virus vaccine […] Nucleic acid […] Viral vector […] Subunit, recombinant, polysaccharide and conjugate vaccines […] Toxoid vaccines“
- Andreas Merkle et al.: Prüfung von Impfstoffen. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 57, 2014, S. 1188, doi:10.1007/s00103-014-2037-x.
- Theo Dingermann: Ganzvirus-Impfstoffe als einfachste Form. Auf: pharmazeutische-zeitung.de vom 10. Juni 2020; abgerufen am 14. Januar 2021.
- Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie. 5. Auflage. Thieme, Stuttgart 2014, ISBN 978-3-13-125315-6, S. 729 ff.
- Kann in der Schwangerschaft und Stillzeit geimpft werden? Robert Koch-Institut, 17. April 2015, abgerufen am 4. Februar 2020.
- Impfschema: Häufig gestellte Fragen und Antworten. Welche Abstände sind zwischen Impfungen einzuhalten? RKI, 25. Juni 2020, abgerufen am 1. November 2021.
- Ganzvirus-Impfstoffe als einfachste Form in www.pharmazeutische-zeitung.de
- Abhishek Vartak, Steven Sucheck: Recent Advances in Subunit Vaccine Carriers. In: Vaccines. Band 4, Nr. 2, 19. April 2016, ISSN 2076-393X, S. 12, doi:10.3390/vaccines4020012, PMID 27104575, PMC 4931629 (freier Volltext) – (mdpi.com [abgerufen am 12. Oktober 2021]).
- Theo Dingermann: Protein-basierte Impfstoffe und VLP. (ANMERKUNG: Mit den dort beschriebenen „Proteinbasierten Impfstoffen“ sind genauer die „Proteinbasierten Untereinheitenimpfstoffe“ gemeint.), auf: pharmazeutische-zeitung.de vom 1. Juli 2020; abgerufen am 14. Januar 2021.
- Rino Rappuoli: Vaccine Design. Horizon Scientific Press, 2011, ISBN 978-1-904455-74-5, S. 13.
- Theo Dingermann: Erste Studie zu Peptid-Impfstoff gegen Covid-19 genehmigt. Auf: pharmazeutische-zeitung.de vom 10. Juni 2020; abgerufen am 14. Januar 2021.
- Paul-Ehrlich-Institut - Pressemitteilung 25 / 2020: Erste klinische Prüfung eines Peptid-Impfstoffs gegen COVID-19 in Deutschland genehmigt. Auf: pei.de; aktualisiert am 1. Dezember 2020, abgerufen am 14. Januar 2021.
- L. J. Picker: Are effector memory T cells the key to an effective HIV/AIDS vaccine? In: EMBO reports. Band 15, Nummer 8, August 2014, S. 820–821, doi:10.15252/embr.201439052, PMID 24980866, PMC 4197036 (freier Volltext).
- A. Lanzavecchia, F. Sallusto: Understanding the generation and function of memory T cell subsets. In: Current opinion in immunology. Band 17, Nummer 3, Juni 2005, S. 326–332, doi:10.1016/j.coi.2005.04.010, PMID 15886125 (Review).
- F. Di Rosa, T. Gebhardt: Bone Marrow T Cells and the Integrated Functions of Recirculating and Tissue-Resident Memory T Cells. In: Frontiers in immunology. Band 7, 2016, S. 51, doi:10.3389/fimmu.2016.00051, PMID 26909081, PMC 4754413 (freier Volltext) (Review).
- J. D. Lelièvre, Y. Lévy: HIV-1 prophylactic vaccines: state of the art. In: Journal of virus eradication. Band 2, Nummer 1, Januar 2016, S. 5–11, PMID 27482428, PMC 4946697 (freier Volltext) (Review).
- S. C. Gilbert: T-cell-inducing vaccines - what's the future. In: Immunology. Band 135, Nummer 1, Januar 2012, S. 19–26, doi:10.1111/j.1365-2567.2011.03517.x, PMID 22044118, PMC 3246649 (freier Volltext) (Review).
- J. T. Harty, V. P. Badovinac: Shaping and reshaping CD8+ T-cell memory. In: Nature Reviews Immunology. Band 8, Nummer 2, Februar 2008, S. 107–119, doi:10.1038/nri2251, PMID 18219309 (Review).
- K. Früh, L. Picker: CD8+ T cell programming by cytomegalovirus vectors: applications in prophylactic and therapeutic vaccination. In: Current opinion in immunology. Band 47, August 2017, S. 52–56, doi:10.1016/j.coi.2017.06.010, PMID 28734175, PMC 5626601 (freier Volltext) (Review).
- Theo Dingermann: Weiterentwicklung der Protein-Impfstoffe: VLP auf: pharmazeutische-zeitung.de vom 10. Juni 2020
- Toxoid Auf: sciencedirect.com.
- Welche Ansätze für Corona-Impfstoffe gibt es? Auf: ndr.de vom 18. September 2020; abgerufen am 14. Januar 2021.
- Paul-Ehrlich-Institut: Neuer WHO-Leitfaden zu modernen DNA-Impfstoffen. Auf: pei.de vom 9. Juli 2020; zuletzt abgerufen am 19. Januar 2021.
- Paul-Ehrlich-Institut: Welche Impfstoffkonzepte werden bei der Entwicklung eines Impfstoffs gegen SARS-CoV-2 verfolgt? Auf: pei.de vom 3. April 2020; zuletzt abgerufen am 19. Januar 2021.
- Fraunhofer-Institut für Produktionsanlagen und Konstruktionstechnik: Die Rettung naht- mRNA-basierte Impfstoffe gegen das neuartige Coronavirus sind vielversprechend, aber schwierig herzustellen. Lässt sich ihre Produktion durch neue Verfahren beschleunigen? Abschnitt "Molekulare Schützenhilfe" Auf: ipk.fraunhofer.de von 2021, zuletzt abgerufen am 19. Januar 2021.
- Using mRNa to target tumours. Auf: pharmaceutical-technology.com vom 15 Februar 2018; zuletzt abgerufen am 22. Oktober 2020.
- Pravin Shende, Mansi Waghchaure: Combined vaccines for prophylaxis of infectious conditions. In: Artificial Cells, Nanomedicine, and Biotechnology. Band 47, Nr. 1, 2019, ISSN 2169-1401, S. 696–705, doi:10.1080/21691401.2019.1576709, PMID 30829068.
- Birgit Scheel et al.: Toll-like receptor-dependent activation of several human blood cell types by protamine-condensed mRNA. In: European Journal of Immunology. Band 35, Nr. 5, Mai 2005, S. 1557–1566, doi:10.1002/eji.200425656, PMID 15832293.
- Jochen Probst: Immuntherapie. Messenger RNA-basierte Impfstoffe zur Behandlung von Krebserkrankungen. In: Biospektrum. 13. Jahrgang, Nr. 1, 2007, S. 49–51.
- J. C. Lorenzi, A. P. Trombone, C. D. Rocha et al.: Intranasal vaccination with messenger RNA as a new approach in gene therapy: use against tuberculosis. In: BMC Biotechnol.. Band 10, 2010, S. 77. doi:10.1186/1472-6750-10-77. PMID 20961459. PMC 2972232 (freier Volltext).
- A. Bringmann, S. A. Held, A. Heine, P. Brossart: RNA vaccines in cancer treatment. In: Journal of Biomedicine and Biotechnology. Band 2010, Artikel 623687, doi:10.1155/2010/623687, PMID 20625504, PMC 2896711 (freier Volltext).
- Nicola, Siegmund-Schultze: Impfstoffentwicklung: Mosaikvakzine gegen HIV erprobt. In: Deutsches Ärzteblatt. 2017, Band 114, Nr. 42, Artikel: A-1934
- Andrea Warpakowski: HIV-Vakzine Erste Erfolge mit Mosaik-Impfstoff. In: MMW - Fortschritte der Medizin. 21 Januar 2019, Band 161, S. 71, doi:10.1007/s15006-019-0076-9.
- Janine Kimpel, Christof Geldmacher: Aus der Klinischen Forschung - Design und Funktionsweise von Vektor-basierten Impfstoffen. In: Trillium Immunologie. 2019, Heft 3/2019.
- C. C. L. Chase, C. S. Daniels, R. Garcia et al.: Needle-free injection technology in swine: Progress toward vaccine efficacy and pork quality. In: Journal of Swine Health and Production. Band 16, Nummer 5, 2008 S. 254–261.
- Paul-Ehrlich-Institut (PEI): Kombinations-Impfstoffe. Auf: pei.de, aktualisierte Fassung vom 11. Januar 2021.
- Weltgesundheitsorganisation: 2020 Global Vaccine Market Report., abgerufen am 6. März 2022.
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Krankenkassen geben mehr Geld für Impfungen aus. 11. Juli 2019, abgerufen am 21. April 2021.
- Yvonne Genzel, Timo Frensing, Udo Reichl: Herstellung moderner Grippeimpfstoffe. Zellkultur statt Hühnerei. In: Chemie in unserer Zeit. Februar 2013, Band 47, Nr. 1, S. 12–22, doi:10.1002/ciuz.201200606.
- Research and Markets: The Future of Global Vaccines - Market Forecasts to 2016, Stockpile Analysis, Competitive Benchmarking and Pipeline Analysis. Auf: www.businesswire.com Business Wire, 15. Januar 2010, abgerufen am 5. Oktober 2013.
- R. Gordon Douglas, Vijay B. Samant: The Vaccine Industry. In: Plotkin's Vaccines, 2018. doi: 10.1016/B978-0-323-35761-6.00004-3, PMC 7151793 S. 41–50.e1.
- Bedeutung von Impfungen - Antworten des Robert Koch-Instituts und des Paul-Ehrlich-Instituts zu den 20 häufigsten Einwänden gegen das Impfen. In: RKI. 22. April 2016, abgerufen am 6. Februar 2020.
- Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit, Kathryn M. Edwards: Vaccines. Elsevier, 2017, ISBN 9780323393010, S. 43.
- Faktencheck: Gerüchte und Wahrheiten zum Thema Impfen. ZEIT, 23. April 2019, abgerufen am 1. Mai 2020.
- Clinical Development Success Rates 2006-2015. BIO Industry Analysis. Juni 2016.
- Ursula Wiedermann-Schmidt: Impfen: Wann. Wogegen. Warum. Manz'sche Verlags- und Universitätsbuchhandlung, Wien 2016, ISBN 978-3-214-08089-1, S. 109.
- Susanne Kutter: Vorsorge: Die größten Mythen über das Impfen. In: Handelsblatt. 9. August 2013, abgerufen am 6. Februar 2020.
- Impfstoff-Tests in Südamerika - Das Corona-Labor. Auf: faz.net vom 16. September 2020, zuletzt abgerufen am 11. Januar 2021.
- Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz - AMG) § 4 Sonstige Begriffsbestimmungen. Auf: gesetze-im-internet.de, zuletzt abgerufen am 11. Januar 2021.
- Rüdiger Zuck: Impfrecht. Impfempfehlungen. Impfentscheidung. In: Medizinrecht. Band 26, Nr. 7, 1. Juli 2008, S. 410–414, doi:10.1007/s00350-008-2212-x.
- Zulassung von Impfstoffen. In: gesundheit.gv.at. 2020, abgerufen am 13. Mai 2020 (österreichisches Deutsch).
- Guideline on similar biological medicinal products. (PDF) In: EMA. Ausschuss für Humanarzneimittel, 30. Oktober 2005, S. 6, abgerufen am 24. Oktober 2021 (englisch).
- ATC/DDD-Klassifikation als PDF-Version Jahr 2020 (3,7 MB)
- Kombinations-Impfstoffe. In: Paul-Ehrlich-Institut. 11. Januar 2021, abgerufen am 18. Januar 2021.
- Epidemiologisches Bulletin 26/2020. In: RKI. 25. Juni 2020, abgerufen am 18. Januar 2021.
.jpg.webp)