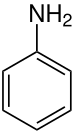
Anilin
Anilin (nach spanisch oder auch arabisch: an-nil = blau = Indigo-Farbe) oder Benzenamin ist eine klare, farblose bis schwach gelbliche, ölige Flüssigkeit mit eigenartigem Geruch, die an der Luft schnell rötlich-braun wird.[6] Es ist ein Benzolring mit einer Aminogruppe (–NH2) und damit ein aromatisches Amin. Mit Säuren versetzt bildet es Anilinsalze. Die basische Wirkung von Anilin wird durch den mesomeren Effekt abgeschwächt, da dieser die Elektronendichte der Aminogruppe verringert.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Anilin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H7N | |||||||||||||||||||||
| Kurzbeschreibung |
ölige, farblose bis braune Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 93,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
184 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (36 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Brechungsindex |
1,5863 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Nomenklatur
Der systematische IUPAC-Name lautet Benzenamin. Die inzwischen bevorzugte IUPAC-Bezeichnung ist jedoch Anilin.[7] Derivate des Anilins werden historisch unter der Benutzung der Silbe "Anil" bezeichnet; bspw. Anilazin, Acetanilid.
Geschichte
Anilin wurde 1826 von Otto Unverdorben erstmals durch Kalkdestillation aus Indigo hergestellt.[8] Er nannte das erhaltene Öl Crystallin (eine charakteristische Eigenschaft ist die Bildung kristallisierbarer Salze mit Säuren). 1834 isolierte Friedlieb Ferdinand Runge erstmals Anilin aus der lange Zeit wichtigsten Quelle, dem Steinkohlenteer[9], und nannte es Kyanol (Blauöl, nach dem Verhalten der Substanz gegenüber Chlorkalklösung). Carl Julius Fritzsche hatte 1840 das Anilin aus der Destillation von Anthranilsäure erhalten, er konnte auch die Identität des von Zinin dargestellten Produktes nachweisen.[10] Zinin erhielt Anilin (von ihm Benzidam genannt) aus Nitrobenzol durch Reduktion mit Schwefelwasserstoff.[11] A. W. Hofmann zeigte, dass diese Verbindungen identisch sind, er konnte ferner das Nitrobenzol mit einem deutlich verbesserten Verfahren (Zink + Säure) zu Anilin reduzieren.[12][13]
Seit 1897 wird Anilin von der Badischen Anilin- und Soda-Fabrik (BASF) zur Synthese des vorher nur aus pflanzlichen Rohstoffen gewonnenen Farbstoffs Indigo eingesetzt (Heumann-Synthese[14]). Schon vorher wurde Anilin in großem Maßstab hergestellt, etwa von der Agfa (Actien-Gesellschaft für Anilin-Fabrication) ab 1873. Eine bekannte Anwendung des Farbstoffes war Anilinleder. Auch in der Drucktechnik wurde Anilin verwendet, u. a. bekam der Flexodruck den auch heute noch verwendeten Beinamen Anilindruck, da erst durch das Anilin eine gute Druckqualität erzeugt werden konnte.
Herstellung
Großtechnisch wird Anilin durch Hydrierung von Nitrobenzol in der Gasphase bei 270 °C und 1,25 bar an einem Kupfer-Katalysator auf Siliciumdioxid hergestellt.[15] Hierfür wird ein Wirbelschichtreaktor verwendet.
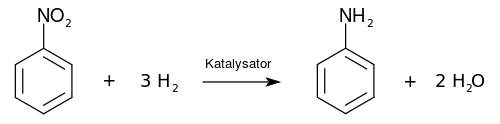
Daneben ist die Hydrierung an einem Nickelsulfidkatalysator auf Aluminiumoxid im Festbettreaktor möglich.
Veraltet ist das Verfahren, mit dem Anilin durch Reduktion von Nitrobenzol mit Eisen in Gegenwart von Salzsäure (Béchamp-Reduktion) gewonnen wurde:
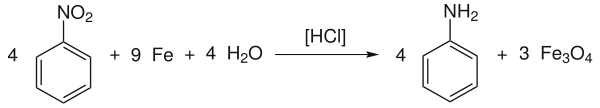
Anschließend wird mit Branntkalk (CaO) neutralisiert, und das Anilin zusammen mit dem Wasser abdestilliert. Das als Nebenprodukt entstehende Eisen(II,III)-oxid kann als Pigment eingesetzt werden.
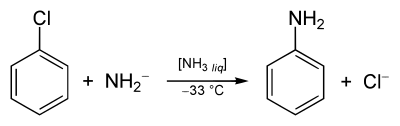
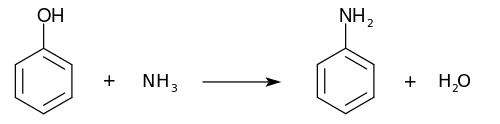
Es gibt noch andere Verfahren, zum Beispiel die Ammonolyse von Chlorbenzol oder Phenol:
Verwendung
Es dient in der chemischen Industrie in erster Linie als Ausgangsstoff für die Synthese von Farben und Kunstfasern, aber auch zur Herstellung von Synthesekautschuk und Medikamenten und als Komponente hypergoler Treibstoffe in der Raumfahrt.
Reaktionen
Anilin ist eine schwache Base. Aromatische Amine wie Anilin sind im Allgemeinen viel schwächere Basen als aliphatische Amine.
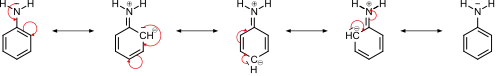
Die schwache Basizität von Anilin lässt sich auf eine Kombination aus induktivem Effekt des elektronegativeren sp2-Kohlenstoffs und Resonanzeffekten zurückführen, da das freie Elektronenpaar des Stickstoffs teilweise in das π-System des Benzolrings delokalisiert wird.
Dabei wird jedoch die Solvatisierung nicht berücksichtigt, welche die Basizität des Anilins wesentlich bestimmt. Im Verhältnis zu Ammoniak beispielsweise ist die Gasphase des Anilins basischer, während die wässrige Lösung 10.000 mal weniger basisch ist.[16]
An der Aminogruppe
Anilin ist das einfachste aromatische Amin und nur wenig wasserlöslich. Um die Wasserlöslichkeit zu begünstigen bzw. diese zu erhöhen, wird Anilin mit einer Säure (beispielsweise Salzsäure) versetzt; dies führt zur sofortigen Salzbildung. Mit Salzsäure entsteht das Hydrochlorid Aniliniumchlorid:
Lässt man Anilin mit seinem Salz (beispielsweise Anilinhydrochlorid) in der Hitze reagieren, so entsteht das Diphenylamin:
Bei der Reaktion von Anilin mit Essigsäureanhydrid entsteht N-Phenylacetamid (Acetanilid):
Die Darstellung von Nitrobenzol aus Anilin ist ebenfalls möglich. Dabei wird das Anilin mit einem Oxidationsmittel (wie zum Beispiel Wasserstoffperoxid, mCPBA, Kaliumpermanganat, Chrom(VI)-oxid oder Blei(IV)-oxid) über die Zwischenstufe Nitrosobenzol zum Nitrobenzol umgesetzt.
Die Reaktion von Nitrosobenzol und Anilin führt durch Wasserabspaltung zum Azobenzol:
Eine direkte Nitrierung mit Nitriersäure führt zu Oxidationen der Aminogruppe. Die gewünschten Nitroaniline erhält man erst nach vorherigem Schützen der Aminogruppe als Acetanilid.
Wenn man die nun erhaltenen Nitroaniline mithilfe eines Reduktionsmittels (wie zum Beispiel Zink in Salzsäure, Natriumborhydrid, Lithiumaluminiumhydrid oder Natriumsulfit) reduziert, erhält man die Phenylendiamine:
Ebenso ist auch die Reaktion mit dem Namen Diazotierung bekannt. Dabei reagiert das Anilin mit Natriumnitrit in Gegenwart von zum Beispiel Salzsäure oder mit Salpetriger Säure zum Benzoldiazoniumchlorid:
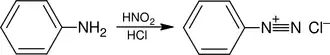
Das Benzoldiazoniumchlorid ist ein starkes, instabiles Elektrophil, das in der Farbstoffchemie eine große Anwendung findet. Das Benzoldiazoniumchlorid kann dabei zum Beispiel mit Wasser zu Phenol unter Stickstoffverlust reagieren. Ebenso ist eine Sandmeyer-Reaktion in Gegenwart von Kupfer(I)-chlorid und Salzsäure unter Wärmezufuhr möglich – dabei entsteht das Chlorbenzol ebenfalls unter Stickstoffverlust. Unter Beibehaltung der beiden Stickstoffatome lässt sich das Benzoldiazoniumion zum Beispiel mit Natriumsulfit in wässriger Lösung zum Phenylhydrazin reduzieren:
Lässt man das Benzoldiazoniumchlorid zum Beispiel mit einer alkalischen 2-Naphthol-Lösung () reagieren, so erhält man das sog. Sudan I. Diese Reaktion wird auch als Kupplungsreaktion, genauer als Azokupplung bezeichnet:
Abgesehen von den Naphtholen können auch andere Kupplungsreagenzien wie zum Beispiel 1-Naphthylamin eingesetzt werden. Aufgrund der Vielzahl an möglichen Kupplungsreagenzien existieren viele wichtige Azofarbstoffe, deshalb bilden sie zahlenmäßig auch die stärkste Farbstoffklasse.
Lässt man Anilin mit Formaldehyd (37%ig) nach dem Mechanismus der Imin-Bildung reagieren erhält man das N-Methylidenanilin:
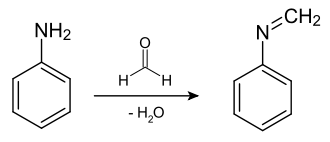
Zuerst greift der Stickstoff der Aminogruppe des Anilins an der Aldehydgruppe (Carbonylgruppe) des Formaldehyd an. Aus dem doppelt gebundenen Sauerstoff der Aldehydgruppe wird ein einfach gebundener mit einer negativen Ladung. Der Stickstoff ist vorerst positiv geladen, bis er sein Proton an den negativ geladenen Sauerstoff der Aldehydgruppe abgibt. Spontan oder durch Zugabe eines wasserentziehenden Mittels wird aus dem Molekül Wasser abgespalten (Hydroxygruppe des ehemaligen Formaldehyds + Proton des Stickstoffs). Zustande kommt eine Verbindung der allgemeinen Struktur R′–N=CH–R′′. N-Methylidenanilin gehört zu der Verbindungsklasse der Azomethine (Schiffschen Basen) und besitzt aufgrund der Methylidengruppe einen sehr reaktiven Angriffspunkt für Nucleophile.
Die Reaktion von Anilin mit Benzaldehyd führt zum Benzalanilin (Benzylidenanilin):
Am Ring
Die Sulfonierung ist eine elektrophile aromatische Substitution SE. Als elektrophiles Teilchen wird Schwefeltrioxid (SO3) eingeführt, welches durch Reaktion von Schwefelsäure mit sich selbst gebildet wird:
Bildung des Elektrophils (Schwefeltrioxid):
Nach dem Prinzip der elektrophilen Substitution (Sulfonierung) ist die Sulfanilsäure synthetisierbar.
Auch weitere elektrophile Substitutionen sind möglich. Beispielsweise die Halogenierung, die Friedel-Crafts-Alkylierung und die Friedel-Crafts-Acylierung.
Eine katalytische Hydrierung von Anilin in Gegenwart eines Katalysators führt zum Cyclohexylamin (CHA). Als Katalysator für katalytische Hydrierungen benutzt man üblicherweise (Edel)-Metalle wie zum Beispiel Palladium:
Sicherheitshinweise
Anilin ist ein starkes Blutgift. Es oxidiert den roten Blutfarbstoff Hämoglobin zu Methämoglobin und verhindert damit den Sauerstofftransport im Blut. Das Gift kann durch Schlucken, Einatmen und durch die Haut aufgenommen werden. Bei leichten Vergiftungen kommt es zur Blaufärbung der Haut und der Fingernägel (Zyanose), zu Schwindelanfällen und Erregungszuständen. Bei höherer Konzentration treten Kopfschmerzen, Schwindel, Bewusstseinsstörungen und Atemnot auf. Letzteres kann den Tod verursachen. Langfristige Vergiftungserscheinungen zeigen sich in Schwächegefühl, Appetitlosigkeit und Blasenkrebs.
Anilin war 1981 auch eine der Ursachen für die in Spanien durch verunreinigtes Rapsöl aufgetretene Massenvergiftung (Spanisches Ölsyndrom):[17] Mit Anilin vergälltes Rapsöl für industrielle Zwecke wurde dabei redestilliert und anschließend über Straßenhändler als „Olivenöl“ verkauft. 20.000 Personen erkrankten, mehr als 300 starben. Die genauen Hintergründe der Vergiftung sind bis heute allerdings ungeklärt.
Siehe auch
Literatur
- Karl Aloys Schenzinger: Anilin – Roman eines Farbstoffes. 1936.
- Christian Mähr: Von Alkohol bis Zucker – Zwölf Substanzen, die die Welt veränderten. Köln 2010, ISBN 978-3-8321-9549-6.
- Margarete Bruns: Von Azurit, Indigo und Anilin. Zur Geschichte der blauen Farbe. In: Emil Ernst Ploß: Ein Buch von alten Farben. Technologie der Textifarben im Mittelalter mit einem Ausblick auf die festen Farben. 6. Auflage. München 1989, ISBN 978-3-89164-060-9, S. 14–20.
- Einen „Beitrag zur Geschichte wissenschaftlicher Entdeckungen“ – Die Entdeckung des Anilin durch Friedlieb Ferdinand Runge. In: Die Gartenlaube. Heft 4, 1863, S. 64 (Volltext [Wikisource]).
Weblinks
Einzelnachweise
- Eintrag zu Anilin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Mai 2017.
- Eintrag zu Anilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-26.
- Eintrag zu Aniline im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 62-53-3 bzw. Anilin), abgerufen am 14. September 2019.
- Hunnius Pharmazeutisches Wörterbuch. 6. Auflage. Walter de Gruyter, Berlin / New York 1986, S. 68.
- Henri A Favre, Warren H Powell: Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Hrsg.: The Royal Society of Chemistry. Cambridge 2014, ISBN 978-0-85404-182-4, S. 416, 668.
- Otto Unverdorben: Ueber das Verhalten der organischen Körper in höheren Temperaturen, Annalen der Physik und Chemie, 1826, VIII, S. 397–410 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. F. Runge: Ueber einige Produkte der Steinkohlendestillation, Annalen der Physik und Chemie, 1834, XXXI, S. 65–78 (doi:10.1002/andp.18341070502; eingeschränkte Vorschau in der Google-Buchsuche).
- J. Fritzsche: Über das Anilin, ein neues Zersetzungsprodukt des Indigos, Annalen der Chemie, 1840, 36 (1), S. 84–90 (doi:10.1002/jlac.18400360108).
- Dr. N. Zinin: Beschreibung einiger neuer organischer Basen, dargestellt durch die Einwirkung des Schwefelwasserstoffes auf Verbindungen der Kohlenwasserstoffe mit Untersalpetersäure, Journal für praktische Chemie, 1842, S. 140–153 (doi:10.1002/prac.18420270125; eingeschränkte Vorschau in der Google-Buchsuche).
- A. W. Von Hofmann, J. S. Muspratt: Neue Bildungsweisen des Anilins, Annalen der Chemie, 1845, 53 (2), S. 221–229 (doi:10.1002/jlac.18450530206; eingeschränkte Vorschau in der Google-Buchsuche).
- A. W. von Hofmann: Über eine sichere Reaction auf Benzol, Liebigs Annalen, 1845, 55 (2), S. 200–205 (doi:10.1002/jlac.18450550205).
- In: Ber. dt. Chem. Ges., 23, 1890, S. 3043, gallica.bnf.fr
- H. Wittcoff et al.: Industrial Organic Chemicals. 2004, Chapter 7, S. 294.
- March, Jerry, 1929–1997.: March's advanced organic chemistry : reactions, mechanisms, and structure. 6. Auflage. Wiley-Interscience, Hoboken, N.J. 2007, ISBN 0-471-72091-7 (englisch).
- E. Gelpí et al.: The Spanish Toxic Oil Syndrome 20 Years after Its Onset: A Multidisciplinary Review of Scientific Knowledge. In: Environmental Health Perspectives, 2002, 110 (5), S. 457–464, PMID 12003748; PMC 1240833 (freier Volltext).