Blanc-Reaktion
Die Blanc-Reaktion, auch Blanc-Chlormethylierung, ist eine Namensreaktion der organischen Chemie und nach dem französischen Chemiker Gustave Louis Blanc (1872–1927) benannt. Durch sie kann eine Chlormethylgruppe (–CH2Cl) in Aromaten eingeführt werden.[1][2]
Übersichtsreaktion
In folgender Übersichtsreaktion reagiert ein Aromat (hier Benzol 1) mit Formaldehyd 2 und Salzsäure 3 über Zinkchlorid als Katalysator zu Benzylchlorid 4:
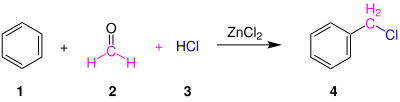
Allgemeines
Vorreiter dieser Reaktion waren Grassi-Cristaldi und Maselli um 1898,[3] Gustave Louis Blanc hat diese Reaktion allerdings um 1923 weiterentwickelt[4] und seither ist sie als die Blanc-Reaktion bekannt. Es werden für die Reaktion Temperaturen von 105–127 °C benötigt und sie kann auch mit verschiedenen Lewissäuren[5] (AlCl3, NiCl2 etc.) durchgeführt werden. Neben Salzsäure kann auch Phosphorsäure benutzt werden. Statt Formaldehyd kann auch dessen trimerisierte Form, also Trioxan eingesetzt werden.[6] Allerdings sollte eine anschließende Reduktion durchgeführt werden um gute Ausbeuten zu erhalten (zwischen 69 und 92 %).[7] Wichtig ist diese Reaktion vor allem für die Herstellung von Harzen, da sie eine Alternative zu üblichen Polymerisationen darstellt.[8]
Vorgeschlagener Reaktionsmechanismus
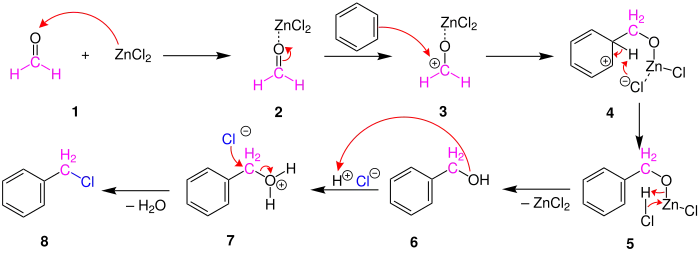
Die Reaktion verläuft im Sinne einer SEAr-Reaktion (Elektrophile aromatischen Substitution). In Gegenwart saurer Katalysatoren lässt sich Formaldehyd auch mit weniger reaktionsfähigen Aromaten umsetzen. Zunächst wird mit Hilfe von Zinkchlorid aus dem Formaldehyd ein elektrophiles Carbokation gebildet. Dieses geht dann in 3 nach der schon erwähnten SEAr-Reaktion eine Bindung mit einem Aromaten ein. Durch Rearomatisierung 4 und Abspaltung des Zinkchlorids 5 erhalten wir ein Benzylalkohol 6. Die Hydroxygruppe in 6 wird protoniert unter Bildung des Oxoniumions 7. Durch Wasserabspaltung und Angriff des Chlorid-Ions entsteht in einer Substitutionsreaktion Benzylchlorid 8 als Endprodukt:[9]
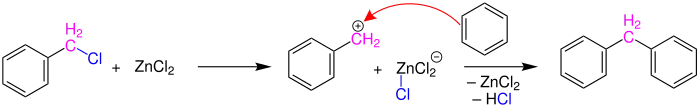
Als Konkurrenzreaktion kann wie folgt die Friedel-Crafts-Alkylierung eintreten, dabei würde ein Diarylmethan (im Beispiel Diphenylmethan) entstehen:
Kritik
Obgleich die Chlormethylierung nach Blanc eine sehr effiziente Methode darstellt, hat sie einen schwerwiegenden Nachteil: bei der Reaktion von Formaldehyd mit Chlorwasserstoff wird in geringem Maße hochgradig karzinogener Bis(chlormethyl)ether gebildet.[10] Daher sollte ihre Notwendigkeit bei der Syntheseplanung kritisch überdacht werden.
Literatur
- Organikum. VEB Deutscher Verlag der Wissenschaften, Berlin 1976.
- Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 1, Wiley, 2009, S. 429–432, ISBN 978-0-471-70450-8.
- Bradford P. Mundy, Michael G Ellerd, Frank G. Favaloro Jr.: Name Reactions and reagents in Organic Syntheses, second Edition, Wiley-Interscience, 2005, S. 100, ISBN 0-471-22854-0.
Einzelnachweise
- Gustave Louis Blanc in: Bull. Soc. Chim. France. 33, 1923, S. 313.
- Reynold C. Fuson, C. H. McKeever: Chloromethylation of Aromatic Compounds. In: Organic Reactions. 1, Nr. 3, 1942, S. 63–90.
- Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 1, Wiley, 2009, S. 429, ISBN 978-0-471-70450-8.
- Blanc, M.G.,: Bulletin de la Société Chimique de France. Band 33, 1923, S. 313.
- Louis F. Fieser, Arnold M. Seligman: Journal of the American Chemical Society. Band 57, 1935, S. 942–946, doi:10.1021/ja01308a050.
- Yolanda T. Pratt: Journal of the American Chemical Society. Band 73, 1951, S. 3803–3807, doi:10.1021/ja01152a071.
- Reynold C. Fuson, C. H. McKeever: Journal of the American Chemical Society. Band 62, 1940, S. 784–785, doi:10.1021/ja01861a026.
- K. S. Kumar, V. N. Rajasekharan Pillaia, Tetrahedron, 1999, 55, S. 10437–10446. doi:10.1016/S0040-4020(99)00569-4.
- Zerong Wang:Comprehensic Organic Name Reactions and Reagents, Volume 1, Wiley, 2009, S. 430, ISBN 978-0-471-70450-8.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry Oxford University Press, 2001, S. 575.