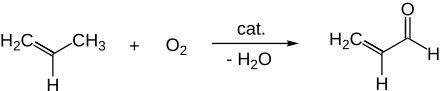Acrolein
Acrolein [akroleˈiːn] (auch Propenal, Acrylaldehyd, 2-Propenal bzw. Prop-2-enal oder Aqualin) ist eine Chemikalie und als Aldehyd der organischen Chemie zuzuordnen. Es ist ein klarer flüssiger Stoff, der die Summenformel C3H4O besitzt. Acrolein entsteht insbesondere bei der Zersetzung von Fetten aus dem Glycerolteil und zeigt sich durch einen stechenden Geruch.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
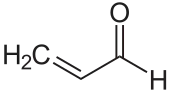 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acrolein | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H4O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche, leichtbewegliche Flüssigkeit mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 56,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,84 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
52 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (267 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Brechungsindex |
1,4017 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
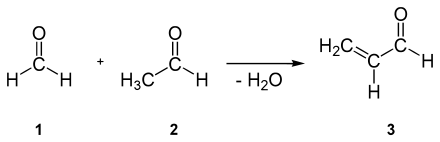
Acrolein (3) kann durch partielle Oxidation von Propen oder durch Reaktion von Acetaldehyd (2) mit Formaldehyd (1) gewonnen werden (Aldolkondensation):
Diese Methode ist heute durch das Sohio-Verfahren abgelöst worden.[2]
Die technische Herstellung in der chemischen Industrie erfolgt weitestgehend über die Gasphasenoxidation von Propan oder Propen in Gegenwart geeigneter heterogener Katalysatoren. Diese Partialoxidation am festen Kontakt (synonym zu „heterogener Katalysator“) erfolgt mit Luft als Oxidationsmittel bei Temperaturen um 330–390 °C, wobei Rohrbündelreaktoren eingesetzt werden, in denen die stark exotherme Reaktion mit Salzbädern gekühlt wird. Es wird nur eine relativ verdünnte Mischung von Propen mit Luft (meist noch in Gegenwart von Wasserdampf) eingesetzt, um die Bildung explosionsfähiger Gemische zu vermeiden. Die mit modernen Katalysatoren erzielbaren Ausbeuten betragen bis über 80 % bezüglich Propen, als Nebenprodukte entstehen um 5 % Acrylsäure und Kohlenstoffmonoxid und Kohlenstoffdioxid neben nicht umgesetztem Propen. Problematisch ist die Quenchung und Isolierung des Acroleins vor der weiteren Verwendung als Rohstoff für die Synthese von Methionin, Glutaraldehyd oder diversen Riechstoffen. Bei der Isolierung kommt es zur Polymerisation von Acrolein und anderen aktiven Nebenkomponenten (im Besonderen Acrylsäureester), die zum Abstellen der Anlage zwingen.[7][8]
Zudem ist Acrolein unerwünschtes Produkt vieler Verbrennungs- und Oxidationsreaktionen diverser organischer Verbindungen. Beim Verbrennen verschiedener organischer Substanzen (Druckertinte, Pflanzenöle, Biodiesel, Wachs, Tabak uvm.) entstehen Acroleindämpfe, zum Beispiel in der Industrie, bei Autoabgasen, Zigarettenrauch (bis 140 μg/Zigarette). So tritt der typische Acroleingeruch unmittelbar nach dem Erlöschen einer Kerze auf. Es entsteht auch beim Überhitzen pflanzlicher und tierischer Fette, zum Beispiel beim Frittieren.[2] Dieser Prozess wird durch das Vorhandensein von Wasser und Säuren deutlich erleichtert. Dabei wird das Fett (Triglycerid) zunächst in seine Bestandteile Glycerin und Fettsäuren zerlegt (Hydrolyse). Das Glycerin wird dann durch Wasserabspaltung zu Acrolein umgesetzt (Dehydratisierung).
In zunehmendem Maße wird versucht, Acrolein nicht mehr aus Propan oder Propen herzustellen. Propan und Propen sind Produkte der Petrochemie, basieren also auf Erdgas oder Erdöl. Diese fossilen Rohstoffe werden in der Zukunft zunehmend knapp. Deshalb versuchen viele Firmen, Acrolein durch Dehydratisierung von Glycerin zu gewinnen. Dieses fällt als billiges Nebenprodukt bei der Herstellung von Biodiesel aus natürlichen Fetten und Ölen an.[9]
Eigenschaften
Die geringe Größe von Acrolein, die Aldehydgruppe sowie die vorhandene Doppelbindung sorgen für eine hohe Reaktivität des Moleküls. In reiner Form ist Acrolein kaum stabil.
Aufgrund der vorhandenen C=C-Doppelbindung kann Acrolein leicht polymerisieren. Acrolein wird auch durch Addition von Wasser zu Glycerin umgesetzt.
Die Aldehydgruppe kann an Proteine binden. Daher wird Acrolein, ähnlich wie Formalin, in der Elektronenmikroskopie zur Fixierung eingesetzt. Der Vorteil liegt in der im Vergleich mit anderen Aldehyden besonders kurzen Reaktionszeit.
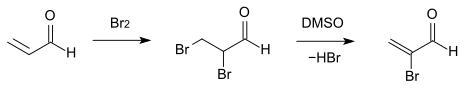
Acrolein reagiert mit elementarem Brom zur entsprechenden 2,3-Dibromverbindung, die mit Dimethylsulfoxid selektiv zum 2-Bromacrolein dehydrohalogeniert werden kann.[10]
Gefahren
Acrolein ist sehr giftig und zudem auch ein starkes Umweltgift. Es ist ein starker Wasser- und Meeresschadstoff und sehr schädlich für Fische. Die MAK-Kommission der DFG stuft Acrolein als krebserzeugend in die Kategorie 3 ein.[11] Unter diese Kategorie fallen Stoffe, die mit Verdacht auf krebserzeugender Wirkung Anlass zur Besorgnis geben. Acrolein ist sehr leicht entzündlich (Flammpunkt −26 °C, Zündtemperatur 215 °C) und kann mit der Luft explosionsfähige Gemische bilden (untere Explosionsgrenze 2,8 Vol-%, obere Explosionsgrenze 31 Vol.-%).[3]
Metabolische Bildung aus dem Zytostatikum Cyclophosphamid
Das Zytostatikum Cyclophosphamid wird in der Leber metabolisiert, wobei es zu einer nichtenzymatischen Spaltung in den eigentlichen Wirkstoff Chlorethylphosphorsäureamid und dem Nebenprodukt Acrolein kommt. Acrolein hat urotoxische Wirkung.
Verwendung
Acrolein wird als Zwischenprodukt in der großtechnischen Herstellung der synthetischen Aminosäure DL-Methionin[12] und dessen Hydroxyanalogon DL-2-Hydroxy-4-methylmercaptobuttersäure eingesetzt, die erhebliche wirtschaftliche Bedeutung als Mischfutterbestandteil in der Tierernährung besitzen.
Acrolein wird hauptsächlich als Zwischenprodukt bei der Synthese von chemischen Verbindungen (wie zum Beispiel Acrylsäure und β-Hydroxypropionaldehyd[13]) und als Biozid verwendet. Es entsteht auch beim Abbau bestimmter Schadstoffe in der Außenluft oder bei der Verbrennung von organischen Stoffen einschließlich Tabak oder Kraftstoffen wie Benzin oder Öl.[14] Die Messung Acrolein-haltiger Emissionen kann mittels 2-HMP-Verfahren erfolgen.[15]
Einzelnachweise
- Eintrag zu ACROLEIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- Eintrag zu Acrolein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu Acrylaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-8.
- Eintrag zu Acrylaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-02-8 bzw. Acrolein), abgerufen am 2. November 2015.
- Patent DE4023239A1: Patent Verfahren zur katalytischen gasphasenoxidation von propen oder iso-buten zu acrolein oder methacrolein - Google Patentsuche, abgerufen am 6. Februar 2017
- Houben-Weyl Methods of Organic Chemistry Vol. E 3, 4th Edition Supplement Aldehydes. Georg Thieme Verlag, 2014, ISBN 978-3-13-181134-9, S. 234 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dissertation Vanessa Lehr: Dehydratisierung von Glycerol zu Acrolein, Technischen Universität Darmstadt, 2008.
- W. Li, J. Li, Z.-K. Wan, J. Wu, W. Massewski: Preparation of α-Haloacrylate Derivatives via Dimethyl Sulfoxide-Mediated Selective Dehydrohalogenation. In Org. Lett 2007, 9, S. 4607–4610. doi:10.1021/ol7021142
- Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. Publisso, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.
- Eintrag zu Methionin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juni 2016.
- Datenblatt Acrolein bei Sigma-Aldrich, abgerufen am 7. März 2011 (PDF).
- US EPA: Acrolein, abgerufen am 16. April 2015.
- VDI 3862 Blatt 5:2008-06 Messen gasförmiger Emissionen; Messen niederer Aldehyde insbesondere Acrolein nach dem 2-HMP-Verfahren - GC-Methode (Gaseous emission measurement; Measurement of lower aldehydes especially acrolein with the 2-HMP-method - GC-method). Beuth Verlag, Berlin, S. 4.
Weblinks
- Eintrag zu Acrolein. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD.