Formosereaktion
Die Formosereaktion ist eine chemische Reaktion, bei der ein Gemisch von Zuckern entsteht; das Produkt wird auch Formose genannt. Die Formosereaktion ist die Selbstkondensation von Formaldehyd an basischen Katalysatoren wie den Oxiden und Hydroxiden von Calcium, Barium, Thallium und Blei, jedoch nicht von Natrium, in Anwesenheit von CH-aktiven Verbindungen. Es wird vermutet, dass die Formose-Reaktion eine Schlüsselreaktion bei der Entstehung der ersten Biomoleküle aus der Ursuppe war und somit die Basis für den Ursprung des Lebens darstellt.[1][2]
Durch sie entstehen zentrale Biomoleküle des Stoffwechsels wie Glycerinaldehyd, Pentosen und Hexosen aus dem einfachen C1-Baustein Formaldehyd. Die Pentosen sind die Grundlage der RNA, dem Träger der genetischen Information in der präbiotischen Phase der Evolution (Origin of Live). Die Reaktion wurde von Alexander Butlerow 1861 entdeckt[3] und ihr komplexer Mechanismus wurde über viele Chemikergenerationen hinweg untersucht.[1][2][4]
Reaktion
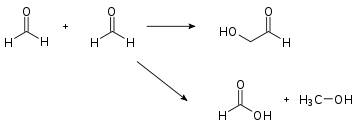
Cannizzaro-Reaktion
Der entscheidende Punkt bei dieser Reaktion ist die erste C-C-Verknüpfung. Formaldehyd kann nicht unkatalysiert mit sich selbst reagieren, weil ein Elektrophil nicht mit einem anderen Elektrophil reagiert und im Formaldehyd gibt es nur ein Kohlenstoffatom. In einer reinen, alkalischen Formalinlösung läuft normalerweise nur die Cannizzaro-Reaktion ab, die Methanol und Ameisensäure liefert (Bild 1).
Für eine C-C-Verknüpfung wird eines der beiden Kohlenstoffatome, zumindest zwischenzeitlich, umgepolt. Dies geschieht auf elegante Weise im Formosecyclus (Bild 2).
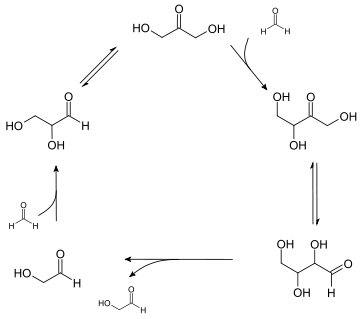
Autokatalytischer Cyclus der Formose-Reaktion
Wird eine alkalische Formalinlösung mit einer kleinen Menge einer α-Hydroxycarbonylverbindung, wie zum Beispiel Glycolaldehyd angeimpft, entwickelt sich innerhalb kurzer Zeit ein autokatalytischer Prozess, der die Reaktion in eine andere Richtung lenkt. Durch eine Aldoladdition entsteht aus Glycolaldehyd Glycerinaldehyd, welcher über die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung in Dihydroxyaceton überführt wird. Diese Verschiebung der Carbonylgruppe ist ganz wesentlich für den weiteren Aufbau der Kohlenstoffkette, denn dadurch wird das Reaktivitätsmuster umgepolt. Während im Glycerinaldehyd am C1 elektrophil und am C2 nukleophil war, wird im Dihydroxyaceton C2 elektrophil und C1 beziehungsweise C3, das formal aus dem vorher elektrophilen Formaldehyd stammt, nukleophil. Dort kann nun eine weitere Aldoladdition und somit eine weitere Kettenverlängerung stattfinden. Durch eine nochmalige van-Ekenstein-Umlagerung wird das Reaktivitätsmuster wieder zurückgeschoben, so dass durch eine Retroaldolspaltung zwei Mole Glycol gebildet werden, die in den autokatalytischen Cyclus zurückfließen.
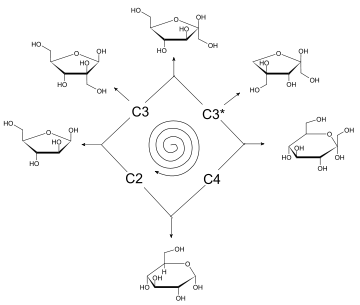
Zucker-Halbacetale
Nach dem ersten Umlauf verdoppelt sich die Glycolaldehydmenge, nach dem zweiten vervierfacht, nach dem 10. vertausendfacht, nach dem 20. Umlauf liegt der Faktor bei einer Million, nach dem 30. bei einer Milliarde usw. (Bild 3)
Die niederen Zucker Glycolaldehyd und Glycerinaldehyd können ihrerseits über Aldolkondensationen C5- oder C6-Zucker bilden. Sobald die Zucker die Größe von 5 oder 6 Kohlenstoffatomen erreicht haben, können sie cyclische Halbacetale ausbilden und scheiden somit als Carbonylverbindungen weitgehend aus dem Prozess aus, so dass keine höheren Kondensationsprodukte entstehen und somit die in der Natur weit verbreiteten Pentosen und Hexosen die stabilen Endprodukte der Reaktion sind.
Technisch kann diese Reaktion zur Herstellung von künstlichen Zuckern und nach deren Hydrogenolyse zur Herstellung von Glycolen (Ethylenglycol, Propylenglycol) verwendet werden.[4]
Selektive Formen der Formose-Reaktion
Mittels Vitamin B1 analogen Umpolungskatalysatoren auf der Basis von Thiazoliumyliden[5], Triazoliumyliden[6][7] und Perimidiniumyliden[8] kann die Formose-Reaktion selektiv zu Glycolaldehyd beziehungsweise Dihydroxyaceton gelenkt werden.
| Katalytische Umpolung | ||
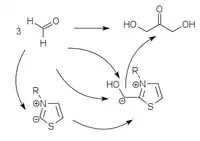 |
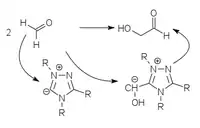 |
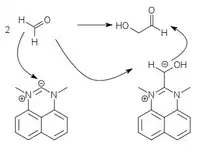 |
| Thiazolium-Katalyse | Triazolium-Katalyse | Perimidinium-Katalyse |
Technische Bedeutung der Formose-Reaktion
Angesichts der begrenzten Erdölreserven und der beinahe unbegrenzten Vorräten an C1-Quellen (Methanhydrat aus der Tiefsee, Kohle, Biogas) wurde seit den 1990er Jahren in der Chemischen Industrie die Forschung auf dem Gebiet der Formose-Reaktion intensiviert, weil dies die einzigen selektiven Aufbaureaktionen auf C1-Basis sind und sie langfristig eine Umstellung der Rohstoffbasis ermöglichen.[9][10]
Weblinks
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, S. 330 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Ronald Breslow: On the Mechanism of the Formose Reaction. In: Tetrahedron Letters, Bd. 1, Nr. 21, 1959, S. 22–26 (doi:10.1016/S0040-4039(01)99487-0).
- Albert Eschenmoser: The search for the chemistry of life's origin. In: Tetrahedron, Bd. 63, 2007, S. 12821–12844 (doi:10.1016/j.tet.2007.10.012).
- Alexander Butlerov: Bildung einer zuckerartigen Substanz durch Synthese. In: Friedrich Wöhler, Justus Liebig, Hermann Kopp (Hrsg.): Justus Liebigs Annalen der Chemie. Band 120, Nr. 3. C. F. Winter'sche Verlagshandlung, Januar 1861, ISSN 1099-0690, S. 295–298, doi:10.1002/jlac.18611200308 (online auf den Seiten der Bayerischen Staatsbibliothek BSB).
- DE4023255 Verfahren zur Herstellung von Glykolen, insbesondere Propylenglykol / EP 0468320 Process for the preparation of glycols from formaldehyde.
- DE000004122669A1 (1991) Verfahren zur Herstellung von Dihydroxyaceton.
- DE000004212264A1 (1992) Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds.
- DE000004230466A1 (1992) Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds.
- DE000019536403A1 (1995) Perimidiniumsalze, ihre Herstellung und Verwendung.
- J. Henrique Teles, Johann-Peter Melder, Klaus Ebel, Regina Schneider, Eugen Gehrer, Wolfgang Harder, Stefan Brode, Dieter Enders, Klaus Breuer, Gerhard Raabe: The Chemistry of Stable Carbenes. Part 2. Benzoin-type condensations of formaldehyde catalyzed by stable carbenes. In: Helvetica Chimica Acta, Bd. 79, Nr. 1, 1996, S. 61–83 (doi:10.1002/hlca.19960790108).
- Gerhard Habermehl, Peter E. Hammann; Hans C. Krebs: Naturstoffchemie. Eine Einführung. 3., überarbeitete und ergänzte Auflage. Springer, Berlin u. a. 2008, ISBN 978-3-540-73732-2, S. 346 (eingeschränkte Vorschau in der Google-Buchsuche).