Trioxan
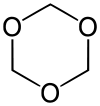
Trioxan ist eine heterocyclische Verbindung aus der Stoffgruppe der Acetale, die durch Trimerisierung von Formaldehyd entsteht. Die IUPAC-Bezeichnung lautet 1,3,5-Trioxacyclohexan oder 1,3,5-Trioxan. Auch die cyclischen Trimere anderer Aldehyde werden als Trioxane bezeichnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trioxan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
leichtentzündlicher, weißer Feststoff mit ethanolähnlichem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,387 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
115 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (221 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−522,5 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung, Eigenschaften und Verwendung
Die Herstellung von Trioxan erfolgt säurekatalytisch durch eine Trimerisierung von Formaldehyd.[6]
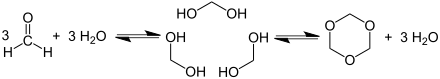
Die Herstellung erfolgt außerdem direkt aus Methanol durch Dehydrierung oder durch Oxidation mit Luftsauerstoff.[6] Die leichtentzündliche Substanz bildet farblose Nadeln, die sich gut in Wasser, Alkohol und Ether lösen. Beim Erhitzen auf 150 bis 200 °C in Gegenwart von Wasser depolymerisiert Trioxan wieder zu monomerem Formaldehyd. Dies stellt vor allem bei unsachgemäßer Lagerung von Trockenbrennstoffen, die Trioxan enthalten, ein Gefahrenpotenzial dar, siehe dazu Esbitkocher. Wegen der katalytischen Wirkung basischer Stoffe sind insbesondere Reinigungsmittel unbedingt getrennt von Trockenbrennstoffen aufzubewahren.
Trioxan wird zur Herstellung von Polyacetal-Kunststoffen verwendet. Auch in Synthesen, die von Formaldehyd ausgehen und diesen in sehr reiner Form benötigen, wird Trioxan eingesetzt.
Sicherheitshinweise / Risikobewertung
Trioxan ist sehr leicht entzündlich. Die Dämpfe sind im Gemisch mit Luft im weiten Konzentrationsbereich von 3,6 bis 29 Volumen-% explosiv.[1] Trioxan reizt Haut, Schleimhäute und Augen und kann beim Einatmen der Dämpfe die Atemwege und das Zentralnervensystem schädigen.
Trioxan wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Trioxan waren die Besorgnisse bezüglich Umweltexposition, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR- oder PBT/vPvB-Substanzen und der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2013 statt und wurde von Polen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht, in dem empfohlen wurde, Trioxan zusätzlich in die Kategorie 2 – Augenreizend einzustufen.[7][2]
Einzelnachweise
- Eintrag zu 1,3,5-Trioxan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. November 2021. (JavaScript erforderlich)
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 1,3,5-trioxane, abgerufen am 26. März 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-58.
- Eintrag zu 1,3,5-trioxane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- Eintrag zu Formaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Februar 2014.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.


