Aldolreaktion
Eine Aldolreaktion ist in der organischen Chemie eine durch Säuren oder Basen katalysierte Reaktion von Aldehyden oder Ketonen. Aldoladdition oder Aldolisation bezeichnet die Addition eines Enolats oder Enolations als Nukleophil an eine Carbonyl-Komponente als Elektrophil. Dabei entsteht ein β-Hydroxyaldehyd oder β-Hydroxyketon. Bei einer Aldolkondensation erfolgt anschließend eine Eliminierung von Wasser und es bildet sich ein α,β-ungesättigtes Carbonyl. Die Aldolspaltung oder Retroaldolreaktion ist die Rückreaktion in die Ausgangsverbindungen.
Der Name Aldehyd-Alkohol-Reaktion leitet sich vom Reaktionsprodukt im Falle einer Reaktion unter Aldehyden, einem β-Hydroxyaldehyd, ab.
Aldolreaktionen sind wichtige Reaktionen für die Bildung von Kohlenstoff-Kohlenstoff-Bindungen und ein grundlegendes Reaktionsprinzip in der organischen Chemie.
Geschichte
Die Aldolreaktion wurde unabhängig voneinander von Charles Adolphe Wurtz und von Alexander Porfyrevich Borodin im Jahre 1872 entdeckt. Borodin hat hier die Dimerisierung von Acetaldehyd zu 3-Hydroxybutanal (andere Namen sind Aldol oder Acetaldol) unter sauren Bedingungen beobachtet.
Übersichtsreaktionen
Aldoladdition und Aldolkondensation
Im Zuge einer Aldoladdition reagiert beispielsweise Acetaldehyd mit einem weiteren Molekül Acetaldehyd zu einem β-Hydroxyaldehyd – hier: 3-Hydroxybutanal, einem Aldol. Im Gegensatz dazu ist das Produkt einer Aldolkondensation derselben Edukt(e) ein α,β-ungesättigter Aldehyd – hier: Crotonaldehyd (trans-2-Butenal). Die Reaktionen können sowohl säuren- als auch basenkatalysiert ablaufen:

Die rot markierten Bindungen symbolisieren die neu geknüpften Kohlenstoff-Kohlenstoff-Bindungen der Aldoladdition und Aldolkondensation
Statt der Acetaldehyde können beliebige Ketone und Aldehyde eine solche Reaktion eingehen, wenn mindestens in einem der Edukte in α-Stellung zur Carbonylgruppe ein H-Atom steht. Das Produkt einer solchen Aldoladdition ist ein β-Hydroxyaldehyd bzw. ein β-Hydroxyketon. Bei der Aldolkondensation entsteht eine α,β-ungesättigte Carbonylverbindung (Aldehyd oder Keton).[1]
Gekreuzte Aldolreaktion
Bei einer gekreuzten bzw. gemischten Aldolreaktion reagieren zwei Carbonylverbindungen mit unterschiedlichen organischen Resten miteinander. Besitzen die Edukte ähnliche Carbonylaktivitäten, so kann ein Gemisch aus vier verschiedenen Aldolen entstehen:
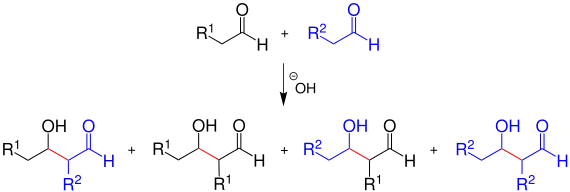
Je nach Art der Reste R1 und R2 liegt – wegen der Bildung von Stereoisomeren – die Anzahl der gebildeten Aldole genau betrachtet noch höher. Die gekreuzte Aldolreaktion verläuft oft unselektiv.
Um unerwünschte Reaktionen zwischen den unterschiedlichen Carbonylverbindungen zu minimieren, müssen starke Basen eingesetzt werden oder entsprechende Edukte ausgewählt werden. Man erhält bisweilen weniger als vier Aldole, wenn die Reaktivität der Carbonylverbindungen unterschiedlich ist. So ist etwa ein Aldehyd elektrophiler als ein Keton und reagiert somit in einer Mischung aus Aldehyd und Keton als Carbonylkomponente, während das Keton als Enol reagiert, da dieses wegen des zusätzlichen +I-Effekts einer Alkylgruppe das Alken stabilisiert.[2] Wenn eine der beiden als Edukt eingesetzten Carbonylverbindungen keine α-ständigen Wasserstoffatome enthält – z. B. Formaldehyd oder Benzaldehyd – verläuft die gekreuzte Aldolreaktion einheitlich. Solche Carbonylverbindungen können keine Enolate bilden und deshalb nicht mit sich selbst reagieren.[3]
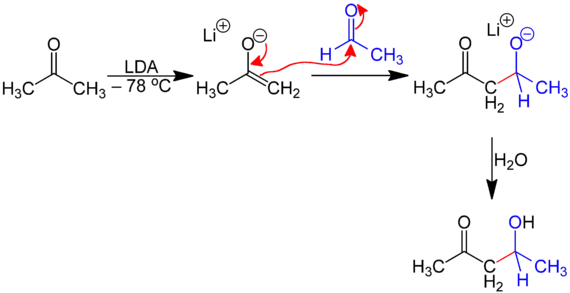
Besonders selektiv verläuft die gekreuzte Aldolreaktion, wenn man das Keton (z. B. Aceton) bei tiefer Temperatur mit Lithiumdiisopropylamid (LDA) ins Lithiumenolat überführt und mit einer zweiten Carbonylverbindung (z. B. Acetaldehyd) umsetzt:[3]
Stereoselektivität
Bei der Aldoladdition kann Stereoselektivität in Form von so genannter einfacher Diastereoselektivität auftreten. Das bedeutet, dass die zwei zuvor sp2-hybridisierten Kohlenstoff-Atome (des Enolats und der Carbonyl-Komponente), die im Produkt eine gemeinsame Bindung aufweisen und jeweils ein Stereozentrum bilden, zueinander dieselbe Relativkonfiguration einnehmen. Dies wird anhand des Zimmerman-Traxler-Modells des Übergangszustands erklärt, in dem eine pseudo-Sesselkonformation angenommen wird.
Anwendung
Die Aldolreaktion ist ein sehr weit verbreitetes Verfahren und hat seine Anwendung sowohl im Labormaßstab als auch in der großtechnischen Produktion.
Die Aldolreaktion hat in der Synthese, besonders von Naturstoffen, große Bedeutung erlangt. In engem Zusammenhang mit der Aldolreaktion stehen Namensreaktionen wie die Claisen-Kondensation, die Henry-Reaktion und die Knoevenagel-Reaktion. Eine asymmetrische Aldolreaktion unter milden Bedingungen ist die Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion.
Biologische Bedeutung
Die Aldolreaktion und ihre Umkehrung sind bei vielen enzymatisch katalysierten biochemischen Reaktionen an der Veränderung des Kohlenstoffgerüstes von Naturstoffen beteiligt. Beispielsweise wird beim aeroben Kohlenhydratabbau am Anfang des Citratzyklus das Citrat aus Oxalessigsäure und Acetyl-CoA in einer Aldoladdition gebildet.
Erfolgt die Biosynthese der Isoprenoide über die Mevalonsäure, dann ist dort die Verknüpfung von Acetyl-CoA und Acetacetyl-CoA zu 3-Hydroxy-3-methylglutaryl-CoA eine Aldolreaktion. Zwei Moleküle Acetyl-CoA reagieren zu Acetacetyl-CoA (Esterkondensation). Dieses wird mit einem dritten Molekül Acetyl-CoA zu 3-Hydroxy-3-methylglutaryl-CoA verknüpft (Aldolreaktion). Anschließend führt die Abspaltung von CoA und gleichzeitige Reduktion der Carboxygruppe zu Mevalonsäure.

Bei der Gluconeogenese reagieren die beiden isomeren Ketotriosen Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat im Sinne einer Aldolreaktion zu Fructose-1,6-bisphosphat.
Die frühere Annahme von Adolf von Baeyer und anderen, dass eine Aldolkondensation ein wichtiger Schritt der pflanzlichen Stärkesynthese ist, ist durch neuere Erkenntnisse überholt.
Literatur
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. 5. durchgesehene Auflage, unveränderter Nachdruck, Vieweg + Teubner, Wiesbaden 2009, ISBN 978-3-8351-0091-6.
- Jürgen Falbe, Manfred Regitz (Hrsg.): Römpp kompakt Basislexikon Chemie. Thieme, Stuttgart u. a. 1998, ISBN 3-13-115711-9.
Weblinks
Einzelnachweise
- Joachim Buddrus: Grundlagen der organischen Chemie. 4. überarbeitete und aktualisierte Auflage, Walter de Gruyter, Berlin/New York 2011, ISBN 978-3-11-024894-4, S. 616 ff.
- Ulrich Lüning: Organische Reaktionen. 2. Auflage, Elsevier, München 2007, ISBN 978-3-8274-1834-0, S. 114.
- Joachim Buddrus: Grundlagen der Organischen Chemie. 4. Auflage, de Gruyter, Berlin/New York 2011, ISBN 978-3-11-024894-4, S. 620–622.