Radikal (Chemie)
Als Radikale bezeichnet man in der Chemie Atome oder Moleküle mit mindestens einem ungepaarten Valenzelektron. Die meisten Radikale sind besonders reaktionsfreudig. Radikale werden mit einem „Punkt“ dargestellt, der das ungepaarte Elektron symbolisiert, zum Beispiel Stickstoffmonoxid (NO•). Eine Verbindung mit zwei ungepaarten Elektronen heißt Diradikal (auch Biradikal), bei drei ungepaarten Elektronen spricht man von einem Triradikal usw. Radikale spielen eine wichtige Rolle bei bestimmten Oxidationsprozessen, bei Kettenpolymerisationen und bei manchen Substitutionsreaktionen.
Nomenklatur
In der Nomenklatur werden Radikale mit der Endung -yl bezeichnet, für Biradikale wird -yliden verwendet. Ausnahmen sind hierbei die Diradikale Methylen, Silylen und Aminylen. Beispiele sind -oxyl für Verbindungen mit radikalischem Sauerstoff (z. B. 2,2,6,6-Tetramethylpiperidinyloxyl) oder Thiyl-Radikale mit radikalischen Schwefelatom.[1]
Entstehung
Radikale bilden sich durch:
- Hitze (thermolytische Bindungsspaltung)
- UV-Strahlung, die die homolytische Spaltung einer kovalenten Bindung bewirkt (Photolyse)
- Röntgen- und andere ionisierende Strahlung
- Elektrochemisch durch Oxidation bzw. Reduktion
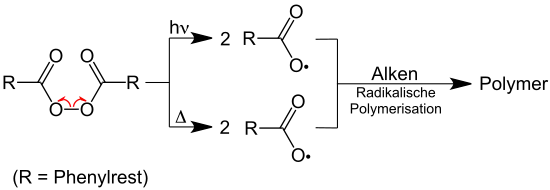
Zur Initiierung radikalischer Reaktionen in der chemischen Synthese werden dem Reaktionsgemisch häufig sogenannte Radikalstarter zugesetzt. Radikalstarter sind Moleküle, die sich besonders leicht – beispielsweise durch Bestrahlung mit ultraviolettem Licht – in Radikale spalten lassen. Beispiele für Radikalstarter sind: Azobis(isobutyronitril), Dibenzoylperoxid, Dilauroylperoxid, Di-tert-butylperoxid, Diisopropylperoxydicarbonat und Kaliumperoxodisulfat.[2]
Reaktivität
Reaktive Radikale
Da die meisten Radikale exergonisch reagieren, sind sie sehr reaktiv und dadurch auch kurzlebig (< 1 Sekunde). Das ungepaarte Elektron befindet sich dabei gewöhnlich an C-, N-, O- und Hg-Atomen oder Halogenen.
Unreaktive Radikale
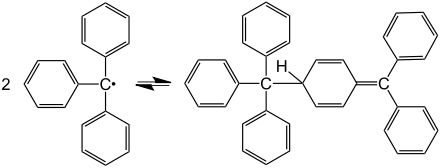
Es sind auch Radikale bekannt, die nicht sofort weiterreagieren und über einen gewissen Zeitraum teilweise sogar als isolierbare Stoffe vorliegen. Ein Beispiel für diese „stabilen Radikale“ ist das Triphenylmethylradikal. Wie andere unreaktive Radikale steht es mit seinem Dimer (das sogenannte Gomberg Dimer) in Lösung im Gleichgewicht. Das Dimer des Triphenylmethyl-Radikals ist das in der Abbildung gezeigte 3-Diphenylmethylen-6-triphenylmethyl-cyclohexa-1,4-dien (und nicht Hexaphenylethan, wie sein Entdecker Moses Gomberg annahm).[3] Faktoren, die zu stabilen Radikalen führen, sind zum einen eine Resonanzstabilisierung des Radikals, zum anderen eine Hinderung der Dimerisierung, beispielsweise durch sterisch anspruchsvolle Substituenten. Auch in der Natur kommen stabile Radikale vor. So beinhaltet zum Beispiel das Enzym Ribonukleotidreduktase (RNR) ein Tyrosylradikal mit einer Halbwertszeit von 4 Tagen.
Kohlenstoff-Radikale
C-zentrierte Radikale zeigen eine zunehmende Stabilität in der Reihe Methylradikal < primäres C-Atom < sekundäres C-Atom < tertiäres C-Atom, was durch induktive Effekte und Hyperkonjugation bedingt ist. Außerdem sind sp³-hybridisierte Kohlenstoff-Radikale stabiler als Radikalzentren, in denen der Kohlenstoff eine sp²- oder sp-Hybridisierung aufweist. Auch Aryl- oder Allylgruppen stabilisieren das Radikal.
Bekannte Beispiele
- Disauerstoff O2 – dieses Sauerstoffmolekül enthält zwei ungepaarte Elektronen (Biradikal •O-O•; die Lewis-Formel O=O gibt die Bindungssituation also nicht vollständig und korrekt wieder) und bildet sich im Magnetfeld als paramagnetisches Triplett ab. Allerdings ist die Reaktionsfähigkeit dieses Biradikals beschränkt, da das Prinzip der Erhaltung des Spins bei chemischen Reaktionen in den meisten Fällen zuerst eine Anregung zu Singulett-Sauerstoff erfordert.
- Stickstoffmonoxid •NO – ein als Botenstoff erkanntes Radikal. Stickstoffmonoxid ist Bestandteil von nitrosen Gasen.
- Hydroxyl-Radikal •OH – das reaktivste und bedeutendste Radikal in der Atmosphäre (wichtig für Abbau von Luftverunreinigungen)
- Chlorradikale Cl• – entstehen durch homolytische Spaltung der Chlor-Chlor-Bindung aus molekularem Chlor (Cl2) und sind reaktive Intermediate bei der Photochlorierung von Alkanen sowie bei der Seitenkettenchlorierung (SSS-Regel) von Alkyl-substituierten Aromaten. Sie werden auch durch Lichteinwirkung aus Fluorchlorkohlenwasserstoffen freigesetzt und können an der Schädigung (Abbau) der Ozonschicht beteiligt sein.
- Bromradikale Br• – entstehen durch homolytische Spaltung der Brom-Brom-Bindung aus molekularem Brom (Br2) und sind reaktive Intermediate bei der Photobromierung von Alkanen sowie bei der Seitenkettenbromierung (SSS-Regel) von Alkyl-substituierten Aromaten
- TEMPO – ein stabiles organisches Radikal, das unter anderem als Oxidationsmittel verwendet wird
Radikalnachweis
Radikale kann man direkt oder indirekt nachweisen:[4]
- Weist ein Molekül ungepaarte Elektronen auf, kann der Spin der Elektronen in einem Magnetfeld zwei unterschiedliche Orientierungen einnehmen. Dies kann durch die Elektronenspinresonanz(ESR)-Spektroskopie aufgezeigt werden.
- Da die meisten Radikale sehr reaktiv sind, kann man sie durch das mit einem Radikalfänger entstehende Produkt charakterisieren:
- Für sehr kurzlebige Radikale können Spin-Trap-Reagenzien wie tert-Bu-N=O eingesetzt werden. Nach der Addition des Radikals bildet sich das persistente Nitroxid, welches mittels ESR-Spektroskopie untersucht werden kann.
- Bei der Dimerisierung von zwei Radikalen entsteht ein stabiles Molekül, das isoliert und charakterisiert werden kann. Beispiel: Zwei Methylradikale (•CH3) dimerisieren zu Ethan (H3C–CH3).
Radikale in der Biologie
Radikale, etwa reaktive Sauerstoffspezies (ROS), spielen bei einer Vielzahl biologischer Prozesse eine wichtige Rolle, können aber auch Zellschäden hervorrufen, die unter anderem zur Entstehung von Krebserkrankungen beitragen können. Auch für die Entstehung der Arteriosklerose, der Alzheimerschen Krankheit, der Leberschädigung durch Alkohol und des Lungenemphysems durch Tabakrauch wird der durch freie Radikale vermittelten Oxidation verschiedener Stoffe eine bedeutsame Rolle zugeschrieben. Unter den intrazellulären Signalwegen, die durch freie Radikale aktiviert werden, ist der NF-κB-Signalweg einer der wichtigsten.
Der Schutz vor der Wirkung der Radikale ist lebensnotwendig; der Körper besitzt deshalb wirksame Abwehr- und Reparaturmechanismen in Form von Enzymen, Hormonen oder anderen Substanzklassen, die die schädliche Wirkung minimieren. An diesen Abwehrmechanismen sind Antioxidantien wie Epigallocatechingallat, Superoxiddismutase, Glutathionperoxidase, Vitamin A, Vitamin C, Vitamin E, Coenzym Q10, Flavonoide wie Taxifolin[5] und Anthocyane beteiligt. Auch Bilirubin und Harnsäure sollen bestimmte freie Radikale neutralisieren können. Das Hormon Melatonin gilt ebenfalls als Radikaleinfänger gegen den oxidativen Stress. Das stärkste bekannte Antioxidans, das Hydridion H−, spielt zum Beispiel im Citratzyklus und bei vielen Redoxreaktionen des Stoffwechsels eine wichtige Rolle.
Radikale spielen im Rahmen der sogenannten „Abnutzungstheorien“ der Alterungsprozesse im Körper eine Rolle, so dass Wirksubstanzen gegen oxidativen Stress als Mittel gegen das Altern im Gespräch sind (→ Theorie der freien Radikale). So ist bekannt, dass Zellen von Vögeln weitaus besser freien Radikalen widerstehen können. Da aber nur der Einfluss synthetischer Antioxidantien untersucht wurde, sollten keine Schlüsse zu möglichen Effekten von Obst und Gemüse gezogen werden. 2007 forderte ein JAMA-Editorial weitere randomisierte Studien, um die Wirkung von Vitamin C und Selen zu etablieren.[6] Eine seither mehrfach aktualisierte, sehr große Metaanalyse der Cochrane Collaboration (2007–2012) konnte abschließend keinerlei positive Effekte vitaminhaltiger Nahrungsergänzungspräparate nachweisen; im Gegenteil stieg die Sterblichkeit in der Verumgruppe sogar leicht an.[7]
Historische Bedeutung
Als sich zu Beginn des 19. Jahrhunderts die Theorie durchsetzte, dass alle Materie aus Atomen aufgebaut ist (siehe John Dalton), wurde von bedeutenden Chemikern wie Lavoisier und Wöhler der Begriff Radikal verwendet, um mehratomige Moleküle zu bezeichnen, die sich in chemischen Reaktionen wie Einzelatome verhielten.[8] Auguste Laurent verwendete den Begriff Radikal erstmals, um Atome und Atomgruppen in der Kerntheorie (Chemie) zu bezeichnen. Zum Beispiel verhält sich das Cyanat-Ion, das aus drei Atomen aufgebaut ist, häufig wie ein Chlorid-Ion. Ebenso verhält sich ein Ammonium-Ion, das aus fünf Atomen besteht, oft wie das Ion eines Alkalimetalls. Deshalb wurden unter anderem Cyanat- und Ammonium-Ionen als Radikale bezeichnet. Siehe auch: Radikaltheorie.
Literatur
- Christoph Rüchardt: Radikale. Eine chemische Theorie in historischer Sicht. In: Sitzungsberichte der Heidelberger Akademie der Wissenschaften, Mathematisch-naturwissenschaftliche Klasse. 1992, S. 319–345 (Volltext).
- Ivo E. Dreosti (Hrsg.): Trace Elements, Micronutrients, and Free Radicals. Humana Press, Totowa (New Jersey) 1991, ISBN 0-89603-188-8.
Weblinks
- Acyclische Kohlenwasserstoffe (ein-, zwei- u. dreiwertige Radikale) (Memento vom 12. Januar 2012 im Internet Archive)
Einzelnachweise
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie. Eine Gebrauchsanweisung. 4. Auflage. Springer, Berlin 1998, ISBN 978-3-540-63221-4, S. 92. (1. Aufl. 1974)
- M. D. Lechner, K. Gehrke, E. H. Nordmeier: Makromolekulare Chemie. 4. Auflage, Birkhäuser Verlag, ISBN 978-3-7643-8890-4, S. 54. 6. Auflage 2020.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 281.
- Ulrich Lüning: Organische Reaktionen – Eine Einführung in der Reaktionswege und Mechanismen. 2. Auflage. Spektrum, München 2007, ISBN 978-3-8274-1834-0, S. 21.
- Yu. A. Vladimirov, E. V. Proskurnina, E. M. Demin, N. S. Matveeva, O. B. Lubitskiy, A. A. Novikov, D. Yu. Izmailov, A. N. Osipov, V. P. Tikhonov, V. E. Kagan: Dihydroquercetin (taxifolin) and other flavonoids as inhibitors of free radical formation at key stages of apoptosis. In: Biochemistry (Moscow). Band 74, Nr. 3, 2009, S. 301–307, doi:10.1134/S0006297909030092, PMID 19364325.
- Goran Bjelakovic, Dimitrinka Nikolova, Lise Lotte Gluud, Rosa G. Simonetti, Christian Gluud: Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention. In: JAMA: The Journal of the American Medical Association. Band 297, Nr. 8, 28. Januar 2007, S. 842–857, doi:10.1001/jama.297.8.842.
- G. Bjelakovic, D. Nikolova, L. L. Gluud, R. G. Simonetti, C. Gluud: Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases. In: Cochrane database of systematic reviews (Online). Band 3, 2012, S. CD007176, doi:10.1002/14651858.CD007176.pub2, PMID 22419320 (Übersichtsartikel).
- John Buckingham: Chasing the molecule. Sutton, Stroud 2004, ISBN 0-7509-3345-3.