Schalenmodell (Atomphysik)
Das Schalenmodell ist ein Atommodell, bei dem die Elektronen den Atomkern in konzentrischen Schalen umgeben. Der Aufenthaltsort eines Elektrons wird durch eine Wahrscheinlichkeitsfunktion modelliert. Die Amplitude dieser Funktion an einem bestimmten Ort ist proportional zur Aufenthaltswahrscheinlichkeit des Elektrons an diesem Ort. Das Schalenmodell ist damit eine Vereinfachung des Orbitalmodells.
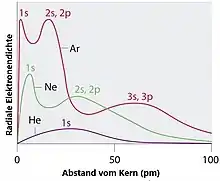
Nach diesem Modell sind die Elektronen in der Atomhülle in Schalen angeordnet, anschaulich etwa wie die Schalen einer Zwiebel. Jede Schale ist der räumliche Aufenthaltsbereich von Elektronen mit ähnlichen Bindungsenergien. Die innerste, dem Atomkern nächstgelegene Schale wird K-Schale genannt. Sie enthält maximal zwei Elektronen. Auf der nächsten Schale, der L-Schale finden maximal acht Elektronen Platz.
In der M-Schale haben 18, in der N-Schale 32 und in der O-Schale 50 Elektronen Platz. Die über je acht hinausgehenden Elektronen in diesen weiter außen liegenden Schalen spielen allerdings bei den Hauptgruppen-Elementen bezüglich der chemischen Eigenschaften so gut wie keine Rolle.
Die Anzahl der Schalen eines Elementes entspricht im Periodensystem der Elemente der Nummer der Periode: Elemente der 1. Periode haben eine Schale, die der 2. Periode zwei Schalen, die der 3. Periode drei Schalen usw.
Eigenschaften der Elemente
Mit dem Schalenmodell der Atome lassen sich verschiedene Eigenschaften der Elemente gut erklären, da jedes Atom seine Edelgaskonfiguration, acht Elektronen in der Außenschale, „anstrebt“. Beispiele:
- Alkalimetalle besitzen nur ein einziges Außenelektron (Valenzelektron) und können dieses daher besonders leicht abgeben; d. h., ihre Ionisierungsenergie ist gering. Daher sind Alkalimetalle besonders reaktiv.
- Den Halogenen fehlt nur ein Elektron für eine voll besetzte Außenschale, daher nehmen sie leicht Elektronen von anderen Elementen auf (z. B. von Natrium) und sind dadurch ebenfalls sehr reaktiv.
- Die Edelgase besitzen bereits eine voll besetzte Außenschale und zeigen daher überhaupt keine „Neigung“, chemische Reaktionen einzugehen.
Namen der Elektronenschalen und maximale Elektronenanzahl
1912 führte Charles Glover Barkla, Professor für Physik am King’s College der University of London, die Bezeichnungen K und L für die am festesten gebundenen Elektronenschalen ein, weil man schon die Bezeichnungen A, B etc. für die Absorptionslinien des Sonnenlichts benutzt hatte. Weil Barkla dachte, dass man noch viele Absorptionslinien finden würde, fing er mit der Bezeichnung der Elektronenschalen etwa in der Mitte des Alphabets an, bei K. Mit dem Bohrschen Atommodell erhielten die Schalen 1913 die Hauptquantenzahlen , und mit den 1916 im Bohr-Sommerfeldschen Atommodell gefundenen weiteren Quantenzahlen und dem Paulischen Ausschließungsprinzip von 1923, sowie der Spin-Quantenzahl konnte man die maximale Besetzungszahl begründen, die u. a. für den Aufbau des chemischen Periodensystems maßgeblich ist.
Schwächen des Atom-Schalenmodells
Es gibt Phänomene, die das atomare Schalenmodell nicht erklären kann. Da es in seiner einfachsten Form den Elektronen räumlich getrennte Kugelschalen zuweist, deren Radius mit der Hauptquantenzahl anwächst, kann es den Elektroneneinfang nicht behandeln, der die Anwesenheit von Elektronen am Ort des Kerns beweist. Des Weiteren bleibt die räumliche Gestalt der Moleküle unerklärt. Warum hat z. B. das Methan (CH4) eine tetraederförmige Gestalt, oder warum ist das Wassermolekül gewinkelt? Diese Eigenschaften der Atome und Moleküle lassen sich mit dem quantenmechanischen Orbitalmodell und seinen Weiterentwicklungen wie VSEPR-Modell sowie über Hybridorbitale und Molekülorbitale erklären.
Siehe auch
Literatur
- W. Finkelnburg: Einführung in die Atomphysik. Springer Verlag, Berlin Heidelberg 1976.
Weblinks
- Atombau – Das Schalenmodell, Erklärung auf Mittelstufenniveau
Einzelnachweise
- LibreTexts: radial density distribution. LibreTexts, abgerufen am 31. Oktober 2020.