Linde-Verfahren
Das Linde-Verfahren ist eine 1895 von Carl von Linde entwickelte technische Methode zur Gastrennung, welche die Verflüssigung von Gasgemischen wie Luft und einzelnen atmosphärischen Gasen wie Sauerstoff, Stickstoff und Argon (Edelgase) in großen Mengen ermöglicht und in diesem Sinne der Kälteerzeugung im Temperaturbereich von 77 bis 100 Kelvin (K) dient.
Geschichte
Obwohl anfangs nur für akademische Zwecke verwendet, kam es bereits 1902 zur ersten echten industriellen Anwendung als wichtiger Teil der ebenfalls von Carl von Linde entwickelten Luftzerlegungsanlage (technische Abkürzung: LZA). Auch heute noch werden Luftzerlegungsanlagen großtechnisch genutzt, um gasförmigen und flüssigen Sauerstoff (GOX und LOX (von liquid oxygen) – als Technik Codes), Stickstoff (GAN und LIN) und Edelgase zu gewinnen. Zur Kälteerzeugung wird das Linde-Verfahren in seinem ursprünglichen Aufbau hingegen nicht mehr verwendet, da inzwischen effizientere technische Umsetzungen (Hubkolbenexpander oder Entspannungsturbinen) entwickelt wurden. Deren Kälteerzeugung basiert nicht länger auf dem reinen Joule-Thomson-Effekt des ursprünglichen Linde-Verfahrens, sondern auf der Erzielung einer möglichst adiabatischen Abkühlung unter Gewinnung von mechanischer Nutzenergie aus dem expandierenden Gas. Beim ursprünglichen Linde-Verfahren dagegen bzw. beim reinen drossel-expansions-isenthalpen Joule-Thomson-Effekt wird diese Energie nicht nur nicht genutzt, sondern sie verbleibt sogar als prozessschädliche Drossel-Reibungswärme im Prozess. Dadurch ist z. B. eine Heliumverflüssigung ohne Vorkühlung mit dem ursprünglichen reinen drossel-expansions-isenthalpen Linde-Verfahren wegen der tiefen Inversionstemperatur des Heliums unmöglich, mit dem verbesserten Verfahren aber sehr wohl, weil die Abführung von mechanischer Nutzenergie bei der Expansion eines Gases unter adiabatischen Bedingungen unabhängig von Gasart und Gastemperatur immer zu einer Abkühlung führt. Die Nutzung des Joule-Thomson-Effekts ist daher immer noch gebräuchlich.
Prinzip
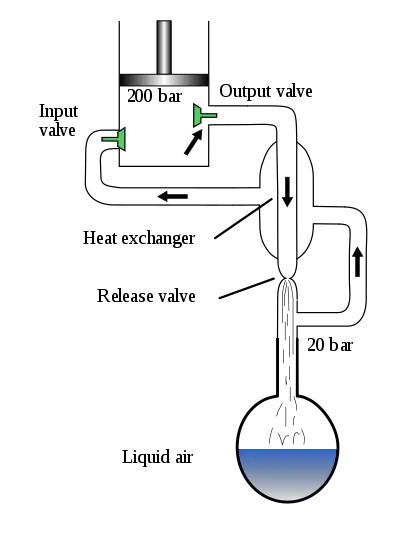
Das isenthalpe Expandieren eines realen Gases in einer Drossel wird von einer Änderung seiner Temperatur begleitet (Joule-Thomson-Effekt). Das abstrakte Modell des idealen Gases zeigt diesen Effekt nicht. Ob die Temperaturänderung in Form von Abkühlung oder Erwärmung auftritt, hängt davon ab, ob die Inversionstemperatur (also die Temperatur, bei welcher der Joule-Thomson-Koeffizient des Gases einen Vorzeichenwechsel erfährt) unterschritten ist. Befindet sich das System über der Inversionstemperatur, so erwärmt sich das Gas bei Expansion (genauer: isenthalper Expansion, die Enthalpie ändert sich durch die Volumenänderung nicht), geringere Temperaturen haben eine Abkühlung zur Folge; dieser Effekt wird im Linde-Verfahren genutzt. (Anm.: eine isenthalpe Expansion tritt dann nach dem 1. Hauptsatz für Thermodynamik in einer Drossel auf, wenn die Änderung der potentiellen und kinetischen Energie des strömenden Fluids von Drosseleintritt zu Drosselaustritt vernachlässigt werden kann und angenommen werden kann, dass die Drossel adiabatisch isoliert ist.)
Um die für viele Gase niedrige Siedetemperatur zu erreichen (für Sauerstoff −183 °C, für Stickstoff −196 °C), benutzt man das entspannte Gas im Gegenstromprinzip zur Vorkühlung des verdichteten Gases.
Anwendung
Das Linde-Verfahren wurde früher zur Abkühlung von atmosphärischen Gasen Sauerstoff, Stickstoff sowie Argon und anderen Edelgasen bis zur Verflüssigung benutzt.
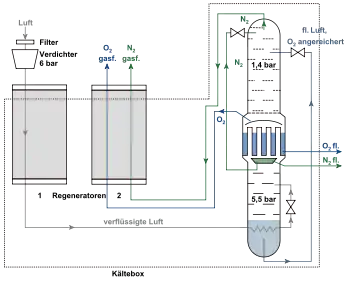
Luftverflüssigung
Ein Kompressor verdichtet die Luft auf einen Druck von ca. 200 bar. Dabei erhöht sich ihre Temperatur um ca. 45 Kelvin, also beispielsweise von +20 °C auf ca. +65 °C. In einem ersten Wärmeübertrager wird die verdichtete, erhitzte Luft dann vorgekühlt und die Temperatur wieder in den Bereich der Umgebungstemperatur zurückgeführt. Dabei wird Wärme aus dem Luftverflüssigungssystem in die Umgebung abgegeben. Die Luft wird zunächst gewaschen und über ein Molekularsieb von Wasserdampf, Staub, Kohlenwasserstoffen, Lachgas und Kohlenstoffdioxid befreit. Kohlenwasserstoffe und Lachgas können zu einer Verpuffung oder sogar einer Explosion in der Rektifikationssäule führen. Anschließend wird die Luft über eine Turbine entspannt, wobei die Temperatur der Luft bis kurz vor den Verflüssigungspunkt absinkt. Anschließend wird die Luft noch über ein Drosselventil geleitet, wobei dort die Luft dann den Verflüssigungspunkt (ca. −170 °C) erreicht.
Dem Ingenieur Fränkl gelang es, die Gegenstromrekuperatoren durch Regeneratoren zu ersetzen. Diese lassen sich weitaus kleiner, preiswerter und leistungsfähiger bauen als Gegenstromrohrbündelwärmeübertrager. Diese Erfindung wurde vom Unternehmen Linde AG übernommen und unter dem Namen Linde-Fränkl-Verfahren vermarktet. Das Verfahren mit Regeneratoren wurde erfolgreich bis ca. 1990 angewandt, bis eine neuere Technologie aufkam, die wieder rekuperative Gegenstrom-Plattenwärmeüberträger mit vorgeschalteter adsorptiver Trocknung und Reinigung beinhaltete.
Flüssige Luft hat eine Dichte von etwa 875 kg/m³ (0,875 g/cm³). In einem offenen Gefäß unter Atmosphärendruck nimmt sie eine Temperatur von −194,25 °C = 78,9 K an. Dabei siedet sie, sodass ihre niedrige Temperatur erhalten bleibt, denn dadurch wird der flüssigen Luft Verdampfungsenthalpie entzogen. Da Sauerstoff und Stickstoff unterschiedliche Siedetemperaturen haben, verdampft der Stickstoff schneller und die Siedetemperatur der verbleibenden Flüssigkeit steigt leicht an, bis 81,7 K. Die Menge der absiedenden Luft regelt sich so ein, dass die durch Wärmeleitung oder Einstrahlung zugeführte Wärme gleich der verbrauchten Verdampfungsenthalpie ist. Je nach Größe und Isolierung des Behälters kann so die flüssige Luft einige Stunden bis viele Tage erhalten bleiben. Flüssige Luft darf jedoch keinesfalls in verschlossenen Behältern ohne Sicherheitseinrichtungen und entsprechender Auslegung aufbewahrt werden, da der durch allmähliche Erwärmung steigende Innendruck diese sonst zum Bersten bringt.
Fraktionieren der verflüssigten Luft


Flüssige Luft kann mittels Fraktionieren in ihre Bestandteile zerlegt werden, indem mithin die unterschiedlichen Siedepunkte der einzelnen Luftbestandteile ausgenutzt werden. Allerdings liegen die Siedepunkte von Sauerstoff und Stickstoff sehr dicht zusammen. Man benutzt daher eine Rektifikationssäule: Die flüssige Luft läuft über mehrere Rektifikationsböden im Gegenstrom zum aufsteigenden Gas nach unten. Sie nimmt Sauerstoff aus dem Gas auf und gibt Stickstoff ab. Die Rektifikation wird bei einem Druck von ca. 5–6 bar durchgeführt. Dadurch wird die Flüssigkeit sauerstoffhaltiger, das Gas stickstoffhaltiger.
Verflüssigung von Wasserstoff und Helium
Um das Linde-Verfahren zur Wasserstoff- und Helium-Verflüssigung anwenden zu können, muss man diese Gase erst unter die Inversionstemperatur vorkühlen. Dies geschieht in der Regel mit flüssiger Luft. Das schließlich erhaltene flüssige Helium siedet unter Atmosphärendruck bei 4,2 K. Dies ist der niedrigste Siedepunkt aller Elemente. Durch Abpumpen des Helium-Gases über dem siedenden Helium wird letzterem Verdampfungsenthalpie entzogen, so dass sich seine Temperatur weiter senken lässt. Da der Dampfdruck mit der Temperatur aber sehr stark abfällt, erreicht man mit diesem Verfahren keine tiefere Temperatur als 0,84 K; zu ihr gehört der Dampfdruck 0,033 mbar.
Physikalische Grundlagen
Das Linde-Verfahren beruht auf dem Joule-Thomson-Effekt: Im idealen Gas üben die Teilchen keine Wechselwirkung aufeinander aus, weshalb die Temperatur des idealen Gases nicht vom Volumen abhängt. Bei realen Gasen hingegen gibt es Wechselwirkungen, die man mit Hilfe der Van-der-Waals-Gleichung beschreibt. Der Energiegehalt des realen Gases ändert sich auch bei adiabatischer (ohne Wärmeaustausch) Entspannung, ohne dass äußere Arbeit verrichtet wurde. Das ist durch die Temperaturänderung nachweisbar.
Verbindet man zwei Gasbehälter mit einer porösen Wand und drückt das im Raum 1 unter Druck stehende Gas mit einem Kolben langsam durch diese Membran, die zur Verhinderung von Wirbeln und Strahlbildung dient, in Raum 2, der unter einem konstanten, aber geringeren Druck als Raum 1 steht, dann stellt sich ein kleiner Temperaturunterschied zwischen den beiden Räumen ein. Er beträgt bei Kohlenstoffdioxid etwa 0,75 K pro bar Druckdifferenz, bei Luft etwa 0,25 K.
Erklärbar ist das, wenn man bedenkt, dass im Raum 1 das Volumen entfernt wurde. Der Kolben hat dem Gas die Arbeit zugeführt. Die Gasmenge taucht im Raum 2 auf und muss die Arbeit gegen den Kolben leisten. Die Differenz der Arbeit ist als innere Energie dem Gas zugutegekommen.
- bzw.
Die Enthalpie bleibt konstant. Beim Van-der-Waals-Gas ist die innere Energie , wobei die Anzahl der Freiheitsgrade eines Teilchens ist.
Damit ergibt sich unter der Berücksichtigung der Van-der-Waals-Gleichung:
Weil die Enthalpie erhalten bleibt, gilt daher für das totale Differential:
Umgeformt nach der Änderung der Temperatur ergibt sich:
Der Zähler ist bei hoher Temperatur positiv. Er wechselt sein Vorzeichen bei der Inversionstemperatur .
Die kritische Temperatur für ein Van-der-Waals-Gas ist also .
Oberhalb von erwärmt sich ein Gas bei Entspannung, unterhalb kühlt es sich ab. Für Kohlenstoffdioxid und Luft liegt deutlich über der Zimmertemperatur, für Wasserstoff dagegen bei −80 °C.
Ein hoher Wert der Van-der-Waals-Konstanten bewirkt daher, dass die Temperatur bei Entspannung des realen Gases stark absinkt. Das ist logisch, denn bei Volumenvergrößerung entfernen sich die Moleküle voneinander und müssen dabei Arbeit gegen die durch charakterisierten Anziehungskräfte verrichten. Diese Arbeit vermindert die kinetische Energie der Moleküle und damit die Temperatur des Gases.
Alternative Verfahren
Zwei neuere Verfahren dienen zur kostengünstigeren Herstellung von Stickstoff und Sauerstoff in bedarfsangepasster Reinheit:
- Membran-Gastrennung (englisch membrane gas separation (MGS)): Diffusion durch Hohlfasermembran kann hochreinen Stickstoff und Sauerstoff mit bis zu 40 % Anreicherungsgrad aus Druckluft liefern.
- Mittels Druckwechsel-Adsorption (englisch pressure swing adsorption (PSA)) an Molekularsieben, CMS – carbon molecular sieve für Stickstoff oder Zeolithe – „Zeo Molekularsieb“ für Sauerstoff lässt sich über Druckwechsel in zwei Druckkesseln Luft zerlegen.[1]
Literatur
- Christian Gerthsen, Hans Otto Kneser, Helmut Vogel: Physik: ein Lehrbuch zum Gebrauch neben Vorlesungen. 14. Auflage. Springer, Berlin / Heidelberg 1982, ISBN 3-540-11369-X, Kapitel 5.6.6 und 5.6.7.
- Georg Veranneman: Technische Gase. Herstellung, Verteilung, Anwendung (= Bibliothek der Technik, Band 10), 4. Auflage, Verlag Moderne Industrie, Landsberg am Lech 2000, ISBN 3-478-93229-7.
Weblinks
- Linde-Videos, welche den Luftzerlegungsprozess visuell darstellen:
- aus der Anlagen-Perspektive: https://www.youtube.com/watch?v=-mUKww4iPgw
- aus der Gase-Perspektive: https://www.youtube.com/watch?v=flvW0vTQ1NM
- Infos zu Heliumverflüssigern von Linde
- SVGs: Trenn-Kolonne, Anlage nach dem Niederdruckverfahren
- Video: JOULE-THOMSON-Effekt und LINDE-Verfahren – Wie erzeugt man flüssige Luft?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15652.
Einzelnachweise
- Stickstoffgenerator – N2 Airtexx Gassysteme & Equipment, abgerufen 27. April 2013