Europium(III)-acetat
Europium(III)-acetat (Eu(CH3COO)3) ist ein Salz aus der Essigsäure und Europium. Es kommt als Anhydrat (Eu(CH3COO)3), Sesquihydrat (Eu(CH3COO)3∙1,5H2O) und als Tetrahydrat Eu(CH3COO)3∙4H2O vor.[1][3] Es ist ebenfalls ein Europium(II)-acetat (Eu(CH3COO)2) bekannt.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
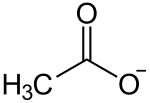 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Europium(III)-acetat | ||||||||||||||||||
| Andere Namen |
Europium(III)-acetat | ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Europium(III)-acetat kann über die Umsetzung von Essigsäure und Europiummetall bei 130 °C in einer evakuierten Kieselglasampulle gewonnen werden.[1]
Dabei oxidiert das Europium und der Wasserstoff wird reduziert.
Eigenschaften
Das Tetrahydrat zersetzt sich an Luft über 6 Schritte zu Europium(III)-oxid.[5][6]
1. Stufe bei 135 °C
2. Stufe bei 170 °C
3. Stufe bei 210 °C
4. Stufe bei 310 °C
5. Stufe bei 390 °C
6. Stufe bei 670 °C
Das wasserfreie Europium(III)-acetat kristallisiert monoklin in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 1126,0(3), b = 2900,5(6), c = 799,1(2) pm und β = 132,03(2)° mit vier Formeleinheiten pro Elementarzelle.[1] Das Sesquihydrat kristallisiert monoklin in der Raumgruppe Cc (Nr. 9) mit den Gitterparametern a = 1608,7(2), b = 1665,6(2), c = 839,1(1) pm und β = 115,75(9)° mit vier Formeleinheiten pro Elementarzelle.[1] Die Wärmekapazität bei 280 K beträgt 803±16 J/(mol∙K).[7]
Einzelnachweise
- S. Gomez Torres, I. Pantenburg, G. Meyer: Direct Oxidation of Europium Metal with Acetic Acid: Anhydrous Europium(III) Acetate, Eu(OAc)3, its Sesqui-hydrate,Eu(OAc)3(H2O)1.5, and the “Hydrogendiacetate”, [Eu(H(OAc)2)3](H2O). In: Z. Anorg. Allg. Chem. Band 632, 2006, S. 1989–1994, doi:10.1002/zaac.200600154.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- H. N. McCoy: The Salts of Europium. In: J. Am. Chem. Soc. Band 61, 1939, S. 2455–2456, doi:10.1021/ja01878a055.
- P. Starynowicz: Synthesis and crystal structure of europium(II) diacetate hemihydrate, Eu(CH3COO)2∙0.5(H2O). In: Journal of Alloys and Compounds. Band 268, 1998, S. 47–49, doi:10.1016/S0925-8388(97)00596-3.
- M. Ogawa, K. Manabe: Thermal Decompostion of Europium(III) Acetate Tetrahydrate. In: Journal of the Ceramic Society of Japan. Band 96, Nr. 9, 1988, S. 890–893, doi:10.2109/jcersj.96.890.
- Balboul, Basma A. A.; Zaki, Mohamed I: Thermal decomposition course of Eu(CH3COO)3·4H2O and the reactivity at the gas/solid interface thus established. In: Journal of Analytical and Applied Pyrolysis. Band 92, Nr. 1, 2011, S. 137–142, doi:10.1016/j.jaap.2011.05.004.
- Dobrokhotova, Zh. V.; Fomina, I. G.; Kiskin, M. A.; Bykov, M. A.; Belov, G. V.; Novotortsev, V. M.: The thermodynamic properties of rare-earth metal binuclear acetates and pivalates. In: Russian Journal of Physical Chemistry. Band 80, Nr. 3, 2006, ISSN 0036-0244, S. 323–329, doi:10.1134/S0036024406030034.