HSAB-Konzept
Das HSAB-Konzept (auch Pearson-Konzept genannt) ist das Akronym für „Hard and Soft Acids and Bases“, also das Konzept der „Harten und Weichen Säuren und Basen“, und zählt zu den Säure-Base-Konzepten.
Der amerikanische Chemiker Ralph G. Pearson veröffentlichte das Konzept 1963.[1] Das HSAB-Konzept wird in vielen Bereichen der Chemie genutzt, um die Stabilität von Verbindungen und deren Reaktivität abzuschätzen.
Es basiert auf dem Lewis-Säure-Base-Konzept, also auf der Reaktivität von Elektronenpaardonatoren (Lewis-Basen) und Elektronenpaarakzeptoren (Lewis-Säuren).
Grundaussagen des Modells und Abschätzung von ‚Härte‘ und ‚Weichheit‘
Die Grundaussage des HSAB-Konzeptes ist: Weiche Säuren reagieren bevorzugt mit weichen Basen und harte Säuren mit harten Basen.
| Hart | Weich |
|---|---|
| Kleine Ionenradien | Große Ionenradien |
| Hohe Ladungen | Geringe Ladungen |
| Geringe Polarisierbarkeit | Große Polarisierbarkeit |
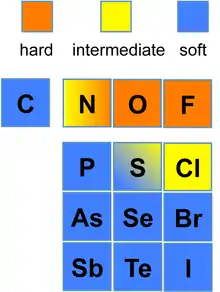
Essenziell ist für das Konzept deswegen die Unterscheidung zwischen harten und weichen Basen sowie zwischen harten und weichen Säuren.
- „Hart“ beschreibt dabei Teilchen (Atome, Ionen und Moleküle), die eine hohe Ladungsdichte aufweisen, also eine hohe Ladung und einen kleinen Radius (großes „Ladungs/Radien-Verhältnis“).
- „Weich“ bezeichnet dagegen Teilchen mit geringer Ladungsdichte, also solche mit geringer Ladung und großem Radius (kleines „Ladungs/Radien-Verhältnis“).
Darüber hinaus sind harte Teilchen kaum polarisierbar (aber stark polarisierend)[2] und weiche Teilchen leicht polarisierbar (aber schwach polarisierend).[3]
Eine Faustregel für Anionen ist die Betrachtung der Stabilität der Halogenide: Das Fluorid-Ion sollte demnach als harte Base mit harten Metall-Ionen stabile Verbindungen bilden, während umgekehrt weiche Säuren das weiche Iodid bevorzugen sollten.
Beispiele
- Eine klassische harte Säure ist das Proton, eine harte Base das Fluorid-Ion. Eine wässrige Lösung von Fluorwasserstoff weist demnach eine geringere Dissoziation als die höheren Halogenwasserstoffe auf.
- Weich sind hingegen das Cadmium(II)-Ion als Säure und das Sulfid-Ion als Base. Cadmiumsulfid sollte also ein eher schlecht in Wasser lösbarer Stoff sein.
Die Bindung zwischen Lewis-Säure und Lewis-Base in Addukten, die von weichen Spezies gebildet wird, hat einen eher kovalenten Charakter, die Bindung zweier harter Spezies ist eher elektrostatisch (ionisch) zu beschreiben.
Anwendung
Das Konzept dient meist mehr der qualitativen als der quantitativen Beschreibung von chemischen Reaktionen. Es wurden aber auch einige erfolgreiche quantitative Modelle etabliert, um die Dissoziationsenergien von Lewis-Säure-Base-Addukten zu bestimmen.
Praktische Anwendung findet das HSAB-Konzept beispielsweise in der qualitativen Analyse (Trennungsgang). Obwohl der klassische Trennungsgang weit älter ist als das HSAB-Konzept, kann seine Funktionsweise großenteils mit dem HSAB-Konzept verstanden werden. Außerdem ist es sehr hilfreich beim Verständnis der Strukturen und Reaktionsweisen von Komplexen. Auch in der Goldschmidt-Klassifikation in der Geologie bestätigen sich die Vorhersagen des Pearson-Konzeptes.
Beispiele
- Das Silber-Kation ist eine weiche Säure; demnach sollte die Stabilität der Silberhalogenide von Fluor nach Iod zunehmen. Tatsächlich bestätigt sich dies: Während Silberfluorid leicht löslich ist, bilden Chlorid, Bromid und Iodid zunehmend stabilere (zunehmend schwerlöslichere) Verbindungen mit hohen kovalenten Bindungsanteilen.
- Nach HSAB sollte Flusssäure HF eine schwache Säure sein, weil die Bindung zwischen H und F starke ionische Anteile hat. In der Tat steigt die Stärke der Halogenwasserstoffsäuren von HF mit pKS von rund +3 bis zum HI mit einem pKS von −10; demnach ist Iodwasserstoffsäure eine 10 Billionen mal stärkere Säure als HF.
Grenzen
Trotz vieler richtiger Vorhersagen kann das HSAB-Konzept versagen, wenn andere Effekte überwiegen:
- Nach HSAB sollten Natrium-Ionen mit Hydroxid oder Fluorid stabile Salze bilden; diese sind aber leicht in Wasser löslich, weil es zur Hydratation durch das Lösemittel kommt.
- Bei der Perchlorsäure sollte sich ähnlich wie bei HF eine niedrige Säurestärke feststellen lassen; die Perchlorsäure ist tatsächlich aber eine der stärksten Säuren, die es gibt. Hier überwiegt die große Stabilität des hochsymmetrischen Perchlorat-Anions.
Selbst für qualitative Aussagen müssen also konkurrierende Effekte in die Überlegungen miteinbezogen werden.
Einteilung einiger Säuren und Basen
Literatur
- Ralph G. Pearson: The HSAB Principle – more quantitative aspects. In: Inorganica Chimica Acta. Vol. 240, No. 1/2, 1995, ISSN 0020-1693, S. 93–98.
- Duward F. Shriver, Peter W. Atkins, Cooper H. Langford: Anorganische Chemie. 2. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-52729250-0.
Einzelnachweise
- R. G. Pearson: Hard and Soft Acids and Bases. In: Journal of the American Chemical Society. Bd. 85, Nr. 22, 1963, S. 3533–3539, doi:10.1021/ja00905a001.
- Eintrag zu hard acid. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02740 – Version: 2.3.2.
- Eintrag zu soft base. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02742 – Version: 2.3.2.