Curium(III)-bromid
Curium(III)-bromid ist ein Bromid des künstlichen Elements und Actinoids Curium mit der Summenformel CmBr3. In diesem Salz tritt Curium in der Oxidationsstufe +3 auf. Da alle Isotope des Curiums nur künstlich hergestellt sind, besitzt es keine natürlichen Vorkommen.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
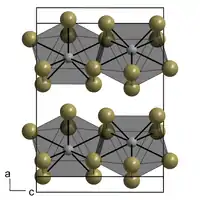 | ||||||||||
| _ Cm3+ _ Br− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
Cmcm (Nr. 63) | |||||||||
| Gitterparameter |
a = 405 pm | |||||||||
| Allgemeines | ||||||||||
| Name | Curium(III)-bromid | |||||||||
| Andere Namen |
Curiumtribromid | |||||||||
| Verhältnisformel | CmBr3 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | je nach Isotop: 479–493 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
6,87 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||

Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Darstellung
Curium(III)-bromid kann durch die Umsetzung von Curium(III)-chlorid mit Ammoniumbromid bei 400–450 °C unter Wasserstoffatmosphäre gewonnen werden.[5]
Eine weitere Möglichkeit besteht in der Reaktion zwischen Curium(III)-oxid und Bromwasserstoffsäure bei 600 °C.[3]
Eigenschaften
Curium(III)-bromid ist eine farblose Ionenverbindung bestehend aus Cm3+- und Br−-Ionen. Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Cmcm (Raumgruppen-Nr. 63) mit den Gitterparametern a = 405 pm, b = 1266 pm und c = 912 pm und vier Formeleinheiten pro Elementarzelle.[5] Seine Kristallstruktur ist isotyp mit Plutonium(III)-bromid.
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
- Gregg J. Lumetta, Major C. Thompson, Robert A. Penneman, P. Gary Eller: Curium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1397–1443 (doi:10.1007/1-4020-3598-5_9).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 149.
- John H. Burns, J. R. Peterson, J. N. Stevenson: Crystallographic Studies of some Transuranic Trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3, in: Journal of Inorganic and Nuclear Chemistry, 1975, 37 (3), S. 743–749 (doi:10.1016/0022-1902(75)80532-X).
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- L. B. Asprey, T. K. Keenan, F. H. Kruse: Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium, in: Inorg. Chem., 1965, 4 (7), S. 985–986 (doi:10.1021/ic50029a013).
Literatur
- Gregg J. Lumetta, Major C. Thompson, Robert A. Penneman, P. Gary Eller: Curium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1397–1443 (doi:10.1007/1-4020-3598-5_9).