Transurane
Die Transurane sind die Elemente mit einer höheren Ordnungszahl als Uran (größer als 92).
Eigenschaften
Alle Transurane sind radioaktiv mit Halbwertszeiten zwischen einigen 10 Millionen Jahren (selten, z. B. Plutonium-244) über Minuten bis zu Bruchteilen einer Sekunde (häufig). Einige Isotope der leichteren Transurane von Neptunium bis Curium haben Halbwertszeiten von einigen Jahrmillionen, Jahrtausenden oder Jahrhunderten. Sie entstehen in Kernreaktoren und machen einen Teil der langlebigen radioaktiven Abfälle aus.
Nach dem Uran mit der Ordnungszahl 92 beginnt die Reihe der Transurane mit dem Neptunium (Element 93). Neben dem für die Kernspaltung bedeutenden Element Plutonium (94) gehören auch Americium (95), Curium (96), Berkelium (97), Californium (98), Einsteinium (99), Fermium (100), Mendelevium (101), Nobelium (102) und Lawrencium (103) sowie alle weiteren schwereren Elemente (Transactinoide) zu den Transuranen.
Die hier namentlich genannten Transurane wurden in der Arbeitsgruppe um Glenn T. Seaborg hergestellt und charakterisiert; Seaborg erhielt dafür 1951 den Nobelpreis für Chemie.
Bis einschließlich des Elements 103, des Lawrenciums, gehören sie zusammen mit Thorium (90), Protactinium (91) und Uran (92) zur Gruppe der Actinoide.
Vorkommen und Gewinnung
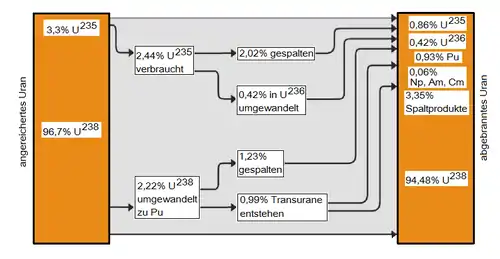
Aufgrund der geologisch gesehenen kurzen Halbwertszeiten kommen Transurane in der Natur nicht oder nur in Spuren vor, die durch Neutroneneinfang und nachfolgenden Beta-Zerfall des Urans entstehen, z. B.:
- Die angegebenen Zeiten sind Halbwertszeiten.
Einzige Ausnahme bildet das Plutonium 244Pu, das noch aus der Entstehungszeit des Sonnensystems stammt.[1]
Transurane lassen sich technisch aus Uran oder anderen Elementen mit hoher Ordnungszahl herstellen. Dazu werden solche Atomkerne mit Neutronen oder anderen Atomkernen beschossen; dabei auftretende Neutroneneinfänge und anschließender Beta-Zerfall ergeben Transurane.
Forschungsgeschichte

Schon in Mendelejews Periodensystem der Elemente von 1871 fand sich hinter Uran, dem damals schwersten bekannten Element, eine Lücke.
Über sechzig Jahre später äußerte sich Ida Noddack im Mai 1934 zu den damals bestehenden Lücken in Mendelejews Periodensystem und stellte am Ende ihrer Arbeit Überlegungen über die Möglichkeit von Transuranen an.[2] Wenige Wochen später veröffentlichte Enrico Fermi drei Arbeiten zu diesem Thema.[3][4][5] Noddack setzte sich im September 1934 kritisch mit der vermeintlichen Entdeckung des Elements 93 durch Fermi auseinander. In ihren Ausführungen nahm sie u. a. die Entdeckung der neutroneninduzierten Kernspaltung vorweg: „Es wäre denkbar, daß bei der Beschießung schwerer Kerne mit Neutronen diese Kerne in mehrere größere Bruchstücke zerfallen, die zwar Isotope bekannter Elemente, aber nicht Nachbarn der bestrahlten Elemente sind.“[6] Ungeachtet Noddacks Einwendungen verfolgten damals alle Arbeitsgruppen die Hypothese, dass bei der Bestrahlung von Uran mit Neutronen stets schwerere Elemente als Uran entstehen.
Am Kaiser-Wilhelm-Institut für Chemie in Berlin machten sich Otto Hahn, Fritz Straßmann und Lise Meitner in dieser Zeit ebenfalls auf die Suche nach Transuranen. In jahrelanger Arbeit versuchten sie, die bei Fermis Versuchen beobachteten Vorgänge aufzuklären. Auf der Suche nach schwereren Elementen fanden sie einige Substanzen, die sie als Nachweise von Transuranen beschrieben.
Unabhängig hiervon widmeten sich von 1937 an auch Irène Joliot-Curie und Paul Savitch in Paris der Suche nach Transuranen. 1937/1938 führte ihre Arbeitsgruppe Versuche durch, bei dem ein dem Lanthan ähnliches Element freigesetzt wurde, dessen chemische Identifizierung sich als außerordentlich schwierig erwies und das sie aufgrund der damaligen Annahmen über chemische Verwandtschaften als einen möglichen Nachweis des Elements 93 deuteten. Sie hielten es für möglich, dass die entdeckte Substanz „die Kernladungszahl 93 hat und es sich bei den von Hahn, Meitner und Straßmann bisher gefundenen Transuranen um die Elemente 94 bis 97 handelt.“[7]
Tatsächlich handelte es sich bei den von Hahn, Straßmann, Meitner, Joliot-Curie und Savitch gemachten Beobachtungen nicht um Nachweise der gesuchten Transurane, sondern um die damals noch unerkannte Kernspaltung des Urans. Zum Wissen über das später Neptunium genannte chemische Element trugen ihre Forschungen daher nur vergleichsweise wenig bei, da sie die zahlreichen bei der Kernspaltung von Uran entstehenden Spaltprodukte für Nachweise der gesuchten Transurane hielten und in ihren Publikationen auch als solche beschrieben.
Ursprünglich war Transuran eine kürzere Bezeichnung für ein künstliches superschweres Element. Das in winzigsten Spuren vorkommende Plutonium-244 aus der Entstehungszeit des Sonnensystems wurde erst 1971, lange nach der Prägung des Begriffes Transuran, entdeckt.[1]
Siehe auch
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Lester R. Morss, Norman M. Edelstein, Jean Fuger: The Chemistry of the Actinide and Transactinide Elements, Dordrecht 2006, ISBN 1-4020-3555-1.
- Glenn T. Seaborg: Transuranium Elements: A Half Century; Literaturinformation; (online, PDF, 6,5 MiB)
- Christian Schnier, Joachim Feuerborn, Bong-Jun Lee: Traces of transuranium elements in terrestrial minerals? (online, PDF, 492 KiB)
- Christian Schnier, Joachim Feuerborn, Bong-Jun Lee: The search for super heavy elements (SHE) in terrestrial minerals using XRF with high energy synchrotron radiation. (Online, PDF-Datei, 446 kB)
Einzelnachweise
- D. C. Hoffman, F. O. Lawrence, J. L. Mewherter, F. M. Rourke: "Detection of Plutonium-244 in Nature", in: Nature 1971, 234, S. 132–134 (doi:10.1038/234132a0).
- Ida Noddack: Das Periodische System der Elemente und seine Lücken, in: Angewandte Chemie, 1934, 47 (20), S. 301–305 (doi:10.1002/ange.19340472002).
- E. Fermi: Radioactivity Induced by Neutron Bombardment, in: Nature, 1934, 133, S. 757–757 (doi:10.1038/133757a0).
- E. Fermi: Element No. 93, in: Nature, 1934, 133, S. 863–864 (doi:10.1038/133863e0).
- E. Fermi: Possible Production of Elements of Atomic Number Higher than 92, in: Nature, 1934, 133, S. 898–899 (doi:10.1038/133898a0).
- Ida Noddack: Über das Element 93, in: Angewandte Chemie, 1934, 47 (37), S. 653–655 (doi:10.1002/ange.19340473707).
- I. Curie, P. Savitch: Sur les radioéléments formés dans l'uranium irradié par les neutrons II. Le Journal de Physique et le Radium 9 (1938) S. 355–359.