Thermolyse
Die Thermolyse ist eine chemische Reaktion, bei der ein Ausgangsstoff durch Erhitzen in mehrere Produkte zersetzt wird. Im Gegensatz zur thermischen Zersetzung (= Pyrolyse) wird die Thermolyse gezielt zur Darstellung definierter Produkte oder reaktiver Zwischenstufen eingesetzt.
Bei der Drehrohr-Pyrolyse finden allerdings sehr komplexe Reaktionen statt, die sich je nach Prozesstemperatur stark unterscheiden. Auch hier kommt es zu Neubildung von Verbindungen, sodass die Drehrohr-Pyrolyse unter 1000 °C eigentlich eine Drehrohr-Thermolyse ist.
Beispiele
- Erhitzt man das Salz Ammoniumchlorid, so zersetzt es sich unter Freisetzung der Gase Ammoniak und Chlorwasserstoff.[1]
- NH4Cl (s) → NH3 (g) + HCl (g)
- Quecksilber(II)-oxid, ein roter, kristalliner Feststoff, zerfällt beim Erhitzen in Quecksilber (Bildung silbriger Tröpfchen) und Sauerstoff.[2]
- 2 HgO (s) → 2 Hg (l) + O2 (g)
- Durch Brennen von Kalk (chemisch Calciumcarbonat) wird das Gas Kohlenstoffdioxid freigesetzt. Zurück bleibt der weiße, bröckelige „gebrannte Kalk“ (chemisch Calciumoxid).[3]
- CaCO3 (s) → CaO (s) + CO2 (g)
- Erhitzt man Dicumylperoxid, so wird die Bindung zwischen den beiden Sauerstoffatomen homolytisch gespalten und es entstehen zwei Phenylalkyloxid-Radikale. Diese dienen industriell als Radikalstarter bei der Polymerisation.
- Diacylperoxide – z. B. Dibenzoylperoxid – werden homolytisch unter Bildung zweier Radikale gespalten.[4]
- Beim Erhitzen von Diazoalkanen entstehen unter Abspaltung von Stickstoff (N2) Carbene.[6]
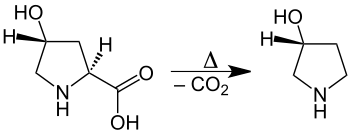
- Thermische Decarboxylierung (Abspaltung von Kohlendioxid) von Aminosäuren unter Bildung von Aminen.[7]
Einzelnachweise
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 72–73.
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 1160.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 570–571.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 413–414.
- Siegfried Hauptmann: Organische Chemie, Verlag Harri Deutsch, 1985, ISBN 3-87144-902-4, S. 537.
- Siegfried Hauptmann: Organische Chemie. Verlag Harri Deutsch, 1985, ISBN 3-87144-902-4, S. 531.
- Sabine Wallbaum, Thomas Mehler, Jürgen Martens: Decarboxylation of α-Amino Acids containing two and three Stereogenic Centers: A Simple One-Step Procedure to Prepare Two Opticall Active β-Amino Alcohols and a Bicyclic Pyrrolidine Derivative. In: Synth. Commun. 24, 1994, S. 1381–1387, doi:10.1080/00397919408011741.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.