Magnesiumfluorid
Magnesiumfluorid ist eine chemische Verbindung aus Magnesium und Fluor. Es gehört zu den Salzen und kommt als weißes Pulver oder als farblose Kristalle vor.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
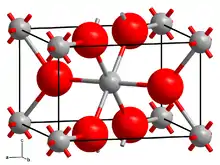 | |||||||||||||||||||
| _ Mg2+ _ F− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Magnesiumfluorid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | MgF2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose geruchlose tetragonale Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 62,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,13 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
2260 °C[3] | ||||||||||||||||||
| Löslichkeit |
schlecht (0,13 g·l−1) in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
1 mg·m−3[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Magnesiumfluorid wurde als Mineral erstmals 1868 von dem italienischen Bergbauingenieur Quintino Sella (1827–1884) beschrieben. Nach ihm trägt es den Namen Sellait. Die natürlichen Vorkommen haben keinerlei wirtschaftliche Bedeutung.
Gewinnung und Darstellung
Im Unterschied zum Magnesiumchlorid ist Magnesiumfluorid schlecht wasserlöslich. Die einfachste und wirtschaftlichste Art der Herstellung des Fluorids ist daher, es aus einer Lösung von Magnesiumchlorid mit Flusssäure auszufällen.
Darüber hinaus kann Magnesiumfluorid auch durch Auflösen von metallischem Magnesium oder Magnesiumcarbonat in Flusssäure oder direkt aus den Elementen Magnesium und Fluor gewonnen werden, wobei letztere Reaktion stark exotherm ist.[6]
Eigenschaften
Magnesiumfluorid bildet farb- und geruchlose unbrennbare Kristalle, die tetragonal in der Rutilstruktur kristallisieren. Die Mohssche Härte beträgt 6. Die Standardbildungsenthalpie beträgt −1124 kJ/mol. Chemisch ist MgF2 sehr stabil und wird nur von heißer Schwefelsäure angegriffen.
Magnesiumfluorid hat einige optische Eigenschaften, die es für technische Anwendungen interessant machen. So ist es in einem außergewöhnlich weiten Wellenlängenbereich transparent. Dieser Bereich reicht von etwa 120 nm (VUV-Strahlung) bis zu etwa 8 µm (Infrarot). Außerdem hat es im sichtbaren Bereich des Spektrums relativ niedrige Brechungsindizes von ca. 1,38. Ferner zeigt MgF2 eine positive Doppelbrechung.
Verwendung
Die optischen Eigenschaften von Magnesiumfluorid machen es zusammen mit seiner chemischen Stabilität zu einem wichtigen Werkstoff für optische Anwendungen. So ist es durch den niedrigen Brechungsindex gut für die Herstellung von Antireflexbeschichtungen geeignet, also um z. B. Brillengläser oder Fotooptiken zu entspiegeln. Wegen der bis weit in den UV-Bereich reichenden Transmission wird MgF2 auch zur Versiegelung von mit Aluminium bedampften Spiegeln verwendet, die in diesem Bereich arbeiten. Als Einkristall findet Magnesiumfluorid Einsatz für optische Fenster, die einen breiten Transparenzbereich benötigen.
Auch außerhalb der optischen Industrie gibt es eine Reihe von Anwendungen, unter anderem als Zusatz für Keramiken und als Katalysator in der chemischen Industrie, in der Metallurgie als Schweissmitteln für Leichtmetalle, als Träger für Katalysatoren und für Erhöhung der Widerstandsfähigkeit und Gasdichtigkeit von Formkörpern aus Aluminiumoxid.[5]
Einzelnachweise
- Eintrag zu MAGNESIUM FLUORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 7. März 2020.
- Eintrag zu Magnesiumfluorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- Datenblatt Magnesiumfluorid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- H. Kojima, S. G. Whiteway, C. R. Masson: Melting points of inorganic fluorides. In: Canadian Journal of Chemistry. 46 (18), 1968, S. 2968–2971, doi:10.1139/v68-494.
- Eintrag zu CAS-Nr. 7783-40-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Oktober 2012. (JavaScript erforderlich)
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 232–233.