Erythropoetin
Erythropoetin [eˌʁyːtʁoˌpoːeˈtiːn] (von altgriechisch ἐρυθρός erythros ‚rot‘, und ποιεῖν poiein ‚machen‘; Synonyme: Erythropoietin, Epoetin, EPO oder Epo, historisch auch Hämatopoetin, erythropoietischer Faktor (der Nieren), Erythropoiesestimulierender Faktor (ESF)) ist ein Glykoprotein-Hormon, das als Wachstumsfaktor für die Bildung roter Blutkörperchen während der Blutbildung, insbesondere nach einem größeren Blutverlust und bei höherem Bedarf an roten Blutkörperchen beim Aufstieg in große Höhen mit vermindertem Sauerstoffpartialdruck, von Bedeutung ist. Erythropoetin zählt damit zu den so genannten „Erythropoiesis Stimulating Agents“ (Kurzform: ESA). Als Therapeutikum wird biotechnologisch hergestelltes Erythropoetin vorwiegend bei der Behandlung der Blutarmut von Dialysepatienten, bei denen die Blutbildung infolge eines Nierenversagens gestört ist, und nach aggressiven Chemotherapiezyklen eingesetzt. Durch zahlreiche Dopingfälle im Profisport erlangte Erythropoetin eine große Bekanntheit.
| Erythropoetin | ||
|---|---|---|
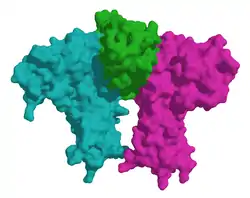
| ||
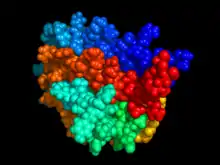
| Oberflächenmodell von Erythropoetin (Mitte) im Komplex mit seinem Rezeptor, nach PDB 1EER | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 165 Aminosäuren; 34 kDa | |
| Sekundär- bis Quartärstruktur | Glykoprotein | |
| Präkursor | PräPro-EPO-Protein | |
| Bezeichner | ||
| Gen-Namen | EPO ; EP; MGC138142 | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B03XA01 B03XA02 | |
| DrugBank | DB00016 | |
| Wirkstoffklasse | Hormon | |
| Vorkommen | ||
| Homologie-Familie | Erythropoetin-2 | |
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2056 | 13856 |
| Ensembl | ENSG00000130427 | ENSMUSG00000029711 |
| UniProt | P01588 | P07321 |
| Refseq (mRNA) | NM_000799 | NM_001312875 |
| Refseq (Protein) | NP_000790 | NP_001299804 |
| Genlocus | Chr 7: 100.72 – 100.72 Mb | Chr 5: 137.48 – 137.49 Mb |
| PubMed-Suche | 2056 | 13856 |
Biosynthese
Bei vermindertem Sauerstoffgehalt des Blutes wird durch Transkriptionsfaktoren die Biosynthese von EPO in Gang gebracht. Diese findet hauptsächlich in den Nieren statt. Das erzeugte Hormon gelangt über den Blutkreislauf an seine Wirkungsorte.
Beim Menschen wird EPO zu rund 90 % in der Niere durch um die Nierenkanälchen liegende Fibroblasten der Nierenrinde produziert. Als Regulator der EPO-Produktion fungiert die Sauerstoffversorgung des Nierengewebes. Rund 10 % werden in den Hepatozyten der Leber gebildet. Zudem konnte eine physiologisch unbedeutende Syntheseaktivität im Gehirn, in der Gebärmutter, im Hoden, in der Milz[1] und auch in Haarfollikel-Zellen nachgewiesen werden.[2]
Das EPO-Gen im Menschen befindet sich auf dem Chromosom 7 (Position 7q21-7q22). Die Synthese wird stimuliert durch eine verminderte Sauerstoffsättigung (Hypoxie) des Blutes. Dies führt zur Verlagerung der α-Untereinheit des „Hypoxie-induzierten Faktors“ (kurz HIF) vom Zytoplasma in den Zellkern EPO-exprimierender Zellen. Dort bindet HIF-α an die zugehörige β-Untereinheit (HIF-β), wodurch das fertige Heterodimer HIF-1 entsteht. Dieses wiederum bindet nachfolgend an das „cAMP response element-binding protein“ (kurz CREB) und einen weiteren Transkriptionsfaktor (p300). Der daraus resultierende, aus nunmehr drei Elementen bestehende Proteinkomplex leitet dann durch Bindung an das 3'-Ende des EPO-Gens die Transkription in die zugehörige mRNA ein. Diese wird an den Ribosomen in das Protein Erythropoetin translatiert.
Biologische Funktion
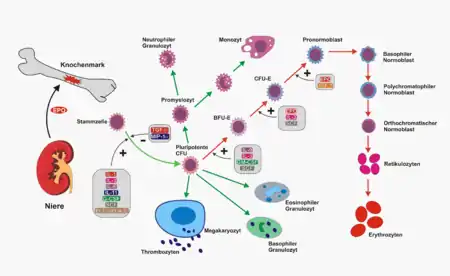
rote Pfeile: Erythropoese;
TGF = Transforming Growth Factor;
MIP = Macrophage Inflammatory Protein;
IL = Interleukin;
G-CSF = Granulocyte-Colony Stimulating Factor;
SCF = Stem Cell Factor;
IGF = Insulin-like Growth Factor;
FLT-3/FLK-2 = Rezeptor-Tyrosinkinase;
BFU-E = Erythroid Burst Forming Unit;
CFU-E = Erythroid Colony Forming Unit
Erythropoetin wirkt überall dort im Körper, wo der so genannte EPO-Rezeptor auf der Oberfläche der Zellen gebildet wird. Das sind insbesondere die Stammzellen im Knochenmark und daneben auch in anderen Geweben, aus denen kontinuierlich neue Blutzellen hervorgehen. EPO bewirkt insbesondere, dass aus diesen Stammzellen Erythrozyten (rote Blutkörperchen) entstehen.
Bildung von Erythrozyten
Über die Bildung und Entwicklung roter Blutkörperchen siehe auch den Hauptartikel Erythropoese.
Die Serumkonzentration des Hormons im gesunden Menschen liegt zwischen 6 und 32 mU/mL und die Plasmahalbwertszeit zwischen 2 und 13 Stunden.[3] Bei der Erythropoese bindet EPO im Knochenmark an den transmembranen Erythropoetin-Rezeptor der Vorläuferzellen des Typs BFU-E (Erythroid Burst Forming Unit), die zunächst zu den reiferen Vorläuferzellen des Typs CFU-E (Erythroid Colony Forming Unit) und schließlich zu Erythrozyten ausdifferenzieren.
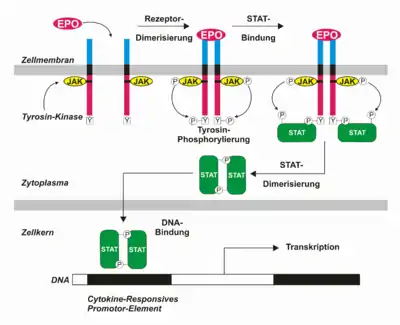
Der Rezeptor (EpoR) gehört zur Familie der Zytokin-Rezeptoren, deren strukturelle Gemeinsamkeiten in zwei oder mehr immunglobulin-ähnlichen Domänen, vier gleich angeordneten Cystein-Resten und der extrazellulären Sequenz WSXWS (Trp-Ser-variable Aminosäure-Trp-Ser) bestehen. Die Bindung von EPO führt zu einer Homodimerisierung des Rezeptors, welche wiederum via Transphosphorylierung das rezeptorgekoppelte Enzym Januskinase-2 aktiviert. Dabei werden spezifische, intrazellulär rezeptorassoziierte Tyrosin-Reste phosphoryliert und dienen hierdurch als Kopplungsstation für das Signaltransduktionsprotein STAT5, wodurch verschiedene Signaltransduktionskaskaden in Gang gesetzt werden. Insgesamt sind daran 94 Proteine beteiligt.
Pro Tag werden circa 200 Milliarden Erythrozyten gebildet. Zusätzlich zur eigentlichen Erythropoese wirkt EPO bei der Differenzierung der Vorläuferzellen als Apoptosehemmer und stimuliert in geringem Maße auch die Bildung von Megakaryozyten. Akute und chronische Insuffizienzen infolge degenerativer Erkrankungen der Niere führen zu verminderten EPO-Bildung und damit zur renalen Anämie.
Weitere Funktionen
Die Aufgabe von EPO im Organismus ist nicht allein auf die Bildung neuer Erythrozyten beschränkt. Immunzytochemische Hybridisierungsuntersuchungen haben gezeigt, dass EpoR in den unterschiedlichsten somatischen Zellen zu finden ist. Dazu gehören Neurone, Astrozyten, Mikroglia- und Herzmuskelzellen. EPO/EpoR-Interaktionen wurden in den verschiedensten nicht blutbildenden Geweben in Zusammenhang mit Zellteilungsvorgängen, Chemotaxis, Angiogenese, Aktivierung intrazellulären Calciums und Apoptosehemmung nachgewiesen. Spezifische EPO-Bindungsstellen wurden in Nervenzellen nachgewiesen, insbesondere auch im Hippocampus, einer Hirnregion, die besonders anfällig für eine durch Sauerstoffmangel verursachte Schädigung ist. Im Mausmodell wurde nachgewiesen, dass durch die gezielte Gabe von EPO die Nerventätigkeit im Hippocampus gesteigert wird und so verbesserte Lern- und Erinnerungsleistungen bei den Tieren zu beobachten sind, und dies unabhängig von den blutbildenden Eigenschaften des Hormons.[4] In mehreren Tiermodellen des Hirninfarkts und des Sauerstoffmangels konnte ein schützender Effekt von EPO nachgewiesen werden. Diese Erkenntnisse könnten neue Therapieansätze für chronische Krankheiten (Multiple Sklerose, Schizophrenie) sowie akuten neurologischen Erkrankungen (Schlaganfall) bieten (siehe hierzu Indikationen für die Therapie mit EPO).
Im Mausmodell konnte nachgewiesen werden, dass die zytoprotektive Eigenschaft von EPO bei Herzmuskelzellen auf der Wirkung des Enzyms Hämoxygenase-1 beruht, dessen durch EPO vermittelte Expression über die p38 MAPK-Signaltransduktionskaskade in Gang gesetzt wird.[5]
Strukturelle Eigenschaften
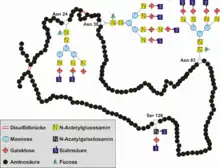
Asn24: N-glykosyliert, tri-antennär, di-sialyliert.
Asn38: N-glykosyliert, tetra-antennär, tetra-sialyliert.
Asn83: N-glykosyliert, tetra-antennär, tri-sialyliert.
Ser126: O-glykosyliert, mono-antennär, di-sialyliert.
EPO gehört phylogenetisch zu einer Zytokinfamilie, die neben EPO auch Somatropin, Prolaktin, die Interleukine 2–7 sowie die so genannten „Colony Stimulating Factors“ (G-CSF, M-CSF und GM-CSF) umfasst.
Aminosäuresequenz von EPO (Einbuchstabencode)[6]
- grün: N-terminales Signalpeptid
- rot: C-terminaler Argininrest
| 10 20 30 40 50 60
MGVHECPAWL WLLLSLLSLP LGLPVLGAPP RLICDSRVLE RYLLEAKEAE NITTGCAEHC |
| 70 80 90 100 110 120
SLNENITVPD TKVNFYAWKR MEVGQQAVEV WQGLALLSEA VLRGQALLVN SSQPWEPLQL |
| 130 140 150 160 170 180
HVDKAVSGLR SLTTLLRALG AQKEAISPPD AASAAPLRTI TADTFRKLFR VYSNFLRGKL |
| 190 KLYTGEACRT GDR |
Das EPO-Gen (5,4 kb, 5 Exons und 4 Introns) codiert ein PräPro-EPO-Protein mit 193 Aminosäureresten. Bei der posttranslationalen Modifikation wird N-terminal ein Signalpeptid mit 27 Aminosäureresten sowie C-terminal ein Argininrest durch eine intrazelluläre Carboxypeptidase abgespalten.
Chemisch ist humanes EPO ein saures, unverzweigtes Polypeptid aus 165 Aminosäuren mit einer Molekülmasse von etwa 34 kDa. Die Sekundärstruktur besteht aus vier antiparallelen α-Helices inklusiver benachbarter Schleifen. Der Kohlenhydratanteil, der etwa 40 % der Molekülmasse beträgt, besteht aus einer O-glykosidisch (Ser 126) und drei N-glykosidisch (Asn 24, Asn 38 und Asn 83) gebundenen Zuckerseitenketten. Die Seitenketten ihrerseits setzen sich aus den Monosacchariden Mannose, Galactose, Fucose, N-Acetylglucosamin, N-Acetylgalactosamin und N-Acetylneuraminsäure zusammen. Die N-glykosidisch gebundenen Seitenketten besitzen mehrere Verzweigungen, die man auch als “Antennen” bezeichnet. Im Gegensatz zur konstanten Aminosäuresequenz des EPO-Moleküls sind die Zuckerstrukturen variabel. Man spricht in diesem Zusammenhang von der Mikroheterogenität des EPO-Moleküls, die sowohl im natürlichen (nativen) als auch im rekombinanten EPO auftritt. Diese ist einerseits gekennzeichnet durch variable Abfolgen der Monosaccharide in den Zuckerseitenketten, anderseits durch die variable Anzahl der endständigen N-Acetylneuraminsäuren. Diese, auch unter dem Trivialnamen Sialinsäuren bekannt, sind entscheidend für die biologische Aktivität des Glykoproteins: Je höher der Sialylierungsgrad, desto höher sind die Aktivität und die Serumhalbwertszeit des Hormons. Bemerkenswert ist, dass hoch-sialylierte Isoformen in In-vitro-Experimenten eine geringere Affinität zum EPO-Rezeptor zeigen. Dies erklärt wiederum, weshalb die asialylierten Isoformen, bei denen die endständigen Sialinsäuren entfernt sind, auf Grund der hohen Rezeptoraffinität unmittelbar in der Leber durch die parenchymalen Zellen (Hepatozyten), die den EPO-Rezeptor tragen, abgereichert werden und somit wirkungslos sind. Funktionale Isoformen werden dagegen nach und nach auch durch andere Körperzellen, die den EPO-Rezeptor tragen, abgebaut. Beim Abbau werden die EPO-Moleküle durch eine rezeptorvermittelte Endocytose in Lysosomen internalisiert und dort zerlegt. In weiterführenden Untersuchungen mit EPO-ähnlichen Molekülen ohne Rezeptoraffinität konnte gezeigt werden, dass die über den EPO-Rezeptor vermittelte Endocytose nur zum Teil zur Abreicherung von EPO aus dem Blutkreislauf beiträgt. Vielmehr scheinen Abbauwege über das Stroma-Gewebe und das Lymphgefäßsystem ausschlaggebend zu sein. Offenbar sind auch Makrophagen und neutrophile Granulozyten daran beteiligt.[7]
Die Zuckerseitenketten beeinflussen auch die Stabilität des EPO-Moleküls und üben dabei eine Schutzfunktion aus. Deglykosyliertes EPO, das keine Zuckerseitenketten besitzt, ist deutlich empfindlicher gegenüber pH- und temperaturinduzierten Denaturierungen als natürliches, glycosyliertes EPO.[8]
Eine optionale Besonderheit des EPO-Moleküls ist die Sulfatierung N-glykosidischer Zuckerseitenketten. Die genaue Funktion der Sulfatierung, die sowohl im nativen als auch im rekombinanten Molekül nachweisbar ist, ist bisher unbekannt.
Die zytoprotektiven Eigenschaften von EPO (siehe Kapitel Biologische Funktion) werden offenbar bestimmt durch Peptidsequenzen der α-Helix B im EPO-Molekül. Dies haben In-vitro- und In-vivo-Untersuchungen mit synthetischen sequenzhomologen Peptiden gezeigt. Demgegenüber haben besagte Sequenzen keine erythropoetische Eigenschaften.[9]
EPO als Arzneimittel
Forschungsgeschichte
Die Forschungsgeschichte des Erythropoetins ist naturgemäß eng verknüpft mit dem Erkenntnisgewinn über Entstehung und Funktion des Blutes. Schon seit der Frühgeschichte ist die Bedeutung des Blutes für die Vitalität des Menschen bekannt. In vielen Kulturen steht Blut im Zentrum ritueller Zeremonien. Häufig wurde das Blut eines starken Tieres oder eines getöteten Feindes verabreicht, um dessen Kraft und Mut auf den Empfänger zu übertragen.
Die erste erfolgreiche Bluttransfusion zur Behandlung einer Anämie nahmen Jean-Baptiste Denis, Leibarzt von Ludwig XIV. und der Chirurg Paul Emmerez († 1690) am 15. Juni 1667 in Paris vor. Sie führten dem Patienten, dessen Zustand sich nach der Transfusion deutlich besserte, das Blut eines Lammes zu. Der englische Gynäkologe und Geburtshelfer James Blundell (1791–1878) führte 1825 die erste erfolgreiche homologe Transfusion am Menschen durch, bei der eine Patientin mit starken Blutungen das Blut ihres Ehemanns erhielt. Der genaue Hintergrund für die Wirkung ihrer Therapien blieb den behandelnden Ärzten jedoch verborgen. Erst zur Mitte des 19. Jahrhunderts lieferten Felix Hoppe-Seyler mit der Entdeckung des Hämoglobin und Ernst Neumann durch seine Arbeiten über das Knochenmark als Ort der Blutbildung erste Erkenntnisse über die Entstehung und die Funktion des Blutes.
1863 erkannte der französische Arzt Denis Jourdanet indirekt den Zusammenhang zwischen erniedrigtem Sauerstoffpartialdruck und Erhöhung der Erythrozytenzahl, als er hämatokritische Untersuchungen an Personen durchführte, die sich längere Zeit in alpinen Höhenlagen aufgehalten hatten. Jourdanet stellte fest, dass das Blut seiner Probanden dickflüssiger war als dasjenige seiner “normalen” Patienten. Den direkten Zusammenhang stellte Friedrich Miescher 1893 her. Miescher beschrieb die Bildung der Erythrozyten als Ergebnis einer verminderten Sauerstoffversorgung des Knochenmarks. Auf dieser Grundlage gab es Bestrebungen, Anämien mittels gezielt induzierten Hypoxien zu therapieren.
Im Jahr 1906 stellten der Franzose Paul Carnot (1869–1957) und seine Mitarbeiterin Catherine Deflandre erstmals die Hypothese auf, dass ein humoraler Faktor die Blutbildung regele. Ihre Hypothese gründete auf Experimenten, bei denen das Blutserum von Kaninchen, die zuvor durch Aderlass anämisch gemacht wurden, nach Injektion in gesunde Kaninchen bei diesen die Anzahl roter Blutkörperchen deutlich erhöht. Zahlreiche Versuche anderer Forscher, die Ergebnisse von Carnot und Deflandre zu reproduzieren, schlugen fehl. Erst durch die Verwendung von Phenylhydrazin, einer hämolytischen Chemikalie zur Induktion einer Anämie, konnten auch andere Forscher, wie zum Beispiel 1911 Camillo Gibelli von der Universität Genua, in der Versuchsanordnung von Carnot und Deflandre deren Hypothese aufrechterhalten. Weitere Hinweise für die Richtigkeit der Hypothese eines humoralen Faktors lieferten Experimente, bei denen die Blutbildung in normalen Tieren durch Serum von Tieren verstärkt werden konnte, die unter hypoxischen Bedingungen gehalten wurden. Hier konnte insbesondere Georges Sandor (1906–1997) vom Institut Pasteur in den 1930er Jahren bedeutende Erfolge erzielen. Die beiden finnischen Nephrologen Eva Bonsdorff (* 1918) und Eeva Jalavisto (1909–1966) gaben schließlich 1948 diesem Faktor den Namen Erythropoetin, kurz EPO.
Als eigentlicher „Entdecker“ gilt gemeinhin Allan Jacob Erslev, der 1953 die ersten fundierten wissenschaftlichen Publikationen veröffentlichte, in denen die Existenz von Erythropoetin zweifelsfrei bewiesen wurde. Zur Schlüsselfigur der weiteren EPO-Forschung wurde jedoch Eugene Goldwasser. 1954 bestätigten er und seine Arbeitsgruppe von der University of Chicago die Arbeiten Erslevs durch eigene Ergebnisse. Goldwasser und sein Mitarbeiter Leon Orris Jacobson konnten zunächst 1957 indirekt nachweisen, dass EPO in der Niere gebildet wird, und 1977 dann erstmals humanes EPO im Milligramm-Maßstab aus dem Urin isolieren. 1983 gelang Fu-Kuen Lin, einem Mitarbeiter bei Amgen, die Identifizierung des humanen EPO-Gens.[10] 1984 berichtete Sylvia Lee-Huang vom New York University Medical Center erstmals von einer erfolgreichen Klonierung und Expression von rekombinantem humanem EPO (rhEPO) in Escherichia coli,[11] die 1985 dann auch in Säugetierzellen gelang.[12] Hierdurch wurde die großtechnische Produktion von rekombinantem EPO in geeigneten Mengen möglich.
Indikationen für die Therapie mit EPO
Von den gegenwärtig klinisch eingesetzten Wachstumsfaktoren besitzt EPO das größte Indikationsspektrum. Die klassische EPO-Therapie zielt darauf ab, die Bildung roter Blutkörperchen bei Patienten mit renaler Anämie, Tumoranämie und Anämien als Folge von Chemotherapien in Gang zu setzen oder zu unterstützen. Zudem gilt mittlerweile als gesichert, dass die Ansprechrate von hypoxischen Tumoren auf eine Radio- oder Chemotherapie durch die Zunahme der Tumoroxygenierung nach EPO-Applikation gesteigert werden kann.
Hämatologische Erkrankungen
Bei der renalen Anämie wird den Patienten EPO meist begleitend zur Hämodialyse verabreicht. Eine US-amerikanische Kurzzeitstudie ergab Hinweise darauf, dass es populationstypisch unterschiedliche Erfordernisse bei der Anwendung von EPO gibt. Dialysepatienten schwarzafrikanischer Abstammung benötigten in dieser Studie im Durchschnitt 12 % höhere EPO-Dosen als Weiße zur Anhebung des Hämoglobinspiegels in einen physiologischen Bereich.[13]
In einer weiteren, retrospektiven Studie wurde festgestellt, dass die Überlebensrate bei Dialysepatienten mit Niereninsuffizienz im Endstadium nach Verabreichung von EPO steigt, wenn diese Patienten in alpinen Höhenlagen leben.[14] Vielfach kann die EPO-Therapie durch die gleichzeitige Verabreichung von Eisenpräparaten zur Blutbildung unterstützt werden.[15] Der molekulare Pathomechanismus einer Tumoranämie, der sich durch die Zugabe von EPO beheben lässt, beruht auf einer gestörten Eisenverwertung. Da diese Mechanismen auch bei chronischen Infektionen (etwa Morbus Crohn, Colitis ulcerosa) oder Sepsis nachweisbar sind, wird der Einsatz von EPO als therapieunterstützende Maßnahme seit einigen Jahren in klinischen Studien untersucht. Ferner werden EPO-Therapieformen bei der Fatigue, beim Myelodysplastischen Syndrom, bei der Aplastischen Anämie, Osteomyelofibrose und HIV-Infektionen diskutiert.
Bei der so genannten infantilen Pyknozytose, eine Sonderform der hereditären Poikilozytose, handelt es sich um eine seltene Erkrankung bei Neugeborenen, die gekennzeichnet ist durch deformierte Erythrozyten und begleitet wird von schwergradigen Anämien. Bisher waren zur Behandlung dieser Krankheit häufige Erythrozytentransfusionen erforderlich. Eine italienische Forschergruppe berichtete im September 2008 erstmals von erfolgreichen Therapiefällen mit EPO, bei denen nachfolgend auf Erythrozytentransfusionen gänzlich verzichtet werden konnte.[16]
Experimentelle Behandlungsansätze bei neurologischen Erkrankungen
Seine zytoprotektiven Eigenschaften in Zellkultur- und Tiermodellen machen EPO zudem zu einem interessanten Kandidaten für die Behandlung von akuten neurologischen Erkrankungen wie beispielsweise dem Schlaganfall. Während sich in Tiermodellen des Schlaganfalls sowie einer ersten Pilotstudie am Menschen vielversprechend waren, blieben die Ergebnisse einer großen randomisierten klinischen Studie zur Behandlung von Schlaganfallpatienten jedoch ernüchternd.[17]
Basierend auf experimentellen Arbeiten und kleinen klinischen Studien ist auch eine Rolle für die Behandlung chronischer Erkrankungen des zentralen Nervensystems postuliert worden. So wurde basierend auf einer an acht Patienten durchgeführten Studie spekuliert, ob hochdosiertes EPO möglicherweise bei der Behandlung von chronisch fortschreitender Multipler Sklerose therapeutisch sein könnte.[18] In einer an 12 Patienten mit Friedreich-Ataxie durchgeführten Studie wurde nach EPO-Gabe eine Reduktion der lymphozytären Frataxinkonzentrationen beobachtet.[19] Im Mausmodell zeigte EPO eine verzögernde Wirkung bei der Entstehung der Amyotrophen Lateralsklerose (ALS).[20] Im Rattenmodell befördert EPO offenbar das axonale Wachstum durchtrennter Nervenfasern.[21]
Experimentelle Behandlungsansätze bei psychiatrischen Erkrankungen
Laut einer 2006 veröffentlichten Pilotstudie könnte EPO als Zusatztherapeutikum bei der Behandlung von schizophrenen Patienten möglicherweise eine leichte Verbesserung der kognitiven Fähigkeiten bewirken.[22] Die Autoren nehmen an, dass der beobachtete Effekt auf den protektiven Eigenschaften von EPO gegenüber neurodegenerativen Mechanismen beruhen könnte, die Ergebnisse sind jedoch bisher nicht durch weitere Forschungsgruppen bestätigt worden. In einer weiteren, neuropsychologischen Einzelstudie wurden stimmungsaufhellende Effekte bei gleichzeitiger Verbesserung kognitiver Fähigkeiten durch Verabreichung von EPO bei Patienten mit Angstzuständen und Depression beobachtet.[23]
Weitere experimentelle Behandlungsansätze
Die zytoprotektiven Eigenschaften von EPO sind nicht allein auf neuronales Gewebe beschränkt. Auch Herzmuskelzellen sind nach einer Behandlung mit EPO deutlich unempfindlicher gegenüber ansonsten letalen Stressfaktoren, wie sie z. B. bei einem Herzinfarkt durch eine mangelhafte Sauerstoffversorgung (Hypoxie) auftreten. Somit könnte EPO bei entsprechenden Risikopatienten vorbeugend verabreicht werden.[24] Doch auch noch nach Auftreten eines ischämischen Infarktes kann die Anwendung von EPO hilfreich sein, da die Herzmuskelzellen bei der Reperfusion des Organs vor der sonst üblichen weiteren Schädigung bewahrt werden.[25] In einer Studie in der Schweiz konnte belegt werden, dass dieser protektive Effekt auf der durch EPO vermittelten Produktion von Stickstoffmonoxid in den koronaren Endothelzellen beruht.[26] Die durch Stickstoffmonoxid verursachte Gefäßerweiterung führt offenbar zu einer höheren Durchblutung und damit zu einer verbesserten Sauerstoffversorgung des Gewebes. In einer ersten Studie mit 138 Patienten zur Behandlung des Herzinfarkts mit EPO konnte jedoch kein Vorteil durch Verabreichung des Zytokins beobachtet werden.[27] Gleiches gilt für die Behandlung einer Herzinsuffizienz, die von einer Anämie begleitet wird.[28]
Im Mausmodell konnte nachgewiesen werden, dass EPO auf Wundheilungsprozesse einen positiven Einfluss hat: Eine hohe Einzeldosis des Zytokins EPO beschleunigt unter anderem die Epithelisation und die Differenzierung des mikrovaskulären Blutgefäßsystems.[29] Zurzeit wird die Übertragbarkeit der Ergebnisse auf den Menschen im Rahmen einer Multicenterstudie untersucht.[30]
In einer Langzeitstudie am Kinderkrankenhaus auf der Bult, Hannover, konnte gezeigt werden, dass EPO bei extrem früh Geborenen vor Hirnblutungen schützen kann.[31]
Das Max-Planck-Institut für experimentelle Medizin in Göttingen plante im Jahr 2020 eine randomerisierte Studie zum Einsatz von EPO zur Symptomverbesserung im Krankheitsverlauf von COVID-19.[32]
Bezeichnung und Eigenschaften von EPO-Präparaten
Die Weltgesundheitsorganisation WHO hat 1989 für rekombinante EPO-Varianten eine INN-Nomenklatur eingeführt. Danach werden alle Substanzen mit dem gleichen Wirkmechanismus wie Erythropoetin mit dem Wortstamm „-poetin“ versehen. Bei „Epoetin“ handelt es sich um einen Wirkstoff, der die gleiche Aminosäuresequenz inklusive Disulfidbrücken und Glykosylierungsstellen aufweist, wie natürliches humanes Erythropoetin. Alle rekombinanten EPO-Varianten unterscheiden sich jedoch vom nativen, endogenen Molekül in der Zusammensetzung der Zuckerstrukturen (Glykosylierungsmuster). Zudem gibt es auch Unterschiede zwischen den rekombinanten Varianten. Zur Unterscheidung der Varianten wird daher der Bezeichnung „Epoetin“ ein griechischer Buchstabe angehängt. Folgende EPO-Varianten sind gegenwärtig gemäß INN-Nomenklatur bei der WHO gelistet: Epoetin alpha (Epoetin α), Epoetin beta (Epoetin β), Epoetin gamma (Epoetin γ), Epoetin delta (Epoetin δ), Epoetin epsilon (Epoetin ε), Epoetin zeta (Epoetin ζ), Epoetin theta (Epoetin θ), Epoetin kappa (Epoetin κ) und Epoetin omega (Epoetin ω).[33]
Das rekombinante Expressionsvehikel für die Produktion der Varianten Epoetin α und β ist jeweils ein genetisch modifizierter Subclon einer Ovarialzelllinie des Chinesischen Streifenhamsters (Cricetulus griseus), eine so genannte CHO-Zelllinie (Chinese Hamster Ovary). Bei der Produktion der Variante Epoetin ω wird eine genetisch modifizierte und subklonierte Zelllinie aus der Niere eines Jungtieres des Syrischen Goldhamsters (Mesocricetus auratus auratus) verwendet (BHK-Zellen, Baby Hamster Kidney).
Epoetin β weist gegenüber Epoetin α eine geringfügig höhere Molekülmasse, ein breiteres Spektrum basischer Isoformen und damit einen geringfügig niedrigeren Sialylierungsgrad auf. Der Anteil tetra-sialylierter Seitenketten ist bei Epoetin β jedoch mehr als doppelt so hoch wie bei Epoetin α. Nach Desialylierung zeigte Epoetin β im Vergleich zu Epoetin α im Mausmodell eine um 20 Prozent höhere pharmakologische Aktivität. Epoetin ω, bedingt durch die unterschiedliche Expressionszelllinie, unterscheidet sich strukturell von der α- und β-Variante durch die Abfolge der Zuckermonomere sowie durch die Anzahl der Verzweigungen in den Zuckerseitenketten (Antennärität, prozentualer Anteil einzelner Verzweigungsarten).
Epoetin γ wird durch eine rekombinante murine Fibroblastenzelllinie exprimiert, Epoetin ε durch eine BHK-Linie (vergleiche Epoetin ω). Beide Varianten haben jedoch, wie auch die Variante Epoetin κ, offenbar keine klinische Relevanz.
Bei Epoetin ζ (Silapo bzw. Retacrit) von Stada/Hospira und Epoetin α von Hexal/Sandoz (Epoetin alfa Hexal, Binocrit) handelt es sich um Nachahmerpräparate des Epoetin α Präparates Erypo/Eprex von Janssen Cilag. Im Vergleich zu Erypo/Eprex enthalten die Nachahmerpräparate weniger O-Glycane sowie weniger der unerwünschten Sialinsäure-Derivate N-Glycolylneuraminsäure und O-Acetylneuraminsäure.[34]
Die EPO-Menge wird eher in Internationalen Einheiten (IE) als in Gramm oder Mol angegeben, da natives oder rekombinantes EPO Mixturen von Isoformen unterschiedlicher biologischer Aktivität darstellen. Eine EPO-Einheit hat per Definition im Nagetiermodell dieselbe erythropoetische Wirkung wie 5 Mikromol Cobaltchlorid. Als Referenzmaterial diente zunächst aus Urin isoliertes humanes EPO.[35][36] 1992 wurde durch die WHO für rekombinantes EPO ein eigener Referenzstandard entwickelt.[37] Das Europäische Direktorat für die Qualität von Arzneimitteln hat für therapeutisches rekombinantes EPO wiederum einen separaten Referenzstandard etabliert (sogenannter BRP-Standard, BRP = (englisch) biological reference preparation). Dabei handelt es sich um ein 1:1-Gemisch von Epoetin α und Epoetin β.[38]
EPO-Präparate der ersten Generation
Im Gegensatz zum Insulin, das vor der Anwendung rekombinanter Insulinpräparate aus Bauchspeicheldrüsen von Schweinen stammte (siehe Organon), gab es eine solch „archaische“ Herkunft für EPO nicht. Erst durch die Isolierung des EPO-Gens sowie durch seine Klonierung und Expression in Säugerzellen war es mit Hilfe biotechnologischer Herstellungsverfahren möglich, das Hormon in Mengen zu produzieren, die für die Therapie ausreichten.
- Das US-amerikanische Biotechnologieunternehmen Amgen brachte 1989 das erste rekombinante EPO-Präparat (Epogen, Epoetin α) auf den Markt. In klinischen Studien der Phasen I und II konnte bereits ab 1986 an der University of Washington in Seattle nachgewiesen werden, dass die Therapie von Anämien mit rekombinantem EPO bei Krebs- und Nierenpatienten wesentlich nebenwirkungsärmer ist als Behandlungen mit Bluttransfusionen. Die patentrechtliche Lage erlaubte Amgen die Exklusivvermarktung von EPO-Präparaten in den USA bis ins Jahr 2015 (nach anderer Quelle lief das Amgen-Patent 2011 aus).[39] Amgens Lizenznehmer in Japan ist der Brauereikonzern Kirin, dessen Pharmasparte die Epoetin α-Variante seit 2001 unter dem Handelsnamen ESPO vertreibt. Im Oktober 2004 kündigte Kirin an, seine Kooperation mit dem japanischen Pharmakonzern Daiichi Sankyo im Vertrieb von ESPO auf dem asiatischen Markt im März 2005 zu beenden.[40]
- Der US-amerikanische Pharmakonzern Johnson & Johnson entwickelte unter der Amgen-Lizenz ein Epoetin α, das unter dem Handelsnamen Procrit innerhalb und Eprex außerhalb der USA erhältlich ist. In Deutschland und Österreich wird das Präparat unter dem Handelsnamen Erypo durch Janssen Cilag (Ortho Biotech), einer Tochtergesellschaft von Johnson & Johnson, vertrieben. Weitere Handelsnamen für den Vertrieb in Italien sind Epoxitin und Globuren. In Spanien und Portugal ist Eprex auch unter dem Namen Epopen durch die Firma Esteve (Laboratorios Pensa) auf dem Markt. In Polen, Russland und der Ukraine wird das Präparat unter dem Namen Epoglobin durch Jelfa Pharmaceuticals vertrieben. Ebenfalls in Polen ist das Präparat Epox über den Arzneimitteldistributor Genexo auf dem Markt. In Bolivien ist ein durch die Firma Laboratories Bagó produziertes Präparat mit dem Namen Eritrogen erhältlich.
- Boehringer Mannheim brachte 1990 ein Epoetin-β-Präparat unter dem Namen NeoRecormon auf den Markt. 1997, als Boehringer Mannheim durch Hoffmann-La Roche aufgekauft wurde, erhielt der Pharmakonzern durch die Europäische Arzneimittelagentur die Zulassung für die europaweite Einführung. In Japan stellt die Firma Chugai, ein seit 2002 zu Hoffmann-La Roche gehöriges Pharmaunternehmen, ebenfalls seit 1990 ein Epoetin-β-Präparat unter dem Handelsnamen Epogin her.
EPO-Präparate der nächsten Generation
Der enorme Erfolg der ersten EPO-Präparate hat dazu geführt, dass (wie bei keinem anderen rekombinant hergestellten Wachstumsfaktor) zahlreiche Strategien entwickelt wurden, um die biologische Aktivität des EPO-Moleküls zu steigern, seine Anwendung zu erleichtern und seine Verträglichkeit zu verbessern. Ein Schwerpunkt lag dabei auf Strukturmodifikationen des Ausgangsmoleküls (Stichworte: Protein-Engineering, Proteindesign). Zudem konnten durch neue Erkenntnisse aus der medizinischen Grundlagenforschung neue Therapiefelder abgesteckt werden. Zur jüngsten Entwicklung in diesem Bereich gehören EPO-Analoga (im Englischen auch als „Mimetics“ bezeichnet), gentherapeutische Ansätze zur Steigerung der EPO-Verfügbarkeit im Organismus und Kombipräparate, die zum Beispiel zur Behandlung neurodegenerativer Erkrankungen eingesetzt werden sollen.
Modifikationen des EPO-Moleküls
- 2001 generierte Amgen unter dem Handelsnamen Aranesp (Darbepoetin α) ein gentechnisch verändertes Erythropoetin. Dieses enthält durch den Austausch von fünf Aminosäuren weitere Zuckerseitenketten, wodurch sich der Anteil endständiger Sialinsäuren und hierdurch die Serumhalbwertszeit um etwa den Faktor drei erhöht. Unter den EPO-Präparaten der nächsten Generation ist es das erste therapeutisch zugelassene. Lizenznehmer für Amgens Darbepoetin α in Italien ist die Firma Dompe Biotec, die das Produkt unter dem Namen Nespo vertreibt. Darbepoetin α wird in CHO-Zellen produziert. 2004 startete Amgen eine Phase-I-Studie zur Anwendung eines hyperglykosylierten Aranesp-Analogon mit der Kennung „AMG114“ bei der Behandlung von Chemotherapie-induzierter Anämie. Im Juni 2006 stellte ein internationales Forscherteam auf dem 43-sten Kongress der American Society of Clinical Oncology (ASCO) Ergebnisse einer Phase-III-Multicenterstudie vor, nach denen „AMG114“ bei einer Serumhalbwertszeit von 131 Stunden geeignet erscheint, um zeitgleich zur Chemotherapie unterschiedlicher Tumorformen (Brustkrebs, Darmkrebs, Non-Hodgkin-Lymphom) angewendet zu werden. Weiterführende Untersuchungen haben jedoch gezeigt, dass das Molekül eine zu geringe Affinität zum EPO-Rezeptor hat. Daher wurden alle klinischen Studien mit „AMG114“ beendet.[41]
- Unter dem Aspekt einer längeren Wirkungsdauer wurde von Hoffmann-La Roche das EPO-Derivat CERA (Continuous Erythropoiesis Receptor Activator, interne Roche-Kennung: Ro 50-3821) entwickelt, bei dem das EPO-Molekül (das aus dem Präparat NeoRecormon bekannte Epoetin β) am N-terminalen Alanin (ALA 1) oder an einem der Lysinreste (LYS 45 oder LYS 52) mit einem Methoxypolyethylenglycolpolymer verknüpft ist (so genannte PEGylierung). Durch die Polymerverknüpfung hat CERA eine Molekülmasse von 66 kDa und ist damit fast doppelt so groß wie natives EPO. Die Serumhalbwertszeit nach intravenöser Gabe liegt gemäß Untersuchungen aus der klinischen Phase II bei rund 133 Stunden und ist damit mehr als fünfmal länger als bei Darbepoetin α. Gemäß pharmakokinetischer Untersuchungen ist die Wirkung von CERA bestimmt durch eine schwächere Bindung des Moleküls an den Erythropoetinrezeptor.[42] Nach erfolgter Bindung löst sich CERA zudem schneller vom EPO-Rezeptor. Gegenwärtig befindet sich CERA auch in einer klinischen Studie (Phase III) bei der Therapie des Non-Hodgkin-Lymphoms. Im April 2006 wurde bei der Europäischen Arzneimittelagentur der Antrag eingereicht, das Präparat unter dem Handelsnamen Mircera in den Verkehr zu bringen. Im Juli 2007 erfolgte die Zulassung durch die Europäische Kommission[43] zur Behandlung der Anämie bei chronischen Nierenerkrankungen (CKD), Sicherheit und Wirksamkeit wurden in anderen Indikationen nicht belegt. In zwei kontrollierten klinischen Studien, in denen Mircera bei Patienten mit verschiedenen Krebserkrankungen einschließlich Kopf- und Hals-Tumoren und Mammakarzinom angewendet wurde, zeigte sich eine ungeklärte erhöhte Mortalität.[44] Im November 2007 erteilte die FDA die Zulassung für Mircera in den USA bei der Behandlung der renalen Anämie mit einmal monatlicher Erhaltungsdosis.
- An der Entwicklung pegylierter EPO-Präparate, die sich noch in vorklinischen Versuchsstadien befinden, sind auch andere Unternehmen wie Bolder Biotechnology (mit BBT-009), PolyTherics (mit Epo TheraPEG), Prolong Pharmaceuticals (mit EPEG), Neose (mit NE-180 = pegyliertes EPO aus Insektenzellen), Lipoxen (ErepoXen, Polysialinsäure statt Polyethylenglycol als Pegylierungspolymer) und das in Heidelberg ansässige Unternehmen Complex Biosystems (reversible PEGylierung zur kontrollierten Freisetzung des Wirkstoffs) beteiligt. Im Februar 2008 gab Neose bekannt, dass die Aktivitäten zu ihrem Präparat NE-180 auf Grund anhaltender Sicherheitsdiskussionen über den Einsatz erythropoesestimulierender Substanzen und hierdurch fehlender Marktperspektiven eingestellt werden. Lipoxen vermeldete im April 2008 den erfolgreichen Abschluss einer in Indien durchgeführten Phase-I-Studie mit ErepoXen und kündigte im Juni 2008 den Beginn einer zweiten Phase-I-Studie in Kanada an. Eine erste Phase-II-Studie mit dem Präparat soll in Indien im zweiten Quartal 2009 gestartet werden. Mit einer Markteinführung von ErepoXen in Russland rechnet das Unternehmen im Jahr 2011.
- Bei dem durch die US-amerikanische Firma CoGenesys entwickelten Präparat Albupoetin ist das EPO-Molekül mit einem humanen Albumin-Molekül verknüpft. Wie bei der PEGylierung erhöht sich durch diese Modifikation die Wirkungsdauer, da das EPO langsamer über die Nieren aus dem Blutkreislauf abgereichert wird. Seine Wirksamkeit habe Albupoetin gemäß Firmeninformation in zahlreichen In-vitro- und In-vivo-Studien gezeigt. Die Technik der Albuminverknüpfung wird durch CoGenesys auch bei anderen Therapeutika (zum Beispiel Somatropin, G-CSF, BNP und Insulin) eingesetzt. Im Januar 2008 wurde CoGenesys durch den israelischen Generikahersteller Teva übernommen.
- Unter der Kennung „PT-401“ arbeitet das in Florida ansässige Unternehmen DNAPrint Genomics in gegenwärtig vorklinischen Studien an einem EPO-Dimer-Präparat, das eine deutlich höhere Affinität zum EPO-Rezeptor haben soll als das native EPO. Im Februar 2008 wurde DNAPrint Genomics durch das US-Pharmaunternehmen Nanobac Pharmaceuticals übernommen.
- Die US-amerikanische Firma Syntonix arbeitet auf der Grundlage ihrer patentierten Transceptor-Technologie an der Entwicklung eines Inhalationspräparates. Bei diesem ist das EPO-Molekül (Funktionseinheit) mit dem kristallinen Fragment (Fc) eines Antikörpers (Transporteinheit) zu einem Fusionsprotein verknüpft (so genannte Epo-Fc). Da das Lungenepithel eine hohe Dichte an Rezeptoren aufweist, die mit dem Fc-Fragment interagieren (so genannte FcRn), wird Epo-Fc, als Inhalationsspray zugeführt rasch in der Lunge aufgenommen und in den Blutkreislauf transportiert. Die Fc-Einheit des Fusionsproteins sorgt zudem dafür, dass die Serumhalbwertszeit gegenüber dem „nackten“ EPO-Molekül deutlich verlängert ist. Dies beruht zum einen auf der erhöhten Molekülgröße (siehe CERA von Hoffmann-La Roche), die das Ausschleusen über die Niere verhindert. Zum anderen wird Epo-Fc nach Endocytose durch die Erythroblasten über den endosomalen Rezyklisierungsweg wieder in den Blutkreislauf abgegeben und steht so erneut zur Verfügung. Epo-Fc befindet sich in der klinischen Erprobungsphase (Klinik Phase I). Am 1. Februar 2007 wurde Syntonix zu einem Tochterunternehmen des Biotechkonzerns Biogen Idec.
Syntonix Mitbewerber auf diesem Gebiet ist Bolder Biotechnology, das ebenfalls ein Epo-Fc entwickelt hat (sogenanntes ImmunoFusion Protein, Kennung: BBT-021). - Das US-amerikanische Biotechnologieunternehmen Warren Pharmaceuticals hat zusammen mit der dänischen Pharmafirma H. Lundbeck A/S ein EPO-Derivat entwickelt, das bei der Therapie neurodegenerativer Erkrankungen helfen soll. Bei dem Präparat CEPO (Kurzform für carbamyliertes EPO) wurde an sämtliche Lysinmonomere des EPO-Moleküls ein Carbamylrest gekoppelt, wodurch sich seine Affinität zu spezifischen neuronalen Rezeptoren erhöht. Im Gegensatz zum nativen EPO-Molekül hat CEPO keine erythropoetischen Eigenschaften. Die Wirkung des Präparats beruht vielmehr auf antiapoptotischen Effekten, die das Absterben von myokardialem und neuronalem Gewebe unterbindet. Im Maus- und Rattenmodell konnten erste Erfolge bei der Behandlung von Ischämischen Schlaganfällen und Enzephalitis erzielt werden.[45] Gleiches gilt für die Therapie des Herzinfarktes im Rattenmodell.[46] Im Oktober 2007 wurde CEPO erstmals in der klinischen Phase I eingesetzt.
- Das israelische Pharmaunternehmen Modigene (seit Juni 2009 in PROLOR Biotech umbenannt) hat ein EPO-Präparat (MOD-7023) entwickelt, bei dem das EPO-Molekül an ein carboxyterminales Peptid des humanen Choriongonadotropin gekoppelt ist. MOD-7023 zeigte gegenüber Standardpräparaten eine verlängerte Serumhalbwertszeit und eine höhere pharmakologische Aktivität.[47] Das Unternehmen wendet diese Technik auch zur strukturellen Modifikation anderer therapeutischer Hormone (Somatotropin, Interferon-β) an.
„Natürliche“ EPO-Varianten
- Ein Gemeinschaftsunternehmen der Firmen Sanofi-Aventis und dem US-amerikanischen Unternehmen Transkaryotic Therapies (seit 2005 vom britischen Pharmaproduzenten Shire Pharmaceuticals[48] akquiriert) vermarktete eine durch Genaktivierung über Transfektion eines viralen Promotor (CMV) von transformierten, humanen Zellen (Linie HT-1080, isoliert aus einem acetabularem Fibrosarkom) erzeugte EPO-Variante unter dem Markennamen DynEpo (Epoetin δ). Shire veröffentlichte erstmals im September 2006 Ergebnisse erfolgreicher Phase-III-Studien.[49] Am 15. März 2007 wurde DynEpo auf dem deutschen Markt eingeführt. Weitere europäische Länder folgten noch im Jahr 2007.[50] Am 31. Juli 2008 gab Shire bekannt, die Produktion von DynEpo zum Ende des Jahres 2008 einzustellen.[51]
- Das französische Biotechunternehmen GenOdyssee hat durch Reihenuntersuchungen eine durch einen so genannten SNPs gekennzeichnete natürliche EPO-Variante entdeckt, die in In-vitro-Experimenten gegenüber nativem EPO eine um 30–50 % gesteigerte Aktivität aufweist. Die als „GO-EPO“ bezeichnete Variante zeigt allein durch den Austausch einer singulären Aminosäure in der Tertiärstruktur eine Konfigurationsänderung nahe der EPO-Rezeptor-Bindungstelle, die die Affinität des Moleküls zum Rezeptor deutlich erhöht.
- Der US-amerikanischen Firma GlycoFi ist es gelungen, ein humanisiertes EPO in Hefen der Gattung Pichia, insbesondere Pichia pastoris, zu generieren. Durch Einführung genetischer Knock-out-Elemente sowie humanspezifischer Gensequenzen in die Hefezellen konnten bei der posttranslationalen Modifikation hefespezifische Glykosylierungen unterbunden und im Gegenzug humanspezifische Glykosylierungsschritte eingeführt werden. Im Mai 2006 wurde GlycoFi durch den US-Pharmakonzern MSD Sharp & Dohme übernommen. Der Einsatz einer pegylierten Form des humanisierten EPO (Kennung: MK2578) wurde in klinischen Studien der Phase II untersucht. Die Entwicklung wurde jedoch 2010 eingestellt.
- Schon seit mehr als einem Jahrzehnt gibt es Bestrebungen, EPO mit Hilfe transgener Tiere (Rinder, Schweine, Ziegen, Schafe) herzustellen. Japanischen Forschern von der Universität in Nagoya gelang erstmals die Produktion von humanem EPO mit Hilfe transgener Hühner. Dabei wird das Hormon aus den Eiern der Tiere isoliert. Die biologische Aktivität des so gewonnenen EPOs in vitro sei mit derjenigen gewöhnlichen rekombinanten EPOs aus CHO-Zellen vergleichbar. Allerdings sei die Glykosylierung unvollständig – so fehlten vielfach die endständigen Sialinsäuren.[52]
EPO-Mimetics
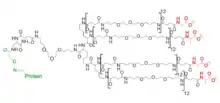
- Die in San Francisco ansässige biopharmazeutische Firma Gryphon Therapeutics (vormals Gryphon Sciences) hat das erste Synthetische Erythropoese-Protein (SEP) entwickelt. SEP ist ein vollsynthetisches Makromolekül, bestehend aus einem Polypeptidrückgrat mit 166 Aminosäuremonomeren, das eine hohe Sequenzhomologie zu dem nativen EPO-Molekül aufweist. Dieses Polypeptid enthält zwei nicht natürliche Lysin-Monomere (Lys 24 (Nε-levulinyl) und Lys 126 (Nε-levulinyl)), über die es chemisch verknüpft ist mit einem negativ geladenen Polymer definierter Länge. Die Aktivität von SEP in vitro ist mit der von EPO vergleichbar. Dagegen ist die Serumhalbwertszeit etwa 2,5 mal länger. Bereits 2002 erwarb Hoffmann-La Roche die Lizenz für die Anwendung des Proteins in den klassischen EPO-Therapiefeldern.[53]
- Die US-amerikanische Firma Affymax hat unter dem Namen Hematide™ (INN Peginesatide, neuer Handelsname: Omontys™) ein EPO-analoges Präparat entwickelt. Beim Wirkstoff handelt es sich um ein kurzkettiges, zyklisches Polypeptid mit einer Disulfidbrücke, dessen Wirkungsweise der des nativen EPO entspricht, dessen Aminosäuresequenz aber keine Homologie zum nativen EPO-Molekül aufweist. Zur Vermeidung einer raschen Ausscheidung über die Nieren und zur Strukturstabilisierung ist das Peptid zudem PEGyliert. Im März 2012 erhielt Omontys™ in den USA die Zulassung für die Behandlung renaler Anämien. Im Februar 2013 kündigte der Hersteller eine Rückrufaktion des Produktes an, da es bei einigen Patienten zu einer zum Teil tödlich verlaufenden anaphylaktischen Reaktion gekommen war.[54]
- Die kanadische Firma ProMetic Biosciences hat mit „PBI-1402“ ein niedermolekulares EPO-Analogon entwickelt, das in klinischen Studien der Phase I stimulierende und antiapoptotische Effekte auf die Bildung von Erythrozyten und Granulozyten gezeigt hat. Inzwischen wird die Substanz in klinischen Phase-II-Studien an Patienten mit Anämien, die durch Chemotherapeutika hervorgerufen werden, untersucht. Erste Ergebnisse dieser Studien wurden auf dem 13. Kongress der Europäischen Gesellschaft für Hämatologie in Kopenhagen im Juni 2008 veröffentlicht.[55]
- Das deutsche Biopharma-Unternehmen AplaGen Biopharmaceuticals aus Baesweiler bei Aachen hat ein EPO-Mimetikum, HemoMer™, entwickelt, bei dem das Funktionspeptid an ein Polysaccharid-basiertes Makromolekül gekoppelt ist. Ähnlich wie bei PEGylierten soll durch die Erhöhung der Molekülgröße die Ausscheidung über die Nieren verzögert werden. Das so genannte Supravalenz-Prinzip sorgt zudem dafür, dass im Gegensatz zur PEGylierung zum einen die Wirksamkeit verstärkt und zum anderen der Wirkstoffträger auch im Körper abgebaut wird. Das Präparat befindet sich gegenwärtig in den präklinischen Studien und kann bisher sowohl intravenös als auch parenteral angewandt werden. Das Unternehmen arbeitet auch an weiteren Cytokin-Mimetika sowie alternativen Darreichungsformen. Im Jahr 2010 musste das Unternehmen Insolvenz anmelden.[56]
- Die Firma Abbott Laboratories hat einen therapeutischen humanisierten Antikörper (ABT007) entwickelt, der in präklinischen Untersuchungen im Mausmodell durch Bindung an den EPO-Rezeptor die Reifung von Vorläuferzellen zu Erythrozyten und damit eine Erhöhung des Hämatokrits bewirkt. Aufgrund der besonderen Bindungseigenschaften des Antikörpers sei eine im Vergleich zu EPO-Standardpräparaten weniger häufige Verabreichung erforderlich.[57]
- Die Bindung von EPO an seinen zugehörigen Rezeptor (EpoR) kann durch bestimmte Substanzen verhindert werden, die ihrerseits anstelle von EPO an den Rezeptor binden (siehe kompetitive Hemmung). Der US-Pharmakonzern Merck hat durch ein kompetitives Screening-Verfahren eine solche Substanz (N-3-[2-(4-biphenyl)-6-chloro-5-methyl]indolyl-acetyl-L-lysin-methyl-ester) identifiziert, die im Zellkulturmodell als Oktamer-Molekül (sternförmige Verknüpfung von acht Einzelmolekülen über ein zentrales „Kernmolekül“, Bezeichnung: „Compound 5“) eine zu EPO identische Rezeptor-Antwort (Homodimerisierung und nachfolgende Signaltransduktionskaskaden) bewirkt.[58] „Compound 5“ ist vollsynthetisch und besitzt als bisher einziges ESA, dessen Wirkung direkt über den EPO-Rezeptor vermittelt wird, kein Aminosäure-Rückgrat. Hierdurch wäre im Gegensatz z. B. zu den EPO-Standardpräparaten auch eine perorale Verabreichung denkbar (siehe auch Kapitel Darreichungsformen). Weiterführende Studien im präklinischen oder klinischen Einsatz von „Compound 5“ wurden allerdings bisher nicht veröffentlicht.
- Das US-amerikanische Biotechnologie-Unternehmen Centocor hat unter der Kennung „CTNO 528“ ein EPO-mimetisches Antikörper-Fusionsprotein ohne strukturelle Ähnlichkeit zu Erythropoetin entwickelt. Im Rattenmodell war „CTNO 528“ bei der Behandlung von Erythrozytenaplasie erfolgreich. In einer ersten Phase-I-Studie am Menschen konnte durch das Präparat dosisabhängig die Anzahl der Retikulozyten sowie die Hämoglobinkonzentration erhöht werden.[59]
- Das US-amerikanische Pharmaunternehmen Ligand Pharmaceuticals arbeitet an der Entwicklung eines nicht peptidischen, oral applizierbaren EPO-Mimetikums.
Gentherapie
- Einen gentherapeutischen Ansatz verfolgt das britische Unternehmen Oxford BioMedica mit seinem Präparat Repoxygen in der vorklinischen Phase. Das Mittel wird intramuskulär gegeben und enthält adenovirale Genshuttle, mit Hilfe derer das EPO-Gen in die Muskelzellen transferiert wird. Die Expression des EPO-Gens wird gesteuert über einen sauerstoffsensitiven Transkriptionsfaktor. Auf diese Weise wird nur dann EPO in den transfizierten Muskelzellen gebildet, wenn die Sauerstoffsättigung im Blut einen kritischen Wert unterschreitet. Im Rahmen des Verfahrens gegen den Leichtathletiktrainer Thomas Springstein wegen des Verdachts auf Gendoping im Januar 2006 teilte Firmengründer Alan Kingsman mit, dass Oxford BioMedica die Produktion des Wirkstoffs bis auf weiteres eingestellt habe.[60]
- Das US-amerikanische Pharmaunternehmen Medgenics arbeitet an der Entwicklung einer so genannten „Biopumpe“. Dabei wird dem Patienten unter Lokalanästhesie durch eine minimalinvasive Biopsie subdermales Gewebe, ein so genanntes „Mikroorgan“, entnommen. Das so gewonnene Mikroorgan wird anschließend mittels adenoviraler Vektoren mit dem EPO-Gen transfiziert. Die auf diese Weise genetisch veränderten Zellen produzieren dann das gewünschte Protein (Erythropoetin). Nach einigen Zwischenschritten zur Entfernung überschüssiger Adenoviren und zur funktionellen Überprüfung wird das Mikroorgan zurück in den Patienten transplantiert (so genannte autologe Transplantation). Gemäß Angaben durch Medgenics bleibt die Funktion dieser Biopumpe über einen Zeitraum von 6 Monaten erhalten.[61] Im März 2009 berichtete Medgenics von erfolgreichen Ergebnissen einer Phase-I/II-Studie ihrer EPODURE-Therapie. Danach lebte ein Patient bereits seit 11 Monaten mit drei EPODURE-Transplantaten ohne jegliche externe EPO-Zufuhr.
- Bei 5 bis 10 % derjenigen Dialysepatienten, bei denen die Erythropoese trotz Behandlung mit hochdosierten EPO-Präparaten nicht anspricht (so genannte EPO-Hyporesponsivität), liegt die Ursache hierfür in einer erhöhten Expression des Proteins SHP-1. Bei SHP-1 handelt es sich um eine Protein-Phosphatase, die in hämatopoetischen Vorläuferzellen des Typs BFU-E durch Dephosphorylierung des Enzyms Janus Kinase 2 den Ablauf der JAK-STAT-Signaltransduktionskaskade nach Bindung von EPO an seinen Rezeptor unterbindet und damit die Reifung der Vorläuferzellen zu Erythrozyten verhindert (siehe hierzu Kapitel Biologische Funktion). Eine japanische Forschergruppe konnte zeigen, dass durch das Einschleusen von Antisense-RNA in Vorläuferzellen des Typs BFU-E, die zuvor aus EPO-hyporesponsiven Dialysepatienten isoliert wurden, die Proteinbiosynthese des SHP-1 durch komplementäre Bindung an die zugehörige mRNA verhindert wird. Die so behandelten Vorläuferzellen setzten den durch EPO gesteuerten Reifungsprozess fort.[62] Anstelle eines solchen gentherapeutischen Ansatzes schlagen die Autoren allerdings die Identifizierung von Substanzen vor, welche die Aktivität von SHP-1 hemmen. Zu diesen Substanzen könnte möglicherweise 4-Hydroxynonenal gehören, dessen inhibierende Wirkung auf SHP-1 in physiologischer Konzentration bereits beschrieben wurde.[63]
Induktoren der EPO-Synthese
- Das US-amerikanische Unternehmen FibroGen arbeitet an der Entwicklung eines Medikaments mit der Bezeichnung „FG-2216“. Die Substanz inhibiert die Funktion des Enzyms Prolylhydroxylase, das für den Abbau des so genannten „Hypoxie-induzierten Faktors“ (kurz: HIF, siehe Kapitel Biosynthese) verantwortlich ist. Durch die so erreichte HIF-Stabilisierung wird das EPO-Gen überexprimiert. Eine entsprechende Wirkungsweise hat auch das ebenfalls von FibroGen entwickelte Präparat „FG-4592“, das bei der Behandlung des so genannten ACD-Syndroms (engl. Anemia of Chronic Disease) angewendet werden soll. Zudem scheinen beide Substanzen die Expression weiterer für die Erythropoese wichtiger Gene zu fördern (EPO-Rezeptor, Transferrin, Transferrin-Rezeptor, Ferroportin). Der japanische Pharmakonzern Astellas erwarb im April 2006 die Rechte für den Vertrieb beider Präparate außerhalb der USA.[64]
- Auch das Präparat „AKB-6548“ des US-amerikanischen Unternehmens Akebia Therapeutics ist ein Inhibitor der Prolylhydroxylase. Im September 2009 kündigte Akebia eine Phase-I-Studie nach oraler Verabreichung bei Patienten mit chronischem Nierenleiden und Prä-Dialysepatienten an.[65]
- Das südkoreanische Pharmaunternehmen CrystalGenomics arbeitet in Konkurrenz zu seinen amerikanischen Mitanbietern ebenfalls an der Entwicklung von Therapeutika, die die Wirkung des HIF-Proteins stabilisieren.[66] Palkon Inc., ein Joint-Venture zwischen CrystalGenomics und der Risikokapitalgesellschaft ProQuest Investment, kündigte im Juni 2009 den Beginn präklinischer Studien mit Präparaten zur HIF-Stabilisierung an.
- Unter Beteiligung des Arzneimittelherstellers Kowa Pharmaceutical wird in Japan an einem Präparat mit der Bezeichnung „K-11706“ gearbeitet. Die Wirkung des Präparats beruht auf der Inhibition des Transkriptionsfaktors GATA2, der durch Bindung an den EPO-Promotor die Expression von Erythropoetin verhindert. K-11706 soll therapeutisch zur Behandlung des ACD-Syndroms (siehe oben), bei dem inflammatorische Zytokine wie Interleukin 1-β und TNF-α die DNA-Bindung von GATA2 begünstigen, eingesetzt werden. Erste Erfolge wurden im Mausmodell nach oraler Verabreichung erzielt.[67]
Chimäre EPO-Proteine und Kombinationstherapien
- 1999 patentierte der italienische Pharmakonzern Menarini die Produktion eines Fusionsproteins in CHO-Zellen, das sich aus EPO und dem „Granulozyten-Makrophagen koloniestimulierender Faktor“ (kurz: GM-CSF) zusammensetzt (US-Patent 5,916,773). Das Fusionsprotein mit der Bezeichnung „MEN 11303“ erzielte in In-vitro-Untersuchungen eine im Vergleich zu äquimolaren Dosen der Einzelfaktoren signifikante Verbesserung bei der Expansion von erythroiden Progenitorzellen. Gegenwärtig wird die Möglichkeit des Präparats bei der Ex-vivo-Vermehrung menschlicher Stammzellen untersucht.
- Das kanadische Unternehmen Stem Cell Therapeutics hat mit NTx-265 ein Behandlungsverfahren entwickelt, bei dem durch kombinatorische Gabe von hCG (Humanes Choriongonadotropin) und EPO im Tiermodell Erfolge bei der Behandlung von Schlaganfällen erzielt werden konnten. Von einer erfolgreichen Phase-II-Studie an Patienten wurde im Februar 2008 berichtet.
- Wissenschaftler des Universitätsspitals Lausanne (CHUV) haben in einem Mausmodell herausgefunden, dass das Protein Gas6 die Bildung roter Blutkörperchen positiv beeinflusst. Bei gesunden Mäusen, denen man EPO verabreichte, produzierten bestimmte Vorläuferzellen der Erythrozyten (so genannte Erythroblasten) das besagte Protein. Gas6 wiederum führte zu einer verbesserten Ansprechrate der Mäuse auf EPO hinsichtlich der Bildung neuer roter Blutkörperchen. Bei akut und chronisch anämischen Mäusen, die auf EPO allein nicht ansprachen, führte die Zugabe von Gas6 zu einer Erhöhung des Hämatokrit. Auf Grundlage dieser Ergebnisse im Tierversuch gehen die Autoren davon aus, dass zukünftig Gas6 allein oder in Verbindung mit EPO bei Anämietherapien von Patienten eingesetzt werden kann, bei denen die alleinige Verabreichung von EPO bisher keinen Erfolg erzielt hat.[68]
Nachahmerpräparate (Biogenerika, Biosimilars, Follow-on-Biologicals)
Die Entwicklung und der Einsatz von Biopharmazeutika in der Medizin seit den 1980er Jahren haben zu wesentlichen Fortschritten in der Therapie von schwerwiegenden Erkrankungen, wie Stoffwechselstörungen sowie Krebs- und Autoimmunerkrankungen geführt. Allerdings sind Biopharmazeutika sehr teuer und können das 25fache eines herkömmlichen Arzneimittels kosten, was zu erheblichen Belastungen des Gesundheitssystems führen kann. Der Ablauf der Patente für einige Biopharmazeutika (darunter auch EPO) seit 2004 und die von der Europäischen Arzneimittelagentur erlassenen Leitlinien für ähnliche biologisch-medizinische Produkte[69] im Allgemeinen und die Leitlinien für ähnliche biologisch-medizinische Produkte, die rekombinantes Erythropoetin enthalten[70] im Speziellen erlaubten Generikaherstellern, in das Geschäft mit EPO und anderen Biopharmazeutika einzusteigen (siehe Kapitel Marktdaten für EPO-Präparate). Aufgrund der hohen Anforderungen an das Know-how und die hohen Entwicklungskosten können das allerdings nur wenige Generikahersteller. In einigen Ländern außerhalb der Europäischen Union sowie in Asien, Afrika und Südamerika waren EPO-Generika (Biosimilars) bereits frühzeitig verfügbar. Vielfach wäre es sinnvoller, bei Produkten außerhalb der Europäischen Union von EPO-Plagiaten zu sprechen, da entsprechende EPO-Präparate bereits seit vielen Jahren im Umlauf sind und da bei deren Herstellung und Vertrieb auf Patente und Lizenzen nur wenig Rücksicht genommen wurde. In den USA hat Amgen auf Grund der patentrechtlichen Situation gegenwärtig ein exklusives Vertriebsrecht. Strenge und standardisierte Zulassungsrichtlinien zur Einführung von Nachahmerpräparaten, wie sie die Europäische Arzneimittelagentur erlassen hat, wurden zwar bereits 2003 von der FDA angekündigt, bisher jedoch nicht umgesetzt. Nach dem Regierungswechsel in den USA und dem erklärten Ziel von Präsident Barack Obama, die Arzneimittelkosten drastisch zu senken, wurde als erster Schritt für die Einführung von Nachahmerpräparaten im März 2009 dem US-Kongress der sogenannte Biosimilar Act als Gesetzentwurf vorgelegt. Im November 2010 fanden Anhörungen vor der FDA statt. Innerhalb der EU sind die ersten EPO-Biosimilars im August 2007 zugelassen worden.
Für Nachahmerpräparate hochkomplexer Proteine hat sich bisher kein einheitlicher Begriff durchgesetzt. In der wissenschaftlichen Literatur wird jedoch am häufigsten der Begriff Biosimilar verwendet. Der Name nimmt Bezug auf die hohe Ähnlichkeit zwischen dem Biosimilar und seinem Referenzprodukt (similar = englisch für „ähnlich“), das landläufig auch als Original oder Originalpräparat bezeichnet wird. Dass Originalpräparat und Biosimilar nicht zu hundert Prozent identisch sein können, liegt an der Besonderheit des Herstellungsprozesses. Der Nachbau hängt, da der Wirkstoff biotechnologisch produziert wird, entscheidend von den Spezifikationen des Herstellungsprozesses ab. Dazu gehören unter anderem die Auswahl der Zelllinie, die Wahl der Produktionsanlage, die Zusammensetzung der Nährsubstanz sowie Temperatur- und Druckverhältnisse während der Produktion. Alle Biopharmazeutika einer Wirkstoffgruppe unterscheiden sich geringfügig. Das trifft nicht nur auf Biosimilars und ihr Referenzprodukt, sondern auch auf die Originalpräparate untereinander zu. Weil sie aus lebenden Zellen gewonnen werden, gibt es immer geringfügige Unterschiede, etwa zwischen den Chargen eines einzelnen Herstellers oder zwischen Herstellern desselben Wirkstoffs.
In Europa wird der Herstellungsprozess engmaschig kontrolliert, um eine größtmögliche Ähnlichkeit zwischen dem Biosimilar und seinem Referenzprodukt zu garantieren. Er unterliegt den gleichen strengen Qualitätsrichtlinien, die auch für die Originalpräparate gelten. Bevor ein Biosimilar auf den europäischen Markt kommt, müssen die Hersteller von Biosimilars ein umfassendes Studienprogramm durchführen. Art und Ausführung der Biosimilars-Studien werden von der Europäischen Arzneimittelagentur (EMA) vorgeschrieben und die Ergebnisse im Rahmen des Zulassungsverfahrens geprüft. Die Zulassung ist Voraussetzung für den therapeutischen Einsatz. Die gelegentlich verwendete Bezeichnung „Biogenerikum“ (plur.: „Biogenerika“) ist eine unzureichende Charakterisierung dieser regulatorischen Arzneimittelklasse (amerikanische Bezeichnung: „Follow-on biologics“).
Asien
- Seit 2000 drängen zahlreiche indische Pharmaunternehmen mit eigenen Präparaten auf den heimischen Markt. Hierzu zählen die Firmen Emcure mit den Präparaten Vintor und Epofer, Wockhardt mit Wepox, Zydus Biogen mit Zyrop, Ranbaxy mit dem Präparat Ceriton, Shantha Biotechnics mit Shanpoietin sowie Intas Pharmaceuticals mit den Präparaten Epofit und Erykine, Claris Lifesciences mit Epotin und Zuventus mit Eporise. Die nach eigenen Angaben größte Produktionsanlage zur Herstellung rekombinanter Proteine (darunter auch EPO) des in Bangalore ansässige Biotechunternehmen Biocon wurde im April 2006 in Betrieb genommen. Inzwischen vertreibt Biocon das EPO-Präparat ERYPRO. Im Juni 2009 ging Biocon eine strategische Partnerschaft mit dem US-amerikanischen Pharmaunternehmen Mylan für den Vertrieb in den USA ein. Der aus der Übernahme der britischen Firma GeneMedix durch das indische Unternehmen Reliance Industries hervorgegangene Arzneimittelhersteller Reliance Life Sciences vertreibt seit 2008 das EPO-Präparat ReliPoietin.
- Das in Vancouver ansässige kanadische Pharmaunternehmen Dragon Biotech produziert seit 2004 ein generisches EPO in einer Anlage in Nanjing (China) und vertreibt dieses in China, Indien, Ägypten, Brasilien, Peru, Ecuador, Trinidad & Tobago sowie in der Dominikanischen Republik und im Kosovo. Zudem kündigt das Unternehmen die Entwicklung eines neuen EPO-Produktes für den europäischen Markt an.
- Neben Dragon Biotech sind weitere Unternehmen mit EPO-Präparaten auf dem chinesischen Markt vertreten. Zu ihnen gehören die in Hongkong ansässigen Firmen Refinex Medical und Medichem, ferner die Unternehmen SciProgen (Präparat: SEPO), Beijing Four Rings Biopharmaceuticals, Shandong Kexing Bioproducts (Präparat: EPOSINO), Kelun Biopharmaceuticals, Chengdu Diao, Shanghai Ke-hua, Shangdong Ahua, Shenzhen Xinpeng, Shanghai Sanwei und 3SBio Shenyang Sunshine Pharmaceuticals (kurz: SSP). Die Firma PlasmaSelect aus München beabsichtigt die Vermarktung des von SSP vertriebenen EPO-Präparats EPIAO in Europa,[71] das in China einen Marktanteil von etwa 40 % besitzt. Das in Shijiazhuang ansässige Pharmaunternehmen North China Pharmaceutical Group Corporation (NCPC), Chinas größter Produzent von Antibiotika, vertreibt ein durch sein Joint Venture GeneTech Biotechnology produziertes EPO-Präparat unter dem Handelsnamen GerEpo.
- In Vietnam produziert das in Ho-Chi-Minh-Stadt ansässige Unternehmen Nanogenpharma ein EPO-α-Präparat unter dem Namen Bioetin.
- In Südkorea ist das EPO-Präparat Epokine (EPO α) vom biopharmazeutischen Unternehmen CJ Corp auf dem Markt. Epokine ist auch in anderen asiatischen Ländern (zum Beispiel Pakistan und Philippinen) und Südamerika (zum Beispiel Chile) durch lokale Distributoren erhältlich. Das Präparat Eporon wird durch CJ Corps heimischen Konkurrenten Dong-A Pharmaceutical vertrieben. Im südamerikanischen und pazifischen Raum ist Eporon durch die kolumbianische Firma Chalver Laboratorios unter dem Namen Eritina auf dem Markt. Ein drittes Unternehmen ist LG Lifescience mit Espogen, das auch durch die Tochtergesellschaft LG Lifescience India in Indien vertrieben wird. Seit 2000 besteht eine Kooperationsvereinbarung zwischen LG Lifescience und dem Schweizer Biogenerikaentwickler Biopartners für eine geplante Einführung von Espogen und anderen Biopharmazeutika in der Europäischen Union.
- Am 5. Februar 2007 wurde die nach Angaben des Leiters des Pasteur Institute of Iran, Abdolhossein Rouholamini Najafabadi, größte Produktionsanlage für rekombinante Proteine (darunter Erythropoetin) in Südwest-Asien in Anwesenheit des iranischen Präsidenten Mahmud Ahmadineschad eingeweiht.[72] In dieser Anlage produziert der iranische Pharmakonzern Pooyesh Darou Pharmaceuticals unter anderem das EPO-Präparat PDpoetin.
- Das iranische Biotechnologie-Unternehmen Cinnagen produziert in Zusammenarbeit mit dem Arzneimittelhersteller Zahravi Pharmaceuticals das EPO-Präparat Erytrex (Epoetin β).
- In Indonesien sind die Pharmaunternehmen Novell Pharmaceutical Laboratories und Kalbe Farma mit den Präparaten Epotrex beziehungsweise Hemapo vertreten.
- Das größte Pharmaunternehmen der Philippinen, United Laboratories Inc., vertreibt über sein Tochterunternehmen Biomedis Inc. das Präparat Renogen.
USA, Mittel- und Südamerika
- In Brasilien hat das Pharmaunternehmen Cristália in Kooperation mit dem halbstaatlichen Forschungsinstitut Instituto Butantan ein rezeptfrei erhältliches generisches EPO[73] entwickelt. Ebenfalls in Brasilien vertreten ist das Pharmaunternehmen Blausiegel mit den Präparaten Eritromax und AlfaEpoetina.
- In Argentinien werden (neben dem Präparat Hemax, siehe oben) die Präparate Epoyet und Hypercrit durch das Pharmaunternehmen Bio Sidus produziert.
- Auf Kuba wurde unter Federführung des staatlichen Centro de Ingeniería Genética y Biotecnología eine generische α-Variante in CHO-Zellen entwickelt, die vom Pharmaunternehmen Heber Biotec mit Sitz in Havanna unter dem Handelsnamen Heberitro für den heimischen Markt vertrieben wird. Heber Biotecs lokaler Mitanbieter ist das Unternehmen CIMAB S.A. mit dem Produkt EPOCIM.
- Das US-amerikanische biopharmazeutische Serviceunternehmen Protein Sciences hat ein Verfahren zur Produktion eines EPO-Biosimilars in Insektenzellen entwickelt und bietet dieses Verfahren als Lizenzgeber an. Das in Insektenzellen, die mit Baculoviren transfiziert sind, generierte EPO hat laut Firmeninformation eine biologische Aktivität, die etwa dem Doppelten des EPO-Standardpräparats (Epogen) entspricht.
- Die AXXO GmbH, ein in Hamburg ansässiges Unternehmen, erwarb unlängst die mexikanische Firma Nedder Farmaceuticos, die als Tochtergesellschaft unter dem Namen Axxo Mexico firmierte und unter anderem ein rekombinantes EPO für den lateinamerikanischen Markt produziert. Die heimischen Konkurrenten sind die Pharmaunternehmen Probiomed mit BIOYETIN™, Pisa mit EXETIN-A und Laboratorios Cryopharma mit EPOMAX.
Afrika und Nahost
- In Südafrika wird seit 1997 durch die Firma Bioclones aus Johannesburg ein EPO-Präparat unter dem Handelsnamen Repotin (EPO α) hergestellt.
- Mindestens vier Unternehmen in Ägypten stellen EPO-Präparate für den heimischen Markt her: EIPICO mit Epoform, Amoun Pharmaceuticals mit Erypoietin, Sedico mit Epoetinv und T3A Pharma mit Pronivel. In Argentinien wird Pronivel durch das Pharmaunternehmen Laboratorio Elea vermarktet.
- In Israel findet sich mit InSight Biopharmaceuticals der bisher einzige Hersteller von generischem EPO als Bulk-Ware. Die Firma Prospec TechnoGene produziert zwar ebenfalls α- und β-Varianten von EPO in CHO-Zellen, dies allerdings nur für Laborzwecke.
- Das im Emirat Ra’s al-Chaima ansässige Pharmaunternehmen Julphar (Gulf Pharmaceuticals Industries) stellt eine EPO-α-Variante unter dem Handelsnamen Epotin her.
Europa
- Im Juni 2005 erhielt das kroatische Pharmaunternehmen Pliva durch die zuständige lokale Zulassungsbehörde die Erlaubnis, ein EPO-Generikum (Epoetal) in Kroatien zu vermarkten. Eine Ausweitung der Vertriebsrechte für den gesamteuropäischen Markt wurde in Zusammenarbeit mit dem australischen Unternehmen Mayne Pharma angestrebt, gemäß Pressemitteilung vom 22. Februar 2006[74] allerdings eingestellt. Hintergrund für diese Entscheidung sind möglicherweise die bei einer Inspektion im Januar/Februar 2006 durch die FDA festgestellten massiven Verstöße gegen die Richtlinien der Guten Herstellungspraxis in Plivas Produktionsstätte in Zagreb.[75] Nachdem auch eine Übernahme durch den isländischen Generikahersteller Actavis gescheitert ist, bemüht sich seit Juni 2006 das US-amerikanische Pharmaunternehmen Barr Pharmaceuticals um Pliva. Durch ein am 18. Juli 2008 abgeschlossenes Übernahmeverfahren gehört Barr Pharmaceuticals und damit auch Pliva zum israelischen Pharmakonzern Teva Pharmaceutical Industries.
- In der Ukraine produziert das Unternehmen Biopharma ein EPO-Präparat unter dem Produktnamen Epocrin (Епокрин) für den heimischen und den russischen Markt. Hersteller der Epocrin-Variante (Эпокрин) in Russland ist die Pharmafirma Sotex.
- In England kündigte der Generikahersteller GeneMedix bereits im Mai 2005 die Markteinführung eines EPO-Präparats mit dem Produktnamen Epostim an. Zwischenzeitlich wurde der angestrebte Termin auf das dritte Quartal 2007 verschoben. Am 31. März 2008 gab GeneMedix bekannt, die Herstellerlaubnis für Epostim in der Produktionsanlage in Tullamore (Irland) und die Genehmigung zur Durchführung klinischer Studien in der Europäischen Union erhalten zu haben. Inzwischen wurde GeneMedix durch das indische Unternehmen Reliance Industries übernommen.
- Der Unternehmensvorstand von Stada Arzneimittel erklärte in einer Pressemitteilung vom 30. März 2006,[76] dass man die Einreichung der Zulassungsunterlagen bei der Europäischen Arzneimittelagentur für die Produktion und den Vertrieb eines EPO-Generikums im zweiten Quartal 2006 plane und mit der Markteinführung Ende 2006 beziehungsweise Anfang 2007 zu rechnen sein werde. Am 30. Juni 2006 ließ STADA verlauten, dass das Unternehmen die Zulassungsunterlagen bei der Europäischen Arzneimittelagentur für die Produktion eines Erythropoetin zeta am selben Tag eingereicht habe.[77] Kooperationspartner für die Produktion des Biosimilars für die klinische Studie ist das in Bielefeld ansässige Biotechunternehmen Bibitec.[78] Das US-amerikanische Unternehmen Hospira erwarb im November 2006 die Vertriebsrechte für Erythropoetin zeta für die Vermarktung in der Europäischen Gemeinschaft sowie in Kanada/USA.[79] Am 18. Oktober 2007 erhielten STADA und Hospira einen Positivbescheid des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur für die Markteinführung der Präparate Silapo bzw. Retacrit.[80] Den endgültigen Zulassungsbescheid zur Markteinführung beider Präparate für das erste Quartal 2008 erhielt STADA am 19. Dezember 2007.[81] Hospira, seit 2015 Bestandteil des US-Pharmakonzerns Pfizer, erhielt am 15. Mai 2018 als erstes Unternehmen die Zulassung durch die FDA für den US-amerikanischen Markt.[82]
- Der britische Generikahersteller Therapeutic Proteins kündigte in einer Pressemitteilung vom 12. Mai 2006 an,[83] Zulassungsunterlagen bei der Europäischen Arzneimittelagentur für die Produktion und den Vertrieb eines EPO-Generikums unter dem Handelsnamen TheraPoietin sowie für zwei weitere Biosimilars einzureichen. Die Produktion aller drei Biosimilars soll in Zusammenarbeit mit dem britischen Auftragsproduzenten Angel Biotechnology erfolgen.
- Der Generikahersteller HEXAL erhielt 2007 als erster die Zulassung der EU-Kommission für ein Epoetin-Biosimilar unter dem Handelsnamen Epoetin alfa Hexal.[84] Das Präparat wurde ferner unter dem Markennamen Binocrit (Sandoz)[85] sowie Abseamed (Medice) zugelassen.[86] Alle drei Präparate werden von der Firma Rentschler Biotechnologie in Laupheim in Lohnfertigung hergestellt. Mit dem Medizintechnikunternehmen Gambro einigte sich Sandoz im Januar 2008 auf die Entwicklung einer gemeinsamen Vertriebsstruktur für das Präparat Binocrit in Deutschland.
- Der Generikahersteller Ratiopharm erhielt im Juli 2009 die Zulassungsempfehlung des humanmedizinischen Ausschusses (CHMP) der Europäischen Arzneimittelagentur für ein selbst entwickeltes EPO-Biosimilar. Die endgültigen Marktzulassung des Präparates Eporatio (Epoetin θ), das auch durch die Berliner CT Arzneimittel unter dem Handelsnamen Biopoin vertrieben wird, erfolgte im Dezember 2009.[87]
Der Fall „Eprex“
Ab 1998 kam es zu schweren Nebenwirkungen bei der Anwendung des EPO-Mittels Eprex/Erypo. Auf Veranlassung der zuständigen Behörde mussten sämtliche humane Proteinbestandteile wegen möglicher Kontaminationsrisiken durch HIV beziehungsweise Erreger der Creutzfeldt-Jakob-Krankheit aus der Formulierung von Arzneimitteln entfernt werden. Der Hersteller Ortho Biotech verwendete daraufhin anstelle von humanem Serumalbumin den Stabilisator Polysorbat 80. Eine von Johnson & Johnson durchgeführte Studie ergab, dass die Zugabe von Polysorbat fatalerweise zur Herauslösung von Weichmachern aus den Gummistopfen der Epo-Spritzen führte. Diese lösten bei mindestens 250 mit Erypo behandelten Patienten Immunreaktionen und eine Erythroblastopenie (engl. Pure Red Cell Aplasia = PRCA) aus. Dieser Zwischenfall warf weltweit die Frage auf, inwieweit auch veränderte Aminosäuresequenzen, abgewandelte Glykostrukturen oder Verunreinigungen bei der Herstellung therapeutischer Proteine und derer Derivate (zum Beispiel Biosimilars) zu derartigen Nebenwirkungen führen können. Die brasilianische Zulassungsbehörde Agência Nacional de Vigilância Sanitária (kurz: ANVISA) verhängte noch im selben Jahr ein Importverbot zweier EPO-Präparate. Bei einer Studie der Universität Utrecht zu acht Präparaten, die außerhalb der EU und der USA vertrieben werden, wurden gravierende Mängel hinsichtlich Wirksamkeit, Reinheit und Formulierungskonsistenz festgestellt. Diese Ergebnisse wurden durch eine neuerliche Studie mit Präparaten aus Korea, China und Indien bestätigt.[88] Neuere Untersuchungen an der Universität Utrecht der nach den europäischen Richtlinien in Europa zugelassenen Epo-Biosimilars zeigen jedoch, dass diese eine zu den Originalpräparaten mindestens gleichwertige Qualität haben.[89]
Darreichungsformen
Die übliche galenische Form der durch zuständige Behörden gegenwärtig zugelassenen EPO-Präparate ist die einer Injektionslösung mit unterschiedlicher Wirkstoffkonzentration (etwa 500 bis 30.000 IE). Neben EPO enthält die Lösung auf der Basis von Wasser für Injektionszwecke zusätzlich Hilfsstoffe (etwa Harnstoff, Polysorbat 20, verschiedene Aminosäuren und Natriumsalze), die der Wirkstoffstabilität dienen. Die Injektionslösungen werden entweder subkutan oder intravenös appliziert. Je nach Applikation, Wirkstoffkonzentration, Indikation und Wirkungsdauer oder Serumhalbwertszeit des Präparats sind mehrere Injektionen pro Woche oder auch nur eine einmalige Injektion pro Monat erforderlich. Der DDD-Wert liegt bei den Präparaten der ersten Generation bei 1000 IE, im Fall der Präparate Aranesp und Mircera bei je 4,5 Mikrogramm.
An alternativen Darreichungsformen wird insbesondere im Zusammenhang mit der Entwicklung neuer erythropoetischer Medikamente gearbeitet (z. B. intrapulmonale Gabe des EPO-Fc-Präparats der Firma Syntonix und intramuskuläre Gabe des Präparats Repoxygen von Oxford BioMedica, siehe dazu im Kapitel EPO-Präparate der nächsten Generation). Bei den Standardpräparaten (z. B. Procrit von Johnson & Johnson) wurden Formulierungen mit verzögerter Freisetzung untersucht, z. B. über die so genannte Enkapsulierung in biologisch abbaubaren Mikrosphären.[90] Das Hauptziel dabei war, die Intervalle zwischen den Einzelgaben zu verlängern und die Verträglichkeit zu verbessern. Ein gravierendes Problem der Enkapsulierung ist die Bildung von EPO-Aggregaten, die eine Anwendung am Patienten ausschließt. Ende der 1990er Jahre konnte die US-amerikanische Firma Alkermes dieses Problem durch ihre patentierte ProLease-Technologie umgehen.[91] Jedoch stellen die Mikrosphären mögliche antigene Adjuvanzien dar, die beim Patienten unerwünschte Immunreaktionen auslösen können. Dies erklärt möglicherweise, weshalb es bisher nicht zu klinischen Untersuchungen dieser Formulierungen kam. Eine japanische Arbeitsgruppe konnte dagegen im Mausmodell zeigen, dass eine Einbettung von EPO in Gelatine-Hydrogel-Mikrosphären erfolgreich bei der Behandlung von Durchblutungsstörungen in den unteren Extremitäten eingesetzt werden kann.[92]
Auch an oralen Applikationsformen wurde geforscht, bei denen das Problem der Säuredenaturierung durch den Magensaft überwunden werden musste. In Kooperation mit Johnson & Johnson arbeitete die britische Firma Provalis (vormals Cortecs International) an oralen Formulierungen. Ergebnisse hierzu wurden jedoch nie veröffentlicht. Mit der Insolvenz von Provalis im Jahr 2006 kamen diese Aktivitäten zum Erliegen. An einem neuerlichen Ansatz der oralen Verabreichung von EPO arbeitet die US-amerikanische Firma Access Pharmaceuticals. Dabei wird der natürliche Aufnahmeweg des Vitamin B12 genutzt. Durch das Beschichten von EPO mit dem Vitamin-B12-Derivat Cyanocobalamin entstehen Nanopartikel, die in Zusammenspiel mit dem im Mundspeichel enthalten Haptocorrinen und dem im Magen befindlichen Intrinsic-Faktor einen Komplex bilden, der vor der Zerstörung durch den Säureangriff im Magen geschützt ist und im Dünndarm rezeptorvermittelt in den Blutkreislauf eingeschleust wird. Die Entwicklung eines solchen Präparates befindet sich gegenwärtig noch in vorklinischen Versuchsstadien.
An Techniken zur intrapulmonalen Verabreichung von EPO arbeitet das australische Nanotechnologie-Unternehmen Nanotechnology Victoria. Hierzu wurde ein Inhalationsgerät entwickelt, das auf der Grundlage der akustischen Oberflächenwelle die Erzeugung nanopartikulärer Tröpfchen hochmolekularer Therapeutika ermöglicht.[93]
Das US-amerikanische Pharma-Unternehmen Zosano hat nach eigenen Angaben eine Mikroinjektionstechnologie entwickelt, die eine transdermale Verabreichung therapeutischer Proteine ermöglicht. Die Anwendung dieser Technik mit EPO befindet sich gegenwärtig in präklinischen Versuchsstadien.
Nebenwirkungen und Kontraindikationen
Da EPO-Rezeptoren auf der Oberfläche verschiedenster Tumorzellen gebildet werden, besteht grundlegend die Möglichkeit, dass die Verabreichung von EPO-Präparaten das Wachstum von Malignomen jeglicher Art stimulieren kann. Zwei kontrollierte klinische Studien, in denen Patienten mit verschiedenen Krebsarten einschließlich Kopf-Hals-Tumoren sowie Brustkrebs mit rekombinantem EPO behandelt wurden, zeigten einen ungeklärten Anstieg der Mortalität.[94][95] Gute Erfahrungen bestehen bei der Anämiebehandlung von Multiplem Myelom,[96] Non-Hodgkin-Lymphom und chronisch lymphatischer Leukämie.[97] Aufgrund der Nebenwirkungsweise ist bei hypertonischen Patienten besondere Vorsicht geboten. Missbrauch von Gesunden (etwa für Dopingzwecke) kann zu einem übermäßigen Anstieg des Hämatokritwertes führen. Dies ist mit dem Risiko lebensbedrohlicher Komplikationen des Herz-Kreislauf-Systems (Thromboserisiko durch Hämokonzentration bei Polyglobulie) verbunden.
Im Frühjahr 2007 veröffentlichte die US-amerikanische Arzneimittelzulassungsbehörde FDA einen Warnhinweis zur Anwendung erythropoese-stimulierender Substanzen infolge der Ergebnisse aus vier klinischen Studien,[98][99][100][101] bei denen es in bisher ungeprüften Behandlungsregimen zu lebensbedrohlichen Nebenwirkungen kam. Hämoglobinspiegel über 12 g/dL, die mittels EPO-Präparaten bei den betroffenen Patienten eingestellt wurden, führten zu einem signifikanten Anstieg der Mortalitätsrate. Aufgrund dessen verordnete die FDA die Abänderung der bisherigen Warnhinweise auf den Beipackzetteln der Präparate Aranesp, Epogen und Procrit.[102]
In einer weiteren Multicenter-Studie zum Einsatz von Epoetin β bei einer Anämie von Brustkrebspatienten, die sich einer Chemotherapie unterzogen, konnte dagegen kein Anstieg der Mortalität festgestellt werden.[103] In dieser Studie wurde sogar bereits dann EPO verabreicht, wenn der Hämoglobinspiegel unter 12,9 g/dL fiel. Offenbar ist die Sterblichkeit bei einer EPO-Therapie damit nicht unmittelbar abhängig vom eingestellten Hämoglobin-Level. Vielmehr nimmt sie bei Krebspatienten dann zu, wenn diese keine Chemotherapie erhalten.
Eine Meta-Analyse von 53 klinischen Studien mit fast 14.000 Patienten kam im Mai 2009 zu dem Schluss, dass die Sterblichkeit von Krebspatienten nach Verabreichung von EPO-Präparaten um den Faktor 1,17 erhöht ist gegenüber solchen, die sich keiner EPO-Therapie unterzogen haben. Bei Patienten, die gleichzeitig eine Chemotherapie bekamen, lag der Faktor bei 1,10.[104][105]
Das Risiko von Krebspatienten bei einer EPO-Therapie ist nicht allein auf eine Tumorprogression, die durch EPO hervorgerufen werden kann, beschränkt. So steigt auch das Risiko venöser Thromboembolien bei einer EPO-Therapie von Patienten mit soliden Tumoren signifikant an.[106] Die Deutsche Gesellschaft für Hämatologie und Onkologie empfiehlt daher, EPO in der Krebsmedizin ausschließlich bei erwachsenen Patienten mit Chemotherapie-induzierter Anämie, wenn sie Symptome haben, anzuwenden. Weiterhin sollte der Hämoglobinspiegel auf maximal 12 g/dl erhöht werden. Die Therapie soll beendet werden, sobald der Ziel-Hämoglobinwert von maximal 12 g/dl erreicht ist oder vier Wochen nach Beendigung der Chemotherapie.[107] Bei der Verordnung von Arzneimitteln mit „blutbildenden“ (Erythropoese-stimulierenden) Wirkstoffen (ESAs) zur Behandlung einer symptomatischen Blutarmut bei chronischer Niereninsuffizienz gelten in Deutschland verbindliche Therapiehinweise. Der entsprechende Beschluss des Gemeinsamen Bundesausschusses (G-BA) vom 23. Juni 2011 ist nach der Veröffentlichung im Bundesanzeiger am 22. September 2011 in Kraft getreten.[108]
Marktdaten für EPO-Präparate


Als Therapeutikum gehörte EPO bis 2004 zu den zehn weltweit erfolgreichsten Medikamenten überhaupt, unter den Biopharmazeutika ist es einer der herausragenden Blockbuster. Zwischenzeitlich entfielen mehr als 30 % der Umsätze mit therapeutischen rekombinanten Proteinen auf EPO-Präparate. Eprex/Procrit von Johnson & Johnson erzielte im Jahr 2004 3,6 Mrd. US-Dollar, Amgens Epogen 2,6 Mrd. US-Dollar und Roches NeoRecormon 1,7 Mrd. US-Dollar.[109] Aranesp, das erste zugelassene EPO-Präparat der nächsten Generation, hatte seit seiner Therapieeinführung anfänglich eine durchschnittliche Zuwachsrate von rund 800 Mio. US-Dollar pro Jahr. Im Jahr 2006 lag Amgens Umsatz mit Aranesp bei 4,1 Mrd. US-Dollar[110] und übertraf damit erstmals die Umsatzzahlen der bisherigen Standardpräparate. Bei den Nachfolgepräparaten DynEpo und Mircera wurde mit anfänglichen Umsatzraten von 300 Mio. US-Dollar bzw. 900 Mio. US-Dollar gerechnet. Diese Prognosen bestätigten sich jedoch nicht. Im Jahr 2010 lag der Umsatz mit Mircera bei 285 Mio. US-Dollar, DynEpo wurde bereits Ende 2008 vom Markt genommen. Weltweit erhielten im Jahr 1999 circa 350.000 Patienten rekombinantes EPO.[111] Da sich die Umsatzzahlen der EPO-Präparate zwischen 1999 und 2005 mehr als verdreifacht haben, dürfte die Zahl der mit EPO behandelten Patienten im entsprechenden Zeitraum proportional gestiegen sein.
2007 kam es im Zuge der Markteinführung der ersten Nachahmerpräparate in der Europäischen Union, der Entwicklung neuer EPO-Präparate (DynEpo, Mircera) und durch die Sicherheitsdebatte bei der Anwendung von EPO zur Behandlung von Tumoranämien erstmals zu einem Rückgang der Umsatzzahlen der Standardpräparate. So wurden im Jahr 2007 11,8 Milliarden US-Dollar mit den Standardpräparaten umgesetzt, was einem Rückgang gegenüber 2006 von 100 Millionen US-Dollar entspricht.[112] Im Jahr 2010 lag der Umsatz bei nunmehr nur noch 8,2 Mrd. US-Dollar und fiel damit auf den Stand von 2002 zurück.
In Deutschland wurden im Jahr 2007 rund 470 Millionen US-Dollar mit EPO-Präparaten umgesetzt. Dies entspricht (gemäß offiziell verfügbarer Daten) etwa 4,5 % des im selben Zeitraum weltweit erzielten Umsatzergebnisses. Die Einführung von Nachahmerpräparaten in Deutschland hat zu einem Preisrückgang geführt. Biosimilars bieten einen deutlichen Preisvorteil im Vergleich zum Festbetrag des Referenzproduktes. Zur Senkung der Arzneimittelkosten in Deutschland plante zum Beispiel die Kassenärztliche Vereinigung Berlin für das Jahr 2008, den Verordnungsanteil von EPO-Biosimilars auf 50 % zu steigern. Anfang 2009 lag der Marktanteil der EPO-Biosimilars bei inzwischen 53 %, während der Anteil der Originalpräparate und deren Re-Importe auf nunmehr 38 % bzw. 9 % zurückging. Schätzungen zufolge würden die Krankenkassen durch den Einsatz von Biosimilars bis 2020 insgesamt etwa acht Milliarden Euro einsparen können.[113] In China sind offiziell 14 unterschiedliche EPO-Präparate im Markt vertreten, deren Gesamtumsatz im Jahr 2006 bei rund 50 Millionen US-Dollar lag. In Indien betrug im Jahr 2006 der Umsatz mit EPO-Präparaten 22 Millionen US-Dollar, wobei die jährlichen Wachstumsraten bis dahin bei 20–30 % lagen.
EPO-Doping
Je mehr rote Blutkörperchen dem menschlichen Blutkreislauf zur Verfügung stehen, desto leistungsfähiger arbeitet der gesamte Organismus, weil den Zellen entsprechend viel Sauerstoff zur Verfügung steht. Aus diesem Grund wird EPO bereits etwa seit Ende der 1980er Jahre zum Zweck der Leistungssteigerung missbraucht. Vor allem Ausdauersportler profitieren von der Wirkung; durch den erhöhten Anteil an Erythrozyten im Blut steigt allerdings die Gefahr von Blutgerinnseln. EPO (und in der Folge auch alle weiteren Derivate wie zum Beispiel Darbepoetin) steht seit 1990 auf der Dopingliste der internationalen Anti-Doping-Organisation (WADA), der Einsatz ist also im Wettkampfsport verboten. Ein praktikables Nachweisverfahren von nicht körpereigenem EPO kann seit 2000 auch bei Urinproben angewandt werden. Da das Nachweisverfahren jedoch nur innerhalb der ersten vier Tage nach Verabreichung wirksam ist, die signifikante leistungssteigernde Wirkung zwar kontinuierlich abnimmt, jedoch bis zu 17 Tagen anhält, waren auch die Olympischen Spiele 2000 noch EPO-Spiele.[114]
Nach Berechnungen des italienischen Sportwissenschaftlers Prof. Alessandro Donati aus dem Jahr 2007 dopen sich weltweit 500.000 Menschen mit EPO. Gemäß der Untersuchungen Donatis übersteigt die jährlich produzierte Menge an EPO den tatsächlichen therapeutischen Bedarf um das Fünf- bis Sechsfache.[115]
Siehe auch
- Hämatokrit (Abkürzung: Hct, Hkt oder Hk), bezeichnet in der Medizin den Anteil der zellulären Bestandteile, zumeist rote Blutkörperchen (Erythrozyten), am Volumen des Blutes und ist ein Maß für die Zähflüssigkeit des Blutes (Viskosität). Normale Werte liegen bei Männern zwischen 40 und 53 Prozent.
- Bei der Blutsenkungsreaktion – abgekürzt BSR, BKS, Blutsenkung; auch: Erythrozytensedimentationsrate (ESR), handelt es sich um ein unspezifisches, einfaches Suchverfahren auf entzündliche Erkrankungen. Es werden die zellulären Bestandteile des Blutes mit der Länge der zellfreien Säule von Blutplasma verglichen.
Handelsnamen
- Epoetin alfa: Abseamed (D), Binocrit (D), Epoetin alfa HEXAL (D), Erypo (D)
- Epoetin beta: NeoRecormon (D)
- Epoetin zeta: Retacrit (D), Silapo (D)
- Epoetin theta: Biopoin (D), Eporatio (D)
Literatur
Übersichtsarbeiten
- Allan Jacob Erslev: Erythropoietin. In: New England Journal of Medicine. Band 324, 1991, S. 1339–1344.
Biosynthese und biologische Funktion
- P.C. Watkins et al.: Regional assignment of the erythropoietin gene to human chromosome region 7pter-q22. In: Cytogenet Cell Genet, 1986, 42, S. 214–218 PMID 2875851
- G.L. Wang, Semenza G.L.: General involvement of hypoxia-inducible factor 1 in transcriptional response of hypoxia. In: Proc Natl Acad Sci U S A, 1993, 90, S. 4304–4308. PMID 8387214
- S.S. Watowich: Activation of erythropoietin signaling by receptor dimerization. In: Int J Biochem Cell Biol, 1999, 31, S. 1075–1088. PMID 10498627
- T.R. Lappin et al.: EPO's alter ego: erythropoietin has multiple actions. In: Stem Cells, 2002, 20, S. 485–492. PMID 12456956
Strukturelle Eigenschaften
- M.A. Recny et al.: Structural characterization of natural human urinary and recombinant DNA-derived erythropoietin. In: J Biol Chem, 1987, 262, S. 17156–17163 PMID 3680293
- H Sasaki. et al.: Carbohydrate structure of erythropoietin expressed in chinese hamster ovary cells by a human erythropoietin cDNA. In: J Biol Chem, 1987, 262, S. 12059–12076. PMID 3624248
- N Kawasaki. et al.: Structural analysis of sulfated N-linked oligosaccharides in erythropoietin. In: Glycobiology, 2001, 11, S. 1043–1049. PMID 11805077
- A.W. Gross, H.F. Lodish: Cellular trafficking and degradation of erythropoietin and novel erythropoietin stimulating protein (NESP). In: J Biol Chem, 2006, 281, S. 2024–2032. PMID 16286456
Forschungsgeschichte
- D. Jourdanet: De l’anemie des altitudes et de l’anemie en general dans ses rapports avec la pression del l’atmosphere. Balliere, Paris 1863.
- P. Carnot, C. Deflandre: Sur l’activité hémopoiétique du sérum au cours de la régénération du sang. In: C R Acad Sci, 1906, 143, S. 384–386; doi:10.1161/01.RES.24.3.488.
- C. Gibelli: Über den Wert des Serums anämisch gemachten Tiere bei der Regeneration des Blutes. In: Naunyn-Schmiedeberg's Archives of Pharmacology, 1911, 65, S. 284–302 doi:10.1007/BF01841822.
- G. Sandor: Über die blutbildende Wirkung des Serums von Tieren, die in verdünnter Luft gehalten wurden. In: Z. Gesamte Exp. Med., 1932, 82, S. 633–646.
- E. Bonsdorff, E. Jalavisto: A humoral mechanism in anoxic erythrocytosis. In: Acta Physiol Scand, 1948, 16, S. 150–170; doi:10.1111/j.1748-1716.1948.tb00535.x.
- A. Erslev: Humoral regulation of red cell production. In: Blood, 1953, 8, S. 349–357. PMID 13032205
- Maluf NS: History of blood transfusion. In: J Hist Med Allied Sci, 1954, 9, S. 59–107. PMID 13118144
- L.O. Jacobson et al.: Role of the kidney in erythropoiesis. In: Nature, 1957, 179, S. 633–634. PMID 13418752
- T. Miyake, C.K. Kung, E. Goldwasser: Purification of human erythropoietin. In: J Biol Chem, 1977, 252, S. 5558–5564. PMID 18467
- Lee-Huang S.: Cloning and expression of human erythropoietin cDNA in Escherichia coli. In: Proc. Nat. Acad. Sci. USA, 1984, 81, S. 2708–2712. PMID 6371819
- F.K. Lin et al.: Cloning and expression of the human erythropoietin gene. In: Proc Natl Acad Sci USA, 1985, 82, S. 7580–7584. PMID 3865178
- K. Jacobs et al.: Isolation and characterization of genomic and cDNA clones of human erythropoietin. In: Nature, 1985, 313, S. 806–810. PMID 3838366
- Patent US4703008: DNA sequences encoding erythropoietin. Erfinder: F. K. Lin.
- W. Jelkmann: Erythropoietin after a century of research: younger than ever. In: Eur J Haematol, 2007, 78, S. 183–205. PMID 17253966
Indikation für die Therapie mit EPO
- R. Y. D. Fleming et al.: The effect of erythropoietin in normal healthy volunteers and pediatric patients with burn injuries. In: Surgery. Band 112, 1992, S. 424–432.
- S. Schreiber et al.: Recombinant erythropoietin for the treatment of anemia in inflammatory bowel disease. In: N Engl J Med, 1996, 334, S. 619–623. PMID 8592524
- G.D. Demetri et al.: Quality-of-life benefit in chemotherapy patients treated with epoietin alpha is independent of disease response or tumor type: results from a prospective community oncology study. In: J Clin Oncol, 1998, 10, S. 3412–3425. PMID 9779721
- K. Nishii et al.: Successful treatment of aplastic anemia with G-CSF and high dose erythropoietin. In: Leuk Lymphoma, 1998, 30, S. 211–214. PMID 9669693
- D.H. Henry: Experience with epoetin alfa and acquired immunodeficiency syndrome anemia. In: Semin Oncol, 1998, 25, S. 64–68. PMID 9671334
- F.R. Dunphry et al.: Erythropoietin reduces anemia and transfusions: a randomised trial with or without erythropoietin during chemotherapie. In: Cancer, 1999, 86, S. 1362–1367. PMID 10506726
- H. Feldmann et al.: Blood flow and oxygenation status of human tumors. Clinical investigations. In: Strahlenther Onkol, 1999, 175, S. 1–6. PMID 9951511
- C. Gasche et al.: Sequential treatment of anemia in ulcerative colitis with intravenous iron and erythropoietin. In: Digestion, 1999, 60, S. 262–267. PMID 10343140
- M. Cazzola: Haematopoietic growth factors in the treatment of myelodysplastic syndromes. In: Forum (Genova), 1999, 9, S. 49–57. PMID 10101210
- M. Milano, R. Collomp: Erythropoietin and neuroprotection: a therapeutic perspective. In: J Oncol Pharm Pract, 2005, 11, S. 145–149. PMID 16595066
- H. Ehrenreich et al.: Improvement of cognitive functions in chronic schizophrenic patients by recombinant human erythropoietin. In: Mol Psychiatry, 2007, 12(2), S. 206–220. PMID 17033631
- M. Krebs et al.: Neuroprotective agents in schizophrenia and affective disorders. In: Expert Opin Pharmacother, 2006, 7, S. 837–848. PMID 16634707
EPO-Präparate der ersten Generation
- L. Ehrlich: Use of EPOGEN for treatment of anemia associated with chronic renal failure. In: Crit Care Nurs Clin North, 1990, Am 2, S. 101–113. PMID 2357306
- Patent US5441868: Production of recombinant erythropoietin. Erfinder: F. K. Lin.
- P.L. Storring et al.: Epoetin alfa and beta differ in their erythropoietin isoform composition and biological properties. In: Br J Haematol, 1998, 100, S. 79–89. PMID 9450795
- V. Skibeli et al.: Sugar profiling proves that human serum erythropoietin differs from recombinant human erythropoietin. In: Blood, 2001, 98, S. 3626–3634. PMID 11739166
- A. Bren et al.: A comparison between epoetin omega and epoetin alfa in the correction of anemia in hemodialysis patients: a prospective, controlled crossover study. In: Artif Organs, 2002, 26, S. 91–97. PMID 11879235
- R. Deicher, W.H. Horl: Differentiating factors between erythropoiesis-stimulating agents: a guide to selection for anaemia of chronic kidney disease. In: Drugs, 2004, 64, S. 499–509. PMID 14977387
- J. Glaspy, Y. Beguin: Anaemia management strategies: optimising treatment using epoetin beta (NeoRecormon). In: Oncology, 2005, 69 Suppl. 2, S. 8–16. PMID 16244505
- T. Littlewood: Epoetin alfa (Eprex) and quality of life. In: Curr Med Res Opin., 2005, 21 Suppl 2: S1-S2. PMID 15969857
EPO-Präparate der nächsten Generation
- F.C. Wrighton et al.: Small peptides as potent mimetics of the protein hormone erythropoietin. In: Science, 1996, 273, S. 458–464. PMID 8662529
- A. Battaglia et al.: The fusion protein MEN 11303 (granolocyte-macrophage colony stimulating factor/erythropoietin) acts as a potent inducer of erythropoiesis. In: Exp Hematol, 2000, 28, S. 490–498. PMID 10812238
- J.Q. Hudson, R.M. Sameri: Darbepoetin alfa, a new therapy for the management of anemia of chronic kidney disease. In: Pharmacotherapy, 2002, 22, S. 141S-149S. PMID 12222584
- G.G. Kochendoerfer et al.: Design and chemical synthesis of homogeneous polymer-modified erythropoiesis protein. In: Science, 2003, 299, S. 884–887. PMID 12574628
- A.J. Bitonti et al.: Delivery of an Erythropoietin-Fc Fusion Protein by Inhalation in Humans through an Immunoglobulin Transport Pathway. In: J Aerosol Med, 2004, 18, S. 294–303. PMID 16181004
- I.C. Macdougall: CERA (Continuous Erythropoietin Receptor Activator): a new erythropoiesis-stimulating agent for the treatment of anemia. In: Curr Hematol Rep, 2005, 4, S. 436–440. PMID 16232379
- S.Y. Chen et al.: Synthetic erythropoietic proteins: tuning biological performance by site-specific polymer attachment. In: Chem Biol, 2005, 12, S. 371–383. PMID 15797221
- F. Fiordaliso et al. (2005),A nonerythropoietic derivative of erythropoietin protects the myocardium from ischemia-reperfusion injury Proc Natl Acad Sci, 102, S. 2046–2051. PMID 15671158
- S.R. Hamilton et al.: Humanization of yeast to produce complex terminally sialylated glycoproteins. In: Science, 2006, 313, S. 1441–1443. PMID 16960007
- Österborg A.C. et al.: A novel erythropoiesis-stimulating agent (AMG114) with 131-hour half-life effectively treats chemotherapy-induced anemia when administered as 200 mcg every 3 weeks. In: J Clin Oncol, 2006, 24, No. 18S, S. 8626. PMID 16982323
- Q. Fan et al.: Preclinical evaluation of Hematide, a novel erythropoiesis stimulating agent, for the treatment of anemia. In: Exp Hematol, 2006, 34, S. 1303–1311. PMID 16982323
- T.R. Coleman et al.: Cytoprotective doses of erythropoietin or carbamylated erythropoietin have markedly different procoagulant and vasoactive activities. In: Proc Natl Acad Sci USA, 2006, 103, S. 5965–5970. PMID 16585502
Nachahmerpräparate (Biosimilars) / Der Fall „Eprex“
- S. Louët: Lessons from Eprex for biogeneric firms. In: Nature Biotechnology, 2003, 21 (9), S. 956–957. PMID 12949539
- H. Schellekens: Biosimilar epoetins: how similar are they? In: EJHP Practice, 2004, 3, S. 243–247. PMID 16006274
- K. Boven et al.: The increased incidence of pure red cell aplasia with an Eprex formulation in uncoated rubber stopper syringes. In: Kidney International, 2005, 67, S. 2346–2353. PMID 15882278
- S.K. Niazi: Handbook of Biogeneric Therapeutic Proteins. 1. Auflage. CRC Press, 2005, ISBN 0-8493-2991-4
- V. Zylka-Menhorn, M.E. Tippmann: Biopharmazeutika sind „unnachahmlich“. In: Deutsches Ärzteblatt, 2006, Jg. 103, Heft 6: A311-A314.
Darreichungsformen
- K.F. Pistel et al.: Biodegradable recombinant human erythropoietin loaded microspheres prepared from linear and star-branched block copolymers: (…). In: J Control Release, 1999, 59, S. 309–325. PMID 10332063
- Patent US5674534: Composition for sustained release of non-aggregated erythropoietin. Erfinder: S. E. Zale.
EPO-Doping
- J. Scott, GC Phillips: Erythropoietin in sports: a new look at an old problem. In: Curr Sports Med Rep, 2005, 4, S. 224–226. PMID 16004833
- Diamanti-Kandarakis E. et al.: Erythropoietin abuse and erythropoietin gene doping: detection strategies in the genomic era. In: Sports Medicine, 2005, 35, S. 831–840. PMID 16180943
- W. Jelkmann: Novel erythropoietic agents: A threat to sportsmanship. (PDF; 490 kB) In: Medicina Sportiva, 2007, 11, S. 32–42.
- K. Sharpe et al.: A third generation approach to detect erythropoietin abuse in athletes. In: Haematologica, 2006, 91, S. 356–363. PMID 16503554
Nachweisverfahren
- F. Lasne, J. de Ceaurriz: Recombinant erythropoietin in urine. In: Nature, 2000, 405, S. 635. PMID 10864311
- F. Lasne: Double-blotting: a solution to the problem of nonspecific binding of secondary antibodies in immunoblotting procedures. In: J Immunol Methods, 2003, 276, S. 223–226. PMID 12738375
- M. Beullens et al.: False-positive detection of recombinant human erythropoietin in urine following strenuous physical exercise. In: Blood, 2006, 107, S. 4711–4713. PMID 16493001
- F. Lasne: No doubt about the validity of the urine test for detection of recombinant human erythropoietin. In: Blood, 2006, 108, S. 1778–1779. PMID 16926299
- W. Jelkmann: Erythropoiesis stimulating agents and techniques: a challenge for doping analysts. In: Curr Med Chem, 2009, 16(10), S. 1236–1247. PMID 19355882
- W. Jelkmann, C Lundby: Blood doping and its detection. In: Blood, 2011, 118(9), S. 2395–404. doi:10.1182/blood-2011-02-303271, PMID 21652677.
Weblinks
- EPO-Doping im Radsport auf cycling4fans.de
- EPO – Risiken und Nebenwirkungen; unabhängiges Informationsangebot der Nationalen Anti Doping Agentur (NADA)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Epoetin
Einzelnachweise
- Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf: Nephrologie – Pathophysiologie – Klinik – Nierenersatzverfahren. Thieme Verlag, Stuttgart 2015, ISBN 978-3-13-700206-2, S. 409
- E. Bodó et al.: Human hair follicles are an extrarenal source and a nonhematopoietic target of erythropoietin. In: FASEB J., 2007, 21, S. 3346–3354. PMID 17540710.
- R.N. Foley: Erythropoietin: physiology and molecular mechanisms. In: Heart Fail Rev., 2008, 13, S. 405–414. PMID 18236154.
- B. Adamcio et al.: Erythropoietin enhances hippocampal long-term potentiation and memory. In: BMC Biol., 2008 Sep 9, 6(1), S. 37. PMID 18782446.
- D. Burger, F. Xiang, L. Hammoud, X. Lu, Q. Feng: Role of heme oxygenase-1 in the cardioprotective effects of erythropoietin during myocardial ischemia and reperfusion. In: Am. J. Physiol. Heart Circ. Physiol. 296, 2009, S. H84–H93 PMID 18996987.
- UniProt P01588
- B. Agoram, K. Aoki, S. Doshi, C. Gegg, G. Jang, G. Molineux, L. Narhi, S. Elliott: Investigation of the effects of altered receptor binding activity on the clearance of erythropoiesis-stimulating proteins: Nonerythropoietin receptor-mediated pathways may play a major role. In: J Pharm Sci 98, 2009, S. 2198–2211 PMID 18837016.
- L.O. Narhi et al.: The effect of carbohydrate on the structure and stability of erythropoietin. In: J. Biol. Chem., 1991, 266, S. 23022–23026 PMID 1744097.
- M. Brines et al.: Nonerythropoietic, tissue-protective peptides derived from the tertiary structure of erythropoietin. In: Proc. Natl. Acad. Sci. USA, 2008, 105, S. 10925–10930. PMID 18676614.
- Fu-Kuen Lin: DNA sequences encoding erythropoietin. US-Patent 4,703,008 (1985).
- S. Lee-Huang: Cloning and expression of human erythropoietin cDNA in Escherichia coli. In: Proc Natl Acad Sci USA, 1984, 81, S. 2708–2712. PMID 6371819.
- K. Jacobs et al.: Isolation and characterization of genomic and cDNA clones of human erythropoietin. In: Nature, 1985, 313, S. 806–810. PMID 3838366.
- E. Lacson, J. Rogus, M. Teng, J. M. Lazarus, R. M. Hakim: The association of race with erythropoietin dose in patients on long-term hemodialysis. In: Am. J. Kidney Dis. 52, 2008, S. 1104–1114 PMID 18824287.
- W. C. Winkelmayer, J. Liu, M. A. Brookhart: Altitude and all-cause mortality in incident dialysis patients. In: JAMA 301, 2009, S. 508–512 PMID 19190315.
- M. Gallieni: Iron in the treatment of anemia in dialysis patients: an important support to erythropoietin. In: Int J Artif Organs 21, 1998, S. 681–686 PMID 9894741.
- G. Amendola, R. Di Concilio, G. D’Urzo, P. Danise, G. Parisi, F. della Ragione, F. Rossi, B. Nobili, S. Perrotta: Erythropoietin treatment can prevent blood transfusion in infantile pyknocytosis. In: Br. J. Haematol., 2008 143,, S. 593–595 PMID 18783402.
- H. Ehrenreich, K. Weissenborn, H. Prange, D. Schneider, C. Weimar, K. Wartenberg, P. D. Schellinger, M. Bohn, H. Becker, M. Wegrzyn, P. Jähnig, M. Herrmann, M. Knauth, M. Bähr, W. Heide, A. Wagner, S. Schwab, H. Reichmann, G. Schwendemann, R. Dengler, A. Kastrup, C. Bartels: Recombinant human erythropoietin in the treatment of acute ischemic stroke. In: Stroke, 40, 2009, S. e647–e656 PMID 19834012.
- H. Ehrenreich et al.: Exploring recombinant human erythropoietin in chronic progressive multiple sclerosis. In: Brain, 2007,;130(Pt 10), S. 2577–2588. PMID 17728357.
- S. Boesch, B. Sturm, S. Hering, H. Goldenberg, W. Poewe, B. Scheiber-Mojdehkar: Friedreich’s ataxia: clinical pilot trial with recombinant human erythropoietin. In: Ann. Neurol., 2007, 62, S. 521–524; PMID 17702040.
- J.F. Grunfeld et al.: Erythropoietin delays disease onset in an amyotrophic lateral sclerosis model. In: Experimental Neurology, 2007, 204, S. 260–263 PMID 17174305.
- M.G. Lykissas et al.: Axonal regeneration stimulated by erythropoietin: An experimental study in rats. In: J Neurosci Methods, 2007, 164, S. 107–115. PMID 17532473.
- H. Ehrenreich et al.: Improvement of cognitive functions in chronic schizophrenic patients by recombinant human erythropoietin. In: Mol Psychiatry, 2006, 12, S. 206–220; PMID 17033631.
- K. Miskowiak, B. Inkster, S. Selvaraj, R. Wise, G. M. Goodwin, C. J. Harmer: Erythropoietin improves mood and modulates the cognitive and neural processing of emotion 3 days post administration. In: Neuropsychopharmacology, 33, 2008, S. 611–618 PMID 17473836.
- M. Joyeux-Faure: Cellular protection by erythropoietin: new therapeutic implications? In: J. Pharmacol. Exp. Ther. 323, 2007, S. 759–762; PMID 17717190 (Review).
- M.A. Bogoyevitch: An update on the cardiac effects of erythropoietin cardioprotection by erythropoietin and the lessons learnt from studies in neuroprotection. In: Cardiovasc. Res, 2004, 63, S. 208–216. PMID 15249178.
- D. Mihov et al.: Erythropoietin protects from reperfusion-induced myocardial injury by enhancing coronary endothelial nitric oxide production. In: Eur J Cardiothorac Surg., 2009, 35(5), S. 839–846. PMID 19237290.
- EPO fails to help heart attack victims in study.
- Darbepoetin-alfa ohne Nutzen bei Herzinsuffizienz. In: Deutsches Ärzteblatt, 18. Januar 2013; abgerufen am 19. Januar 2013.
- H. Sorg, C. Krueger, T. Schulz, M. D. Menger, F. Schmitz, B. Vollmar: Effects of erythropoietin in skin wound healing are dose related. In: FASEB J., 2009, 23, S. 3049–3058 PMID 19403513.
- EPO in der Wundtherapie: MHH testet innovatives Heilungskonzept ohne Nebenwirkungen. Medizinische Hochschule Hannover (MHH), Pressemitteilung, 24. März 2010.
- Achim-Peter Neubauer, Wolfgang Voss, Michael Wachtendorf, Tanja Jungmann: Erythropoietin Improves Neurodevelopmental Outcome of Extremely Preterm Infants. In: Annals of Neurology. Band 67, Nr. 5, Mai 2010, S. 657–666, doi:10.1002/ana.21977.
- Studie in Göttingen: Doping gegen Covid-19. In: mdr.de. Abgerufen am 7. Juli 2020.
- International nonproprietary names (INN) for biologicals and biotechnological substances (PDF; 179 KB).
- W. Jelkmann: Efficacy of recombinant erythropoietins: is there unity of international units? In: Nephrol Dial Transplant., 2009, 24, S. 1366–1368. PMID 19225013.
- P.M. Cotes, D.R. Bangham: The international reference preparation of erythropoietin. In: Bull World Health Organ, 1966, 35, S. 751–760. PMID 5297809.
- L. Annable et al.: The second international reference preparation of erythropoietin, human, urinary, for bioassay. In: Bull World Health Organ, 1972, 47, S. 99–112. PMID 4538911.
- P.L. Storring et al.: The international standard for recombinant DNA-derived erythropoietin: collaborative study of four recombinant DNA-derived erythropoietins and two highly purified human urinary erythropoietins. In: J Endocrinol., 1992, 134, S. 459–484. PMID 1402553.
- M.E. Behr-Gross: Collaborative study for the establishment of erythropoietin BRP batch 3. In: Pharmeuropa Bio., 2007(1), S. 49–66. PMID 18413137.
- Missing the $20 billion biogeneric boom. CNNMoney.com, 15. August 2006
- Kirin, Sankyo to terminate joint marketing of renal anemia drug ESPO (…) by next march. (Memento vom 28. September 2007 im Internet Archive).
- I.C. Macdougall: Novel erythropoiesis-stimulating agents: a new era in anemia management. In: Clin J Am Soc Nephrol., 2008, 3(1), S. 200–207. PMID 18077782.
- CERA: Andersartige Wechselwirkung mit dem Erythropoietin-Rezeptor als Epoetin.
- Europäischer öffentlicher Beurteilungsbericht für Mircera.
- Fachinformation Mircera (PDF; 1,3 MB) Juni 2006.
- Cepo statt Epo. FAZ.net, 8. Juli 2004.
- F. Fiordaliso et al.: A nonerythropoietic derivative of erythropoietin protects the myocardium from ischemia-reperfusion injury. In: Proc Natl Acad Sci, 2005, 102, S. 2046–2051. PMID 15671158.
- F. Fahres et al.: Development of a long-acting erythropoietin by fusing the carboxyl-terminal peptide of human chorionic gonadotropin beta-subunit to the coding sequence of human erythropoietin. In: Endocrinology, 2007, 148, S. 5081–5087; PMID 17641000.
- Akquisition Shire Pharmaceuticals vom 21. April 2005 (Memento vom 31. Juli 2012 im Webarchiv archive.today).
- New treatment a success for anaemia associated with chronic kidney disease (Memento vom 28. September 2007 im Internet Archive; PDF).
- Neue, von menschlichen Zellen produzierte Behandlung für die renale Anämie … (Memento vom 27. September 2007 im Internet Archive) Pressemitteilung, 15. März 2007.
- Quartalsbericht der Firma Shire und Mitteilung des Vorstandsvorsitzenden Angus Russel vom 31. Juli 2008 (Memento vom 5. Januar 2011 im Internet Archive).
- D. Kodama, D. Nishimiya, K. Iwata, K. Yamaguchi, K. Yoshida, Y. Kawabe, M. Motono, H. Watanabe, T. Yamashita, K. Nishijima, M. Kamihira, S. Iijima: Production of human erythropoietin by chimeric chickens. In: Biochem. Biophys. Res. Commun. 367, 2008, S. 834–839 PMID 18201556.
- Roche licenses Synthetic Erythropoiesis Protein from Gryphon Sciences. (Memento vom 20. März 2006 im Internet Archive).
- Affymax and Takeda Announce a Nationwide Voluntary Recall of All Lots of OMONTYS® (peginesatide) Injection (Memento vom 18. April 2015 im Internet Archive), Mitteilung auf der Homepage von Affymax Inc. vom 23. Februar 2013 (abgerufen am 27. Februar 2013).
- Poster der ProMetic Life Sciences Inc. zum Präparat PBI-1402.
- Baesweiler: Biotech: Aplagen im Insolvenzverfahren. In: aachener-nachrichten.de. 8. April 2010, abgerufen am 2. November 2018.
- Z. Liu, V. S. Stoll, P. J. Devries, C. G. Jakob, N. Xie, R. L. Simmer, S. E. Lacy, D. A. Egan, J. E. Harlan, R. R. Lesniewski, E. B. Reilly: A potent erythropoietin-mimicking human antibody interacts through a novel binding site. In: Blood 110, 2007, S. 2408–2413 PMID 17620453.
- S.A. Qureshi et al.: Mimicry of erythropoietin by a nonpeptide molecule. In: Proc Natl Acad Sci USA, 1999, 96, S. 12156–12161. PMID 10518592.
- E. Bouman-Thio et al.: A phase I, single and fractionated, ascending-dose study evaluating the safety, pharmacokinetics, pharmacodynamics, and immunogenicity of an erythropoietin mimetic antibody fusion protein (CNTO 528) in healthy male subjects. In: J Clin Pharmacol., 2008, 48(10), S. 1197–1207. PMID 18812609.
- Repoxygen haben wir im Kühlfach. In: FAZ, 31. Januar 2006.
- Die „Biopumpe“ von Medgenics.
- S. Akagi et al.: The critical role of SRC homology domain 2-containing tyrosine phosphatase-1 in recombinant human erythropoietin hyporesponsive anemia in chronic hemodialysis patients. In: J Am Soc Nephrol., 2004, 15, S. 3215–3224. PMID 15579525.
- A. Rinna, H.J. Forman: SHP-1 inhibition by 4-hydroxynonenal activates Jun N-terminal kinase and glutamate cysteine ligase. In: Am J Respir Cell Mol Biol., 2008, 39, S. 97–104. PMID 18276794.
- Astellas Acquires the Rights to FG-2216 and FG-4592(…)for Europe and Other Regions (…) (Memento vom 7. August 2008 im Internet Archive) Pressemitteilung, 28. April 2006.
- Akebia Announces Initiation of Phase 1 Clinical Study of AKB-6548 Pressemitteilung vom 15. September 2009.
- CrystalGenomics had entered into oral hypoxia therapeutics development. (Memento vom 8. Oktober 2007 im Internet Archive) Pressemitteilung, 19. September 2006.
- Y. Nakano et al.: Oral administration of K-11706 inhibits GATA binding activity, enhances hypoxia-inducible factor 1 binding activity, and restores indicators in an in vivo mouse model of anemia of chronic disease. In: Blood, 2004, 104, S. 4300–4307 PMID 15328158.
- A. Angelillo-Scherrer, L. Burnier, D. Lambrechts, R. J. Fish, M. Tjwa, S. Plaisance, R. Sugamele, M. DeMol, E. Martinez-Soria, P. H. Maxwell, G. Lemke, S. P. Goff, G. K. Matsushima, H. S. Earp, M. Chanson, D. Collen, S. Izui, M. Schapira, E. M. Conway, P. Carmeliet: Role of Gas6 in erythropoiesis and anemia in mice. In: J. Clin. Invest. 118, 2008, S. 583–596 PMID 18188450 PMC 217618 (freier Volltext).
- Leitlinien für ähnliche biologisch-medizinische Produkte (Memento vom 21. September 2008 im Internet Archive) (PDF; 105 KB).
- Leitlinien für ähnliche biologisch-medizinische Produkte, die rekombinantes Erythropoetin enthalten (Memento vom 18. Juli 2006 im Internet Archive).
- PlasmaSelect (Memento vom 22. Februar 2014 im Internet Archive).
- Biggest Pharmaceutical Plant to Open Soon. (Memento vom 17. Februar 2007 im Internet Archive).
- generisches rekombinantes EPO von Cristália / Blausigel (Memento vom 4. März 2005 im Internet Archive).
- Pliva-Pressemitteilung vom 22. Februar 2006 (Memento vom 15. Dezember 2007 im Internet Archive).
- Nicholas Buhay: WARNING LETTER 320-06-02. Public Health Service, Food and Drug Administration, 28. April 2006, abgerufen am 10. Juli 2009 (englisch).
- Stada-Pressemitteilung vom 30. März 2006 (Memento vom 24. Mai 2006 im Internet Archive).
- Zulassungsunterlagen für Erythropoetin-Biosimilar bei EMEA eingereicht. (Memento vom 12. April 2013 im Webarchiv archive.today) STADA.
- Bibitec schließt erste Wirkstoffentwicklung für ein Biosimilar ab. (Memento vom 4. Oktober 2009 im Internet Archive) NewLab BioQuality AG, Pressemitteilung.
- STADA ordnet Biosimilar-Projekte neu – Epo-zeta-Vertriebsrechte an Hospira. (Memento vom 12. April 2013 im Webarchiv archive.today) Pressemitteilung, 20. November 2006.
- Committee for Medicinal Products for Human Use Summary of Positive Opinion for Silapo.
- STADA erhält für Erythropoetin-zeta Zulassung – Einführung im 1. Quartal 2008 (Memento vom 17. Juli 2011 im Internet Archive) (PDF; 39 KB).
- Seth E. Cockrum: FDA Approves Retacrit as a Biosimilar to Epogen®. Mitteilung auf lexicology.com vom 15. Mai 2018 (englisch, abgerufen am 15. Mai 2018).
- Pressemitteilung durch Therapeutic Proteins vom 12. Mai 2006 (Memento vom 4. Oktober 2009 im Internet Archive).
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Binocrit.
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Epoetin Alfa Hexal.
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Abseamed.
- Kurz Informiert, Dtsch Arztebl 2010; 107(17)
- S. S. Park, J. Park, J. Ko, L. Chen, D. Meriage, J. Crouse-Zeineddini, W. Wong, B. A. Kerwin: Biochemical assessment of erythropoietin products from Asia versus US Epoetin alfa manufactured by Amgen. In: J Pharm Sci 98, 2009, S. 1688–1699 PMID 18781649.
- Biosimilar EPOs show the same or better quality. Generics and Biosimilars Initiative, 12. November 2010
- K.F.Pistel et al.: Biodegradable recombinant human erythropoietin loaded microspheres prepared from linear and star-branched block copolymers: (…). In: J Control Release, 1999, 59, S. 309–325. PMID 10332063.
- S.E. Zale: Composition for sustained release of non-aggregated erythropoietin, US-Patent 5,674,534 (1999).
- L. Longhu et al.: Sustained release of erythropoietin using biodegradable gelatin hydrogel microspheres persistently improves lower leg ischemia. In: J Am Coll Cardiol, 2009, 53, S. 2378–2388.
- “NanoVentures Australia Reaches Important Milestone in Development of Pulmonary Drug Delivery Technology” (Memento vom 21. Juli 2012 im Webarchiv archive.today) vom 31. Mai 2009.
- M. Henke et al.: Erythropoietin to treat head and neck cancer patients with anaemia undergoing radiotherapy: randomised, double-blind, placebo-controlled trial. In: The Lancet, 2003, 362, S. 1255–1260. PMID 14575968.
- B. Leyland-Jones et al.: Maintaining normal hemoglobin levels with epoetin alfa in mainly nonanemic patients with metastatic breast cancer receiving first-line chemotherapy: a survival studyl. In: Journal of Clinical Oncology, 2005, 23, S. 5960–5972. PMID 16087945.
- R. Baz et al.: Recombinant human erythropoietin is associated with increased overall survival in patients with multiple myeloma. In: Acta Haematologica, 2007, 117, S. 162–167. PMID 17148935.
- J.F. San Miguel, R. García-Sanz: Recombinant human erythropoietin in the anaemia of multiple myeloma and non-Hodgkin’s lymphoma. In: Medical Oncology, 1998, 15, Suppl 1, S. S29–S34. PMID 9785334.
- J.R. Wright et al.: Randomized, double-blind, placebo-controlled trial of erythropoietin in non-small-cell lung cancer with disease-related anemia. In: Journal of Clinical Oncology, 2007, 25, S. 1027–1032. PMID 17312332.
- Amgen Comments on Phase 3 Study in Cancer Patients with Anemia Not Due to Concurrent Chemotherapy. (Memento vom 16. Mai 2008 im Internet Archive; PDF).
- Study of the importance of Novel Erythropoiesis Stimulating Protein (Aranesp®) for the effect of radiotherapy in patients with primary squamous cell carcinoma of the head and neck.
- Roche Halts Enrollment in Study of Biologic Drug Cera Due to Safety Concerns. (Memento vom 7. Juli 2007 im Internet Archive).
- FDA-Alert on Erythropoiesis Stimulating Agents (ESA). (Memento vom 13. November 2007 im Internet Archive; PDF).
- M. Aapro et al.: Effect of once-weekly epoetin beta on survival in patients with metastatic breast cancer receiving anthracycline- and/or taxane-based chemotherapy: results of the Breast Cancer-Anemia and the Value of Erythropoietin (BRAVE) study. In: Journal of Clinical Oncology, 2008, 26, S. 592–598. PMID 18235117.
- Sina Vogt: Nebenwirkung Sterberisiko: Medikament zur Blutbildung in der Kritik. Uniklinik Köln, Pressemitteilung vom 11. Mai 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- J. Bohlius et al.: Recombinant human erythropoiesis-stimulating agents and mortality in patients with cancer: a meta-analysis of randomised trials. In: The Lancet, 2009, 373(9674), S. 1532–1542. PMID 19410717.
- C. L. Bennet et al.: Venous Thromboembolism and Mortality Associated With Recombinant Erythropoietin and Darbepoetin Administration for the Treatment of Cancer-Associated Anemia. In: JAMA, 2008, 299, S. 914–924.
- Behandlung mit hämatopoetischen Wachstumsfaktoren. (PDF) Stand: November 2008, Deutsche Gesellschaft für Hämatologie und Onkologie
- Erythropoese-stimulierende Wirkstoffe bei Niereninsuffizienz zurückhaltend verordnen. Pressemitteilung, Therapiehinweis, Gemeinsamer Bundesausschuss, 22. September 2011
- S. Ritter: Erythropoietin. In: Chemical & Engineering News, 2005, Nr. 83(25).
- J.L. Fox: FDA likely to further restrict erythropoietin use for cancer patients. In: Nature Biotechnology, 2007, 25, S. 607–608. PMID 17557084.
- Erythropoietin: Muntermacher und Lebensretter. (Memento vom 7. September 2005 im Internet Archive)
- A Comprehensive Report of Erythropoietins. (Memento vom 22. Februar 2014 im Internet Archive).
- B Häussler: Artikel. IGES Institut, 2008.
- Arnd Krüger: EPO-Spiele auch in Sydney? (Memento des Originals vom 31. Dezember 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Alessandro Donati: World Traffic in Doping Substances (PDF) WADA, Februar 2007, (PDF, 542 KB).
- Rote Liste online, Stand: September 2009.