Silber(I)-oxid
Silber(I)-oxid (Ag2O) ist eine chemische Verbindung aus der Gruppe der Oxide.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-oxid.png.webp) | ||||||||||||||||||||||
| _ Ag+ _ O2− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Silber(I)-oxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | Ag2O | |||||||||||||||||||||
| Kurzbeschreibung |
schweres, fast schwarzes, samtartiges Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 231,74 g·mol−1[3] | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
7,2 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
0,01 mg·m−3[3] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−31,1 kJ/mol[4] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Silber(I)-oxid ist das Reaktionsprodukt des Edelmetalls Silber mit Sauerstoff.
Zur Gewinnung gießt man Silbernitrat-Lösung zu Natronlauge oder Kalilauge. Silberoxid fällt dann im Alkalischen als brauner Niederschlag aus:
Eigenschaften
Silber(I)-oxid ist ein braunes Pulver, das bei Einwirkung von Sonnenlicht nachdunkelt. Feuchtes Silber(I)-oxid ist sehr wenig lichtempfindlich und zersetzt sich beim Trocknen etwas. Es besitzt eine Kristallstruktur vom Cu2O-Typ mit der Raumgruppe Pn3m (Raumgruppen-Nr. 224) (a = 475,2 pm) und eine Bildungsenthalpie von −30,5 kJ/mol.[5] Aufschlämmungen von Silberoxid in Wasser reagieren deutlich alkalisch, da in Umkehrung der obigen Reaktion Silber- und Hydroxidionen gebildet werden[6].
In Umkehrung der Synthesereaktion wird Silber(I)-oxid beim Erhitzen wieder in die Elemente Silber und Sauerstoff zersetzt (Thermolyse).
An der Luft reagiert Silber(I)-oxid mit Kohlenstoffdioxid zu Silbercarbonat:
Verwendung
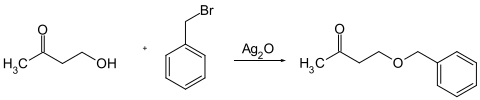
In der präparativen organischen Chemie wird Silber(I)-oxid in einer Variante der Williamson-Ethersynthese verwendet.[7]
Silber(I)-oxid ist in Wärmeleitpaste zur Weiterleitung der Prozessorwärme an den Kühlkörpern im Computer enthalten, da es eine hohe Wärmeleitfähigkeit besitzt.
Silber(I)-oxid ist Bestandteil der Silberoxid-Zink-Batterie, die in Armbanduhren und anderen Kleingeräten eingesetzt wird.
Einzelnachweise
- Eintrag zu SILVER OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. Mai 2020.
- Eintrag zu Silberoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. September 2014.
- Eintrag zu Silber(I)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 998.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Masato Tanabe and Richard H. Peters: (R,S)-Mevalonolactone-2-13C In: Organic Syntheses. 60, 1981, S. 92, doi:10.15227/orgsyn.060.0092; Coll. Vol. 7, 1990, S. 386 (PDF).


