Bariumsulfat
Bariumsulfat (BaSO4) ist das Barium-Salz der Schwefelsäure.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
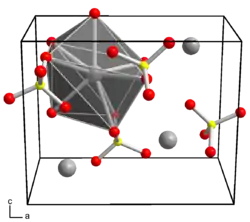 | ||||||||||||||||||||||
| _ Ba2+ _ S6+ _ O2− | ||||||||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||||||||||||||
| Gitterparameter |
a = 8,884 Å, b = 5,456 Å und c = 7,157 Å | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bariumsulfat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | BaSO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, rhombische Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 233,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
4,5 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (2,2 mg·l−1 bei 18 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
| |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1465,2 kJ·mol−1[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
In der Natur tritt Bariumsulfat im Mineral Baryt (Schwerspat) auf, das als Hauptrohstoff zur Herstellung anderer Barium-Verbindungen dient. In manchen Algen, wie z. B. den Zellen von Closterium kommt Bariumsulfat in der normalen orthorhombischen Baryt-Form vor. Im Ciliaten Loxodes konnte nachgewiesen werden, dass die Bariumsulfat-Kristalle aufgrund ihrer hohen Dichte als Schwerkraftrezeptoren dienen.[6]
Eigenschaften
Barium (Ordnungszahl 56 im PSE) ist abgeleitet vom griechischen βαρύς /barys/ „schwer“. Das natürliche Mineral hat seinen Namen aus dieser Wortbedeutung. Aufgrund der hohen Elektronendichte kann Bariumsulfat als positives Röntgenkontrastmittel verwendet werden. Bariumsulfat ist ein weißes Pulver, das in Wasser, Säuren und Laugen praktisch unlöslich ist, während es sich in heißer konzentrierter Schwefelsäure bis zu 12 % lösen lässt. Bei hohen Temperaturen (> 1400 °C) zersetzt sich Bariumsulfat zu Bariumoxid, Schwefeldioxid und Sauerstoff:
Auf Grund seiner Schwerlöslichkeit ist das Mineral im Gegensatz zu allen anderen Bariumverbindungen kein Gefahrstoff.
Es kristallisiert orthorhombisch, Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 8,884 Å, b = 5,456 Å und c = 7,157 Å.[7]
Gewinnung und Darstellung
Bariumsulfat wird hauptsächlich durch Abbau des Minerals Baryt gewonnen.[2] Die beiden größten Lieferländer sind die Volksrepublik China und Indien.[8] 2019 betrug die geschätzte weltweite Fördermenge 9,5 Millionen Tonnen.[8]
| Land | 2018[8] | 2019, geschätzt[8] |
|---|---|---|
| China | 2.900 | 2.900 |
| Indien | 2.390 | 2.200 |
| Iran | 490 | 490 |
| Kasachstan | 620 | 620 |
| Laos | 90 | 420 |
| Marokko | 940 | 1.100 |
| Mexiko | 380 | 400 |
| Pakistan | 110 | 110 |
| Russland | 163 | 160 |
| Türkei | 245 | 250 |
| Vereinigte Staaten von Amerika | 366 | 390 |
| restliche Länder | 482 | 480 |
| Gesamt | 9.180 | 9.500 |
Das gewonnene Erz wird gewaschen, gebrochen und gemahlen und das Bariumsulfat durch Sedimentation von der Gangart getrennt. Durch weitere physikalische Bearbeitung (Flotation) und chemische Aufbereitung (Oxidation, Reduktion) werden die Reinheit und der Weißgrad weiter erhöht.[2]
Blanc fixe ist ein synthetisches, durch Fällung hergestelltes Bariumsulfat, welches insbesondere als Füllstoff Verwendung findet. Die Fällung von Bariumsulfid mit Natriumsulfat führt zu einem Produkt, das sehr feinkörnig aufbereitet werden kann.
Das gefällte Bariumsulfat wird abfiltriert, getrocknet und gemahlen. Das reinweiße Bariumsulfat hat gewöhnlich eine Teilchengröße im einstelligen Mikrometerbereich.
Zur Herstellung von Blanc-fixe-Pasten mit einem 25- bis 30-prozentigen Feststoffgehalt setzt man Bariumchlorid mit Natriumsulfat zum unlöslichen Bariumsulfat um.
Die Bariumchloridlösung stammt gewöhnlich aus der Lithopone-Herstellung oder wird durch Umsetzung von Bariumsulfid mit Salzsäure hergestellt.
Früher fiel Bariumsulfat bei der Herstellung von Wasserstoffperoxid aus Bariumperoxid bei der Umsetzung mit Schwefelsäure an.
Verwendung
Natürliches Bariumsulfat dient als Rohstoff zur technischen Herstellung anderer Barium-Verbindungen inklusive Barium-Metall. Als Füllstoff wird Bariumsulfat in Kunststoffen, plastischen Massen, Lacken und Farben, sowie bei der Papierherstellung verwendet.[2] Daneben wird es aufgrund seiner physikalischen Eigenschaften bei der Rohstoffgewinnung und in Schwerbeton sowie aufgrund der Absorption von Gamma- und Röntgenstrahlung in Strahlenschutzbeton und in der Radiologie eingesetzt.
In der Erdöl- und Erdgas-Industrie
Die – bezogen auf die Menge – wichtigste Anwendung von Bariumsulfat ist die Verwendung in Bohrspülschlämmen. Durch die hohe Dichte des Bariumsulfats erhält man Suspensionen, deren Dichte so hoch ist, dass Gesteinsbrocken im Bohrschlamm aufschwimmen und dadurch das Bohrloch frei gespült werden kann.[2]
Als Füllstoff
Schwerspat wird bei der Produktion von Kunststoffen für Spachtelmassen im Autoreparaturbereich, als Füllstoff in Kupplungs- und Bremsbelägen, in Teppichbodenbeschichtungen und in Abwasserrohren eingesetzt. Durch seine hohe Dichte erhöht es die Dichte des Kunststoffes, wirkt schalldämmend und verbessert durch seine geringe Ölzahl die Verarbeitbarkeit und den Verlauf. Daneben erhöht es die Oberflächenhärte und Kratzfestigkeit von Kunststoffen. Durch seine Temperaturstabilität kann es auch dort eingesetzt werden, wo andere Füllstoffe, wie Calciumcarbonat, nicht mehr verwendet werden können. Bei der Herstellung von Papier wird Bariumsulfat als Füllstoff eingesetzt, um dessen Streichfähigkeit zu verbessern (siehe Barytpapier für Fotopapiere).[2]
Als Weißpigment
Als Barytweiß, Blanc fixe, Malerweiß, Puppenweiß ist gefälltes Bariumsulfat der weiße Füllstoff in vielen Malerfarben und Lacken. Es kann auch in Deckweiß enthalten sein. Im Colour Index wird Bariumsulfat, als synthetisches BaSO4 unter der Bezeichnung C.I. Pigment White 21 und als „natürliches“ Baryt unter C.I. Pigment White 22 geführt. Es ist hervorragend lichtecht und chemisch stabil. Deshalb erhielt es auch die Bezeichnung Permanentweiß. Die Wirkung als Weißpigment entsteht durch Streuung an der Grenzfläche zwischen Füllstoff und umgebendem Bindemittel. Daher erscheint Bariumsulfat in Bindemitteln, die selbst einen Brechungsindex nahe dem von Bariumsulfat (1,64[9]) besitzen, nahezu transparent. Diese geringe Differenz der Brechungsindices ist vorteilhaft für die Verwendung als Verschnittmittel. In Systemen, die oberhalb der kritischen Pigment-Volumen-Konzentration formuliert sind, etwa in Dispersionsfarben, kommen zusätzliche Grenzflächen zwischen Bariumsulfat und Luft hinzu. An diesen ist die Differenz der Brechungsindices größer, so dass das Deckvermögen deutlich erhöht wird (Dry-Hiding-Effekt). Beim Einsatz farbstarker organischer Pigmente in geringen Mengen ist es üblich, so genannte Verkollerungen mit Bariumsulfat als Trägersubstanz herzustellen. Dabei werden Pigment und Bariumsulfat gemeinsam vermahlen. Der Farbort verändert sich dabei nicht, aber die Farbstärke wird deutlich herabgesetzt. So wird die Dosierung geringer Pigmentmengen vereinfacht. Diese Methode wird für die Herstellung von Lasuren benötigt. Auch bei einer Nuancierung von reinen Weißtönen ist es vorteilhaft größere Mengen mit herabgesetzter Farbstärke abzuwägen.
Als Blanc fixe wurde es erstmals 1830 von Kuhlmann in Lille in den Handel gebracht. Natürlicher gemahlener Baryt dürfte schon früher verwendet worden sein. Das durch Fällung hergestellte Bariumsulfat ist allerdings feiner und brillanter und daher als Füllstoff besser geeignet. Durch chemische Reaktion von BaS und ZnSO4 in wässrigem Milieu erhält man das Weißpigment Lithopone als ein Gemisch von Bariumsulfat und Zinksulfid.
F. Grum und W. Luckey (Kodak) führten 1968 das Bariumsulfat als Weiß zur Beschichtung von Ulbricht-Kugeln ein.[10] Aufgrund seiner äußerst geringen Lichtabsorption im Bereich zwischen 250 nm und 2500 nm dient Bariumsulfat auch heute noch, mit einer Reflektivität von mehr als 90 %, als De-facto-Standard für diffuse Weißreflektoren. Einen Ersatz bilden Teflon-Standards, die abriebfester sind. Titandioxid ist wegen seiner merklichen Absorption im Ultravioletten nur eingeschränkt geeignet.
Röntgenkontrastmittel
In der Medizin wird Bariumsulfat als Röntgenkontrastmittel Patienten in Form einer milchigen Suspension zum Trinken gegeben, um den Verlauf des Verdauungstraktes bei einer Röntgenuntersuchung zu kontrastieren (positives Röntgenkontrastmittel mit hoher Röntgenstrahlabsorption). In niedrigerer Konzentration, meist 1–1,5 %, wird es in der Computertomographie ebenfalls zur Markierung des Gastrointestinaltraktes verwendet. Bariumsulfat sollte nicht bei Verdacht auf Perforationen des Magen-Darm-Trakts eingesetzt werden, da es in der Peritonealhöhle zu Granulomen und Verklebungen führen kann. Auch das versehentliche Einbringen in den Atemtrakt ist wegen der Gefahr einer Aspirationspneumonie unbedingt zu vermeiden.[11]
Analytik
Sulfate werden qualitativ nachgewiesen, indem eine Probenlösung mit Salzsäure angesäuert und mit Bariumchlorid versetzt wird. Das Bariumsulfat fällt als schwerlöslicher, weißer Niederschlag aus. Die Bariumsulfat-Fällung eignet sich sowohl zur gravimetrischen Bestimmung von Sulfat als auch zur Bestimmung von löslich vorhandenem Barium mit zugesetztem Sulfat.
Einzelnachweise
- Eintrag zu BARIUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Februar 2020.
- Eintrag zu Bariumsulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. November 2016.
- Datenblatt Barium sulfate, Puratronic®, 99.998% (metals basis) bei AlfaAesar, abgerufen am 6. Dezember 2019 (PDF) (JavaScript erforderlich).
- MAK- und BAT-Werte-Liste 2013
- G.Kortüm, H.Lachmann; Einführung in die chemische Thermodynamik; 7., ergänzte und neubearbeitete Auflage; Seite 465; Verlag Chemie; Weinheim; Vandenhoeck & Ruprecht; Göttingen; 1981; ISBN 3-527-25881-7 (Verlag Chemie); ISBN 3-525-42310-1 (Vandenhoeck & Ruprecht).
- D. Neugebauer et al. Evidence of central and peripheral gravireception in the ciliate Loxodes striatus, J. Comp. Physiol. A (1998) 183, 303–311.
- R.J. Hill: A further refinement of the barite structure. In: The Canadian Mineralogist, 15, 1977, S. 522–526.
- BARITE. (PDF) USGS, Januar 2020, abgerufen am 10. April 2020.
- T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage; Seite 123; Vincentz Network; Hannover; 2000; ISBN 3-87870-569-7.
- F. Grum, G. W. Luckey; Optical Sphere Paint and a Working Standard of Reflectance; Applied Optics, Vol. 7, Heft 11, S. 2289–2294 (1968), doi:10.1364/AO.7.002289.
- Silke Hecht: Röntgendiagnostik in der Kleintierpraxis. Schattauer Verlag, 2. Auflage 2012, ISBN 9783794528127, S. 259.