Thoriumnitrat
Thoriumnitrat (Th(NO3)4) ist eine farblose, leicht in Wasser und Ethanol lösliche chemische Verbindung, das Thoriumsalz der Salpetersäure. Das Nitrat ist ein wichtiges Zwischenprodukt bei der Darstellung von Thorium(IV)-oxid sowie von Thoriummetall und wird auch bei der Erzeugung von Gasglühkörpern eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
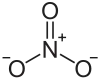 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thoriumnitrat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Th(NO3)4 | |||||||||||||||
| Kurzbeschreibung |
hygroskopische weiße Plättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 480,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,78 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||

Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Chemische Reaktionen
Thoriumnitrat selbst ist nicht entflammbar, jedoch – wie andere Nitrate – brandfördernd. Mischungen mit brennbaren Stoffen können daher beim Entzünden heftig oder explosiv reagieren. Die dabei entstehenden Gase enthalten gesundheitsschädliche Stickstoffverbindungen.
Wässrige Lösungen reagieren sauer, da durch Hydrolyse Salpetersäure entsteht. Die Lösungen zersetzen sich langsam unter Abscheidung sogenannter basischer Thoriumnitrate.[8]
Auswirkungen auf die Gesundheit
Thoriumnitrat selbst ist gering giftig, die freiwerdende Alphastrahlung kann jedoch in größeren Mengen gesundheitsschädigend wirken. Die Emission von Beta- und Gammastrahlung ist eher gering. Der Staub kann Augen, Nase, Rachen und Haut reizen. Bei Augenkontakt sollten die Augen gründlich mit fließendem Wasser gespült werden.
Bei Mäusen bewirkte orale Gabe in hoher Dosis tödliche gastrointestinale Störungen wie Magengeschwüre und Darmblutungen.[7][6] Beim Verschlucken wird empfohlen, viel zu trinken. In jedem Fall ist sofort ein entsprechender Arzt aufzusuchen. Die Substanz kann Übelkeit, Benommenheit, Erbrechen, Bauchkrämpfe, blutige Durchfälle, Krampfanfälle und Kreislaufkollaps hervorrufen.[2]
Verwendung

Am wichtigsten war bis vor einigen Jahren die Verwendung zur Herstellung von Glühstrümpfen, die die Lichtausbeute bei Gaslampen verbesserten. Mittlerweile wurde die Substanz jedoch erfolgreich durch nichtradioaktive Materialien ersetzt.
Auch wurde es für die Herstellung von Elektroden zum Schweißen gebraucht (Wolfram-Inertgas-Schweißen (WIG)). Ebenso wurden Kathoden für Magnetron- und Wanderfeldröhren unter Verwendung von Thoriumnitrat hergestellt, da diese in der Lage waren, freie Elektronen auch bei niedrigen Temperaturen zu emittieren und zudem eine längere Lebensdauer hatten.[9]
Als Bestandteil von Thorium-X
Thoriumnitrat ist ein Bestandteil von Thorium-X, einer Mischung verschiedener radioaktiver Isotope, welche früher unter anderem für die Erzeugung der damals für besonders gesund gehaltenen Zahnpasta Doramad, welche jedoch nach den Atombombenabwürfen auf Hiroshima und Nagasaki wegen der seitdem offenkundlichen Schädlichkeit von Radioaktivität vom Markt genommen wurde. Ebenso gab es unter der Bezeichnung Thorium-X Salben, Badezusätze und Tinkturen vor allem gegen Ekzeme.[10] Diese Verwendung hatte z. T. schwerwiegende Spätfolgen.[11]
Thorium-X wurde vielseitig erforscht, unter anderem seine (vermuteten positiven) Auswirkungen auf das Immunsystem[12] und auf Mykosen.[13]
In den 1960er-Jahren wurde Thorium-X auch gegen Morbus Bechterew eingesetzt.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-95.
- ibilabs.com: MSDS Thorium Nitrate (Memento vom 13. Februar 2013 im Internet Archive)
- Datenblatt Thorium nitrate hydrate bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Environmental Quality and Safety, Supplement, Vol. 1, 1975, S. 1.
- Eintrag zu Thorium nitrate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- S. J. Patrick: Some effects of the administration of thorium nitrate to mice. In: Canadian Journal of Research. Band 26e, Nr. 6, 1948, S. 303–316, doi:10.1139/cjr48e-019.
- Eintrag zu Thoriumtetranitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- James B. Hedrick: Thorium (PDF; 36 kB).
- Victor H Witten, Milton S Ross, Eleanor Oshry, Arthur B Hyman, Vera Holmstrom: Studies of Thorium X Applied to Human Skin. In: Journal of Investigative Dermatology. 17, 1951, S. 311–322, doi:10.1038/jid.1951.100.
- J. Natkunarajah, S. Cliff: Thorium X treatment: multiple basal cell carcinomas within a port-wine stain. In: Clinical and Experimental Dermatology. 34, 2009, S. e189–e191, doi:10.1111/j.1365-2230.2008.03012.x.
- Ludvig Hektoen, H. J. Corper: The Influence of Thorium X on Antibody-Formation. In: Journal of Infectious Diseases. Band 26, Nr. 4, 1920, S. 331–335, JSTOR:30082119.
- Bernard Green: Mycosis Fungoides — Treated with Thorium X. In: Proceedings of the Royal Society of Medicine. Band 40, Nr. 9, 1947, S. 503, PMID 19993605, PMC 2183582 (freier Volltext).
Literatur
- Mathias S. Wickleder, Blandine Fourest, Peter K. Dorhout: Thorium. In: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 52–160, doi:10.1007/1-4020-3598-5_3.
Weblinks
- Informationen (PDF, en; 17 kB) der National Oceanic and Atmospheric Administration



