Haptizität
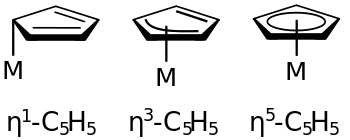
Unter der Haptizität eines Liganden versteht man in der Koordinationschemie die Anzahl der Ligandatome (in der Regel ungesättigte Kohlenstoffatome), die direkt an das Zentralatom eines Komplexes gebunden sind. Die Angabe der Haptizität liefert Informationen über unterschiedliche Bindungszustände eines Liganden, wenn mehrere Atome zur Bindung zur Verfügung stehen.
Liganden, die unterschiedlich viele Atome zur Bindung beisteuern können, sind zum Beispiel ungesättigte organische Moleküle, wie Allyl- (C3H5−), Benzol (C6H6) oder Cyclopentadienylsysteme (C5H5−).
Die Benennung erfolgt durch den Buchstaben ηn (griech. eta), welcher dem Namen des Komplexes vorangestellt wird. Das hochgestellte n gibt die Anzahl der gebundenen Atome an. Man liest ηn als n-hapto (η3 = trihapto, η4 = tetrahapto, η5 = pentahapto usw.).
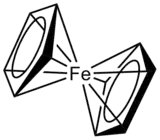
Die Haptizität von Liganden wechselt häufig bei Substitutions- oder Redox-Reaktionen:[1]
Einzelnachweise
- Gottfried Huttner: Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0). In: Angewandte Chemie, International Edition in English. 10, Nr. 8, 1971, S. 556–557. doi:10.1002/anie.197105561.
2.png.webp)