Oktaederlücke
Die Oktaederlücke ist in einer Kristallstruktur ein von mindestens sechs benachbarten Atomen oder Ionen gebildeter Hohlraum. Dieser bleibt auch frei, wenn in einer dichtesten Kugelpackung die Atome so eng wie möglich gesetzt werden. Der Name kommt daher, dass die Atome ein Oktaeder bilden. Dichteste Kugelpackungen (kubisch flächenzentriertes und hexagonales Kristallsystem, aber nicht das kubisch raumzentrierte) haben genauso viele Oktaederlücken wie Atome in der Elementarzelle.
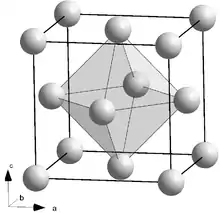
Eine Oktaederlücke im kubisch-flächenzentrierten Kristall ist genau im Zentrum der Elementarzelle platziert. Dazu kommen 12 weitere Oktaederlücken, die genau in der Mitte der Kanten der Elementarzelle liegen. Diese "Kantenoktaederlücken" werden allerdings mit je drei benachbarten Elementarzellen geteilt. Die gesamte Anzahl der Oktaederlücken pro Elementarzelle beträgt somit 1 + 12 · 1/4 = 4 wie die Anzahl der Atome 8 · 1/8 + 6 · 1/2 = 4.[1]
Kleinere Fremdatome können in die Oktaederlücken eingelagert werden, unregelmäßig als Fehlstellen oder regelmäßig als Verbindungspartner. Ein Beispiel für den regelmäßigen Einbau ist die Natriumchlorid-Struktur: Im Natriumchlorid sind die Chlorid-Anionen etwa doppelt so groß wie die Natrium-Kationen. Die Anionen bilden ein dichtgepacktes kubisch-flächenzentriertes Gitter, die Kationen füllen die Oktaederlücken auf.
Neben den Oktaederlücken besitzen dichteste Kugelpackungen auch noch die kleineren Tetraederlücken, die von vier Atomen gebildet werden.
Größe
Die Größe der Oktaederlücke kann angegeben werden durch den Radius r der größten Kugel, die in die Lücke hineinpasst. Mit dem Radius R der großen Kugeln in den Ecken des Oktaeders, d. h. der halben Bindungslänge, erhält man folgende Werte.
Kubisch-flächenzentriertes Gitter
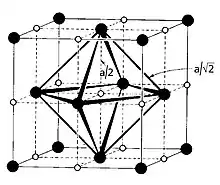
Hier sind alle Seiten des Oktaeders gleich lang und alle Ecken des Oktaeders gleich weit von seinem Zentrum entfernt, vgl. Abb.; es handelt sich um ein regelmäßiges Oktaeder:
mit
- dem Radius der Umkugel des Oktaeders
- der Seitenlänge des Oktaeders
- der Seitenlänge der Elementarzelle.
Kubisch-raumzentriertes Gitter
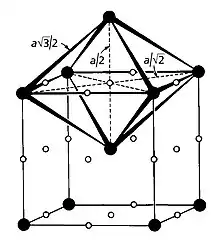
Hier sind nicht alle Seiten des Oktaeders gleich lang bzw. nicht alle seine Ecken gleich weit von seinem Zentrum entfernt, vgl. Abb., es handelt sich um ein verzerrtes bzw. unregelmäßiges Oktaeder; entscheidend für die Lückenkugel ist daher der kleinere der beiden Ecken-Zentrum-Abstände:
mit:
- der Seitenlänge der Elementarzelle
- der Raumdiagonale der Elementarzelle.
Einzelnachweise
- Charles E. Mortimer, Ulrich Müller: Chemie – Das Basiswissen der Chemie. 12. Auflage, Georg Thieme Verlag, 2015, ISBN 978-3-13-484312-5, S. 188.
Literatur
- Ulrich Müller: Anorganische Strukturchemie. 5. Auflage, Teubner, Stuttgart 2006, ISBN 3-83-510107-2, S. 278 ff.