Koenigs-Knorr-Methode
Die Koenigs-Knorr-Methode – benannt nach Wilhelm Koenigs (1851–1906) und seinem Mitarbeiter Eduard Knorr (1867–1926) – ist eine der bekanntesten Reaktionen in der Kohlenhydratchemie und dient zur synthetischen Herstellung von Glykosiden aus Monosaccharid-Derivaten.
Die Chemiker Koenigs und Knorr behandelten im Jahre 1901 2,3,4,6-Tetra-O-acetyl-α-D-glucopyranosylbromid (Acetobromglucose) in Methanol mit Silber(I)-carbonat und erhielten Methyl-2,3,4,6-tetra-O-acetyl-β-D-glucopyranosid.
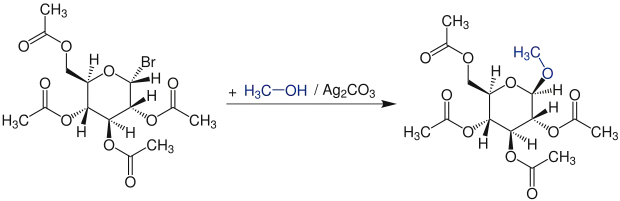
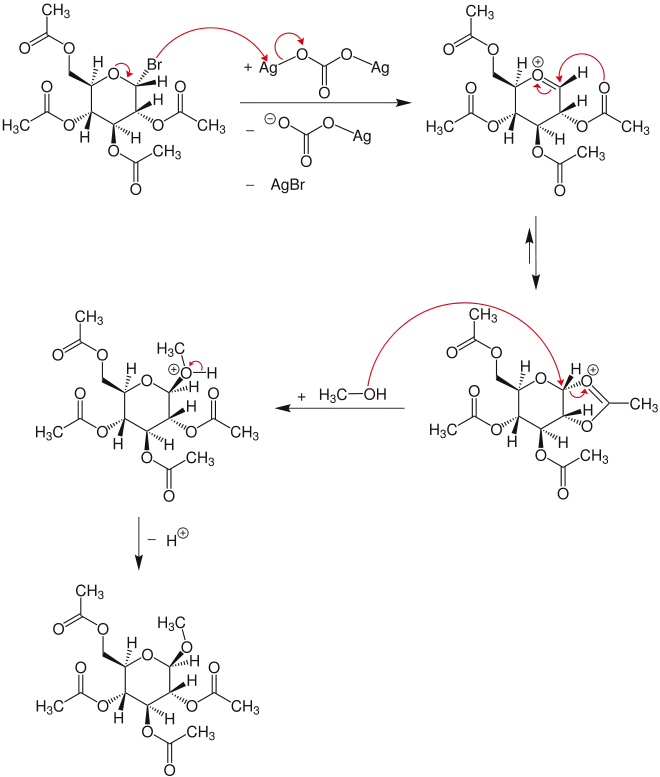
Reaktionsmechanismus
Im ersten Schritt reagiert das Glycosylbromid mit Silbercarbonat unter Abspaltung von Silberbromid und dem Silbercarbonatanion zum Oxocarbeniumion. Aus diesem bildet sich ein Dioxolaniumion, welches vom Methanol über einen SN2-Mechanismus am Carbonylkohlenstoffatom angegriffen wird. Durch diesen Angriff kommt es zur Inversion. Nach der Abspaltung eines Protons entsteht letztlich das Glykosid.[1]
Diese Reaktion kann auch auf Kohlenhydrate mit anderen Schutzgruppen übertragen werden. In der Oligosaccharidsynthese werden anstelle des Methanols Kohlenhydrate verwendet, die mit Schutzgruppen so verändert wurden, dass sie nur noch eine „freie“ Hydroxygruppe enthalten.
Die Methode wurde später durch Emil Fischer und Burckhardt Helferich auf andere chlorsubstituierte Purine übertragen und damit erstmals auf synthetischem Weg Nucleoside erzeugt. Sie wurde später durch zahlreiche Chemiker weiter verbessert und modifiziert.
Einzelnachweise
- László Kürti und Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 246–247, ISBN 978-0-12-429785-2.
Literatur
- W. Koenigs, E. Knorr: Chemische Berichte. Nr. 34, 1901, S. 957. online