Glycosidische Bindung
Als glycosidische Bindung oder glykosidische Bindung bezeichnet man die chemische Bindung zwischen dem anomeren Kohlenstoffatom eines Kohlenhydrats (Glycon) und dem Hetero- oder selten Kohlenstoffatom eines Aglycons oder einem zweiten Zuckermolekül. Verbindungen, die eine glycosidische Bindung enthalten, sind in der Natur weit verbreitet und werden Glycoside genannt.[1]
Wenn das Aglycon ein Alkohol oder Phenol ist, dann stammt das Brücken-Sauerstoffatom vom Aglycon. Glycoside können auch Bindungen zu anderen Heteroatomen wie Schwefel, Selen, Stickstoff und Phosphor oder selten zu Kohlenstoff („C-Glycoside“) aufweisen. Die glycosidische Bindung ist hydrolytisch spaltbar, wobei das Reaktionsgleichgewicht auf Seiten der Spaltungsprodukte liegt. Die Bindung ist kinetisch aber sehr stabil. Sie wird mit geringem Energieaufwand unter Wasserabspaltung durch eine Kondensationsreaktion gebildet. In der Natur erfolgt die als Glycosylierung bezeichnete Bildung enzymatisch über ein aktiviertes Saccharid, im Labor durch spezielle Aktivierungsmethoden oder durch Reaktion eines Zuckers mit einem großen Überschuss des Alkohols unter Säurekatalyse.
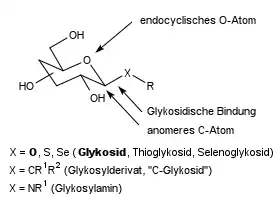
Bei einem Glycosid liegt die Aldehydfunktion der Aldosen (z. B. Glucose) oder die Ketofunktion der Ketosen (z. B. Fructose) als zyklisches Vollacetal vor. Ein Acetal ist das Kondensationsprodukt aus einem Aldehyd oder Keton und einem oder zwei Alkoholen („Halbacetal“ bzw. „Vollacetal“). Vollacetale sind stabil gegen basische und neutrale bis schwach saure wässrige Lösungen, hydrolysieren jedoch in Gegenwart starker Säuren.
Nomenklatur und Beispiele
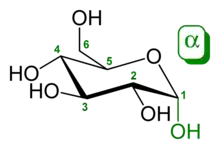
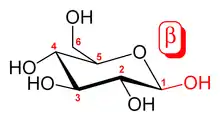
Das α- und β-Anomer der D-Glucose. Die Position der anomeren Kohlenstoffatome (rot oder grün) relativ zur CH2OH-Gruppe am C-5 bestimmt, ob es sich um die α-Verbindung (verschiedene Ringseiten) oder die β-Verbindung (dieselbe Seite des Rings) handelt.
Einfache Glycoside
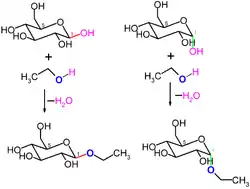
Die Position der Hydroxygruppe des an der Bindung beteiligten anomeren Kohlenstoffatoms bestimmt den Namen der Verbindung und auch den Typ der Bindung: Glucose kommt in der cyclischen Pyranoseform als α-D-Glucopyranose oder β-D-Glucopyranose vor. Dies wird bei der Nomenklatur einer Bindung als α- oder β-glycosidische Bindung berücksichtigt. Bei einem einfachen Glycosid, etwa aus dem Monosaccharid Glucose und einem Alkohol wie Ethanol, wird dieses entweder als Ethyl-α-D-glucopyranosid oder Ethyl-β-D-glucopyranosid bezeichnet. Während eine glycosidische Bindung im Normalfall eine C-O-Bindung ist, wird bei Glycosiden mit Heteroatom (S, Se, N, P) dies durch kursive Nennung im Namen berücksichtigt, z. B. Ethyl-S-α-D-glucopyranosid.[2]
Definition α und β
Durch die Präfixe α und β wird die anomere Konfiguration definiert. Entscheidend ist die stereochemische Relation des exocyclischen Sauerstoffs zum konfigurationsbestimmenden C-Atom des Zuckers (α = trans, β = cis). Dabei ist α nicht immer axial und β nicht immer äquatorial zum Ring. Beispiele: Bei α-D-Glucopyranose steht der exocyclische Sauerstoff cis zum konfigurationsbestimmenden C-5: das Aglycon steht axial (β ist hier äquatorial). Bei dem Paradebeispiel β-D- oder L-Arabinopyranose steht der exocyclische Sauerstoff cis zum konfigurationsbestimmenden C-4. Hier ist β also axial.[2] Die Unterscheidung ist am besten in der Fischer-Schreibweise zu sehen.
Di-, Oligo- und Polysaccharide
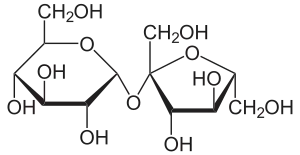
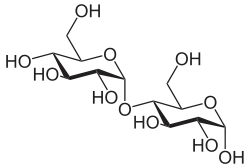
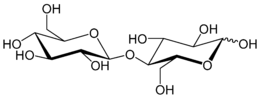
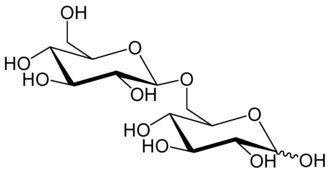
Bei der Kondensation zweier Kohlenhydrate über eine glycosidische Bindung zu einem Disaccharid berücksichtigt die Nomenklatur der Bindung zwei verschiedene Faktoren:
- Einerseits je nach Ausgangsverbindung die α- oder β-Stellung des an der Bindung beteiligten ersten anomeren Kohlenstoffatoms.
- Der zweite Teil der Benennung stammt aus der Position der Kohlenstoffatome, die an die Sauerstoffbrücke direkt gebunden sind. Bei der Saccharose (Rohrzucker) kommt die Bindung über das 1. Kohlenstoffatom der Glucose mit einer Hydroxygruppe in α-Stellung zum 2. Kohlenstoffatom der β-D-Fructose zustande. Die Bindung ist also eine α-1→2-glycosidische Bindung und Saccharose heißt demnach korrekt 1-α-D-Glucopyranosyl-2-β-D-fructofuranosid oder auch 2-β-D-Fructofuranosyl-1-α-D-glucopyranosid.
Es ist ebenfalls möglich, dass zwei gleiche Monosaccharide zu einem Disaccharid wie der Cellobiose verbunden werden. Dabei verbrückt das Sauerstoffatom das C1-Atom des ersten β-D-Glucosemoleküls mit dem 4. Kohlenstoffatom eines zweiten, identischen Monomers. Die Verbindung ist eine β-1→4-glycosidische Bindung und die Cellobiose demnach das 1-β-D-Glucopyranosyl-4-β-D-glucopyranosid. Da das anomere erste Kohlenstoffatom des zweiten Glucosemoleküls frei bleibt, kann dieses mit weiteren Monomeren zu einem Polysaccharid wie Cellulose weiterreagieren. Analog können zwei Glucosemoleküle α-1→4-glycosidisch zu Maltose (1-α-D-Glucopyranosyl-4-α-D-glucopyranose) verknüpft werden.
Eine weitere Verbindungsmöglichkeit kommt in der Gentiobiose vor: zwei Glucoseeinheiten sind über das 1. C-Atom des ersten Monomers und das 6. C-Atom des zweiten β-1→6-verbrückt, die Verbindung heißt auch 1-β-D-Glucopyranosyl-6-β-D-glucopyranose. In Laminaribiose sind ebenfalls zwei Glucosemoleküle β-1→3-verknüpft.
Bei Polysacchariden kommen verschiedene glycosidische Bindungen vor:
- Amylopektin, der Hauptbestandteil der Stärke, ist aus α-1→4-verbundenen Glucosemonomeren aufgebaut.
- Amylose, die ebenfalls in Stärke vorkommt, enthält nur α-1→4-verbrückte Glucose, die eine Helixstruktur bildet.
- Cellulose besteht aus Glucose, die β-1→4-verbunden ist.
- Glykogen besteht aus Glucose, wobei die Hauptkette vorwiegend α-1→4-Bindungen aufweist, aber auch Verzweigungen mit α-1→6-Struktur.
Komplexe Glycoside und Heteroglycoside

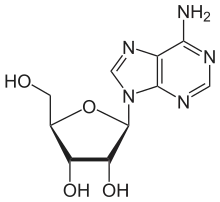
Neben einfachen Alkoholen und anderen Sacchariden kann der Zuckeranteil auch mit einem komplexeren Alkohol (wie einem Steroidalkohol), einem Phenol oder einem anderen Heteroatom wie Stickstoff, Schwefel oder Phosphor verbunden sein. Dieser Fall tritt beispielsweise in den Nukleosiden und Nukleotiden auf, bei denen eine N-glycosidische Bindung über eine Stickstoffbrücke vorliegt. Der Zuckeranteil ist hier meist die Ribose oder die Desoxyribose. In der Natur kommen daneben sehr viele O- und N-Glycoside, seltener S-Glycoside vor, die verschiedenste Funktionen wie Aromastoffe (Amygdalin, Glycyrrhizin), Abwehrstoffe (Senfölglycoside, Barbaloin, Cycasin), Energiespeicher und -übertrager (ADP, ATP), Farbstoffe (Azalein, Betanin, Karmin, Malvin) und Speicherstoffe (Coniferin) erfüllen. Auch einige natürliche und künstliche Antibiotika wie Azithromycin, Bleomycin, Cethromycin, Doramectin und Streptomycin sind Glycoside.
Einzelnachweise
- Wissenschaft-Online-Lexika: Eintrag zu Glykoside im Kompaktlexikon der Biologie, abgerufen am 25. Februar 2009.
- IUPAC Nomenclature of Carbohydrates bzw. Abschnitt 2-Carb-33: Glycosides and glycosyl compounds.
Literatur
- G. Löffler, P. E. Petrides, P. C: Heinrich: Biochemie & Pathobiochemie. 8. Auflage, Springer, Heidelberg 2006, ISBN 978-3-540-32680-9.
- H. R. Horton, L. A. Moran, K. G. Scrimgeour, M. D. Perry, C. Biele, J. D. Rawn: Biochemie., 4. Auflage, Pearson Education, 2008, ISBN 978-3-8273-7312-0, 1088 Seiten.