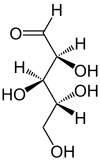
Arabinose
Arabinose ist ein natürlich vorkommender Einfachzucker (Monosaccharid), der aus fünf Kohlenstoff-Atomen besteht (Pentose). Arabinose wird bisweilen auch als Pectinose, Gummizucker oder Aloinzucker bezeichnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Fischer-Projektion, offenkettige Darstellung | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Arabinose | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10O5 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,6 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
59,4 g/100 g Wasser bei 10 °C[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Entdeckung und Konstitution
Der deutsche Chemiker Carl Scheibler erhielt durch Hydrolyse von Gummi arabicum das Kohlenhydrat Arabinose. Heinrich Kiliani korrigierte die vorgeschlagene Konstitutionsformel, indem er nachwies, dass der Substanz die Summenformel C5H10O5 zukommt, es sich also um einen „Fünferzucker“, eine Pentose, handelt.
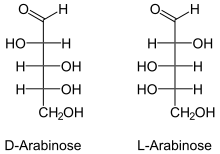
In der Folge wurden verschiedene Methoden der Umwandlung von D-Glucose in Arabinose entwickelt. Diese Abbaureaktionen führten zu D-Arabinose, deren wässrige Lösung die Ebene polarisierten Lichts nach links dreht.[5] Die aus Gummi arabicum erhaltene Arabinose war aber „rechtsdrehend“, musste daher die L-Konfiguration besitzen. In der Natur kommt in gebundener Form auch D-Arabinose vor, ist jedoch seltener (Vorkommen siehe unten).
Stereochemie und Gleichgewichte
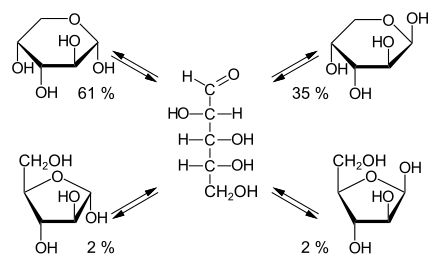
Die offenkettige Arabinose ist diastereomer zu den drei weiteren Aldopentosen Ribose, Xylose und Lyxose. Die beiden Enantiomeren D-(−)-Arabinose und L-(+)-Arabinose sind Folgen der Chiralität der Verbindung.
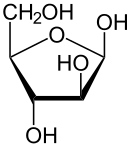
Durch eine intramolekulare Halbacetalbildung bilden sich die beiden cyclischen Konstitutionsisomere Arabinofuranose und Arabinopyranose. Da bei der Halbacetalbildung ein weiteres Asymmetriezentrum entsteht, resultieren jeweils zwei Diastereomere, die α- und β-Arabinofuranose, bzw. die α- und β-Arabinopyranose. Die α- und β-Furanose- bzw. α- und β-Pyranosepaare werden auch als Anomere bezeichnet.
| D-Arabinose – Schreibweisen | ||
|---|---|---|
| Keilstrichformel | Haworth-Schreibweise | |
 |
 α-D-Arabinofuranose |
 β-D-Arabinofuranose |
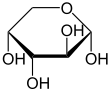 α-D-Arabinopyranose |
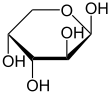 β-D-Arabinopyranose | |
Jeder Ringform und jedem Stereoisomer ist eine eigene CAS-Nummer zugeordnet:
| offen- kettig |
Furanose | Pyranose | |||
|---|---|---|---|---|---|
| α | β | α | β | ||
| D-Arabinose | 10323-20-3 | 37388-49-1 | 25545-03-3 | 608-45-7 | 6748-95-4 |
| L-Arabinose | 5328-37-0 | 38029-69-5 | 20074-49-1 | 7296-55-1 | 7296-56-2 |
Eigenschaften
In wässriger Lösung stehen die anomeren Arabinofuranosen und Arabinopyranosen über die instabile offenkettige Aldehydform miteinander im Gleichgewicht. Das Gleichgewicht wird zu 61 % von der α-Arabinopyranose dominiert, gefolgt von der β-Arabinopyranose mit 35 %. Die beiden Arabinofuranosen spielen mit jeweils 2 % nur eine untergeordnete Rolle.[6] Die Einstellung des Gleichgewichts wird als Mutarotation bezeichnet.
Arabinose kann von gewöhnlicher Hefe nicht vergoren werden. 2005 gelang es Forschern der Goethe-Universität Frankfurt am Main, Hefekulturen so zu modifizieren, dass sie auch Arabinose und Xylose zu Ethanol vergären können.[7]
Vorkommen
Die L-Form kommt in Lebensmitteln häufig vor, meist als Baustein in Polysaccharid-Ketten im Pflanzenreich. Sie hat, wie andere Zucker auch, einen süßlichen Geschmack.[8] Die D-Form wurde als Bestandteil eines Polysaccharids in Tuberkulose-Bazillen nachgewiesen.
Abbau
Der Abbau von L-Arabinose bei E. coli wird durch das ara-Operon gesteuert. Ist L-Arabinose in der Zelle vorhanden, wird die Transkription an einem Promotor aktiviert und die synthetisierte mRNA, die aus dem Gen araA hervorgeht, kann nach Translation in die L-Arabinose-Isomerase umgewandelt werden. Die L-Arabinose-Isomerase wandelt L-Arabinose in L-Ribulose um.[9]
Siehe auch
Weblinks
Einzelnachweise
- Datenblatt Arabinose (PDF) bei Carl Roth, abgerufen am 23. März 2007.
- Datenblatt D-Arabinose bei Sciencelab (Memento vom 4. März 2016 im Internet Archive).
- Eintrag zu Arabinose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Februar 2019.
- Datenblatt D-(-)-Arabinose bei AlfaAesar, abgerufen am 20. Februar 2019 (PDF) (JavaScript erforderlich).
- Louis F. Fieser, Mary Fieser, Lehrbuch der Organischen Chemie, ins Deutsche übersetzt von R. Hensel, Verlag Chemie, Weinheim, 1954, S. 416–418.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 851 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wissenschaftler entwicklen neuen Hefetyp durch „gesteuerte Evolution“: Gentech-Hefe macht Biosprit aus Pflanzenabfällen. In: scinexx. 30. November 2005, abgerufen am 24. Januar 2020.
- L-Arabinose | GoldBio. Abgerufen am 5. März 2020.
- James W. Patrick, Nancy Lee: Purification and Properties of an l-Arabinose Isomerase from Escherichia coli. In: Journal of Biological Chemistry. Band 243, Nr. 16, 25. August 1968, S. 4312–4318, doi:10.1016/S0021-9258(18)93258-8, PMID 4878429.