Alkoholische Gärung
Die alkoholische Gärung ist ein enzymatischer Prozess, bei dem Kohlenhydrate, hauptsächlich Glucose, unter anoxischen Bedingungen zu Ethanol („Trinkalkohol“) und Kohlendioxid abgebaut (vergoren) werden. Die meisten Mikroorganismen (Mikroben) mit der Fähigkeit zur alkoholischen Gärung nutzen diesen Stoffwechselweg nur vorübergehend zur Energiegewinnung, wenn der zur Atmung benötigte Sauerstoff fehlt.
| Übergeordnet |
| Glykolytische Gärung Metabolismus der D-Glucose |
| Gene Ontology |
|---|
| QuickGO |


Die Nutzung der alkoholischen Gärung durch den Menschen zur Herstellung alkoholischer Getränke gab es schon in prähistorischer Zeit. In der heutigen Zeit dient die alkoholische Gärung außerdem der Umwandlung von Biomasse in Ethanol als sekundärer Energieträger.
Forschungsgeschichte
Schon in vorgeschichtlicher Zeit erzeugten Jäger und Sammler alkoholische Getränke. 1815 stellte der französische Chemiker Joseph Louis Gay-Lussac erstmals die Brutto-Reaktionsgleichung für den Abbau von Glucose zu Ethanol auf. Danach entwickelten sich verschiedene Ansichten über den Ablauf der Gärung. Während in den 1830er Jahren Jöns Jakob Berzelius und Justus von Liebig mit der „mechanistischen Gärungstheorie“ bestimmten Stoffen eine katalysierende Wirkung zuschrieben, meinten Charles Cagniard-Latour, Theodor Schwann und Friedrich Traugott Kützing unabhängig voneinander, dass Lebewesen, nämlich Hefen, dafür verantwortlich seien.[1] Louis Pasteur postulierte 1857 die „vitalistische Gärungstheorie“, der zufolge die alkoholische Gärung nur in Verbindung mit lebenden Zellen möglich sei.
Diese Kontroverse wurde am 11. Januar 1897 von dem Chemiker Eduard Buchner entschieden mit einer Publikation über den Nachweis der alkoholischen Gärung mittels zellfreien Hefeextrakts.[2] Er machte den Stoff Zymase – nach aktuellem Wissen ein Gemisch verschiedener Enzyme – für die Umsetzung von Zucker zu Ethanol verantwortlich und erhielt 1907 den Nobelpreis für Chemie „für seine biochemischen Untersuchungen und die Entdeckung der zellfreien Gärung“. Nähere Untersuchungen durch Arthur Harden und William John Young führten zur Entdeckung eines phosphorylierten Zwischenprodukts: des Harden-Young-Esters, bekannt als Fructose-1,6-bisphosphat. Zusammen erhielten Harden und Hans von Euler-Chelpin 1929 für ihre „Forschung über die Zuckervergärung und deren Anteil der Enzyme an diesem Vorgang“ ebenfalls den Nobelpreis für Chemie. Nachdem Stück für Stück die Teilreaktionen aufgeklärt und Schemata für den Ablauf der Gärung entworfen wurden, identifizierte Otto Warburg den Cofaktor Nicotinamidadenindinukleotid (NADH) als essentiellen Bestandteil des Gärprozesses. Schon 1937 gelang Erwin Negelein und Hans Joachim Wulff die Kristallisation des Gärungsenzyms Alkoholdehydrogenase.[3]
Weitere Forscher, die nach Buchner an der Aufdeckung der Enzymkette der alkoholischen Gärung mitwirkten, waren Carl Neuberg, Gustav Embden, Otto Fritz Meyerhof, Jakub Karol Parnas, Karl Lohmann sowie Gerty Cori und Carl Ferdinand Cori.[4]
Die an der Gärung beteiligten Enzyme aus verschiedenen Spezies sind mittlerweile isoliert und biochemisch charakterisiert (pH-Optimum, Temperaturoptimum, Reaktionsgeschwindigkeit, Umsatzrate). Die Kristallstrukturanalyse gewährte einen ersten Einblick in ihre molekulare Raumstruktur. Es bestehen Erkenntnisse über die Reaktionsmechanismen. Alles in allem können Vergleiche zwischen den Spezies gezogen werden.[5][6] Die entschlüsselten Gene, die die Baupläne für diese Enzyme enthalten, geben Aufschluss über die evolutionäre Herkunft und über ihre eventuelle ursprüngliche Funktion.
Die Rolle im Stoffwechsel
Die alkoholische Gärung wird vor allem von Zuckerhefen betrieben, unter Sauerstoffmangel dient sie ihnen zur Energiegewinnung. Steht Sauerstoff zur Verfügung, bauen sie Zucker durch Zellatmung ab und gewinnen so die zum Leben benötigte Energie. Der Zucker wird dabei durch eine lange Reihe chemischer, enzymatischer (d. h. durch Enzyme katalysierter) Umsetzungen (Glykolyse – Citratzyklus – Atmungskette) unter Sauerstoffverbrauch vollständig zu Kohlendioxid und Wasser oxidiert. Steht kein Sauerstoff zur Verfügung, so haben die Hefen in der alkoholischen Gärung eine alternative Möglichkeit zur Energiegewinnung. Sie können aber damit – im Vergleich zur vollständigen Oxidation durch Zellatmung – wesentlich weniger Energie in Form von Adenosintriphosphat (ATP) aus Glucose gewinnen: Beim Abbau von einem Molekül Glucose können bei dessen vollständiger Oxidation 32 Moleküle ATP gewonnen werden,[7] bei der alkoholischen Gärung dagegen nur zwei Moleküle ATP. Diese zwei ATP werden in der Glykolyse gewonnen, dem ersten Schritt in der Reaktionsfolge sowohl der Zellatmung als auch der Gärung. Die zwei weiteren Reaktionsschritte der Gärung und damit letztlich die Ethanolproduktion dienen nicht der Energiegewinnung, sondern der Regeneration des Cofaktors NAD+, der bei den enzymatischen Umsetzungen der Glykolyse verbraucht wird. Da NAD nur in begrenzten Mengen vorhanden ist, wird es durch die Gärungsenzyme aus dem reduzierten Zustand (NADH) durch Oxidation mit Acetaldehyd wieder in den oxidierten Zustand (NAD+) versetzt; der Acetaldehyd wird dabei zu Ethanol reduziert.
Hefen sind fakultative Anaerobier. Wenn Sauerstoff zur Verfügung steht, wird Glucose aerob verstoffwechselt, nämlich vollständig zu Kohlenstoffdioxid und Wasser oxidiert. Unter Luftabschluss müssen Hefen dagegen die alkoholische Gärung betreiben. Da bei dieser weit weniger Energie je Molekül umgesetzter Glucose erzeugt wird als bei der aeroben Atmung, steigt die Geschwindigkeit des Glucose-Umsatzes stark an, wodurch der geringere ATP-Gewinn je Molekül umgesetzter Glucose teilweise kompensiert wird. Dieses Phänomen wird Pasteur-Effekt genannt. Wegen der eingeschränkten Energiegewinnung wachsen und vermehren sich Hefen unter Luftabschluss weit weniger stark als bei Luftzutritt. Außerdem wirkt das entstehende Ethanol als Zellgift.
Wenn Hefen in einem Medium mit hoher Zuckerkonzentration wachsen und ihre Enzyme der Zellatmung dadurch überlastet sind, betreiben sie alkoholische Gärung, obwohl genügend Sauerstoff vorhanden ist. Die Hefen nehmen ständig den Zucker auf und verwerten ihn neben der Zellatmung zusätzlich durch Gärung. Es handelt sich hierbei um den Crabtree-Effekt.[8]
Neben Hefearten betreiben auch manche Bakterien alkoholische Gärung.[9] So nutzt Sarcina ventriculi den gleichen enzymatischen Weg wie Hefe, während Zymomonas mobilis einen alternativen Weg beschreitet. Ebenso konnte in verschiedenen Pflanzen geringe Ethanolbildung bei Sauerstoffmangel nachgewiesen werden.[10]
Biochemische Grundlagen
Enzymatische Reaktionen
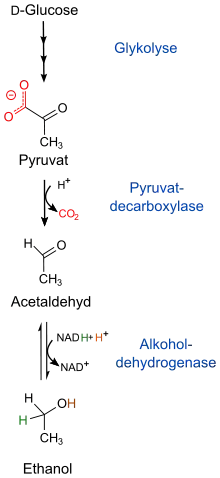
Die ersten Schritte der alkoholischen Gärung sind die der Glykolyse. Bei Backhefe (S. cerevisiae) ist dies der Embden-Meyerhof-Parnas-Weg, während das Bakterium Zymomonas mobilis den Entner-Doudoroff-Weg verwendet.[11] Hierbei wird ein Molekül D-Glucose zu zwei Molekülen Pyruvat umgesetzt. Bei S. cerevisiae entstehen hierbei zwei Moleküle Adenosintriphosphat (ATP) aus zwei Molekülen Adenosindiphosphat (ADP) und zwei Phosphatresten (Pi) durch Substratkettenphosphorylierung. Bei Z. mobilis wird nur ein Molekül ATP gebildet. Zusätzlich werden bei beiden Wegen zwei Moleküle NAD+ (Nicotinamidadenindinukleotid) zu zwei Molekülen NADH reduziert.
Damit die Glykolyse erneut ablaufen kann, muss NAD+ regeneriert werden. Dies geschieht unter anaeroben Bedingungen in der folgenden Gärungsreaktion. Von jedem Molekül Pyruvat wird ein Molekül Kohlenstoffdioxid durch das Enzym Pyruvatdecarboxylase (EC 4.1.1.1) abgespalten. Als Cofaktoren dienen bei dieser Reaktion Thiaminpyrophosphat, ein Verwandter des Vitamin B1, und zwei Magnesiumionen. Die Pyruvatdecarboxylase darf nicht mit der Pyruvatdehydrogenase E1 (EC 1.2.4.1) des Pyruvatdehydrogenase-Komplexes verwechselt werden, das beim aeroben Abbau von Pyruvat eine zentrale Rolle spielt.
Das in diesem Schritt entstehende Acetaldehyd ist für den Organismus sehr giftig und wird im folgenden Schritt sofort weiter umgesetzt. Das katalysierende Enzym Alkoholdehydrogenase (EC 1.1.1.1) enthält ein Zinkion (Zn2+), welches die Carbonylgruppe am Acetaldehyd polarisiert. Dadurch können zwei Elektronen und ein Proton vom NADH auf das Acetaldehyd übertragen werden, wodurch es zu Ethanol reduziert und NAD+ regeneriert wird. Sowohl die Glykolyse als auch die zwei Folgereaktionen finden im Zytoplasma der Zelle statt.
Die Netto-Reaktionsgleichung für Bäckerhefe lautet:
Das Enzym Alkoholdehydrogenase stellt Ethanol durch Reduktion von Acetaldehyd her, katalysiert aber auch die Rückreaktion. Während der alkoholischen Gärung läuft zum größten Teil die Reduktion von Acetaldehyd zu Ethanol ab. Das entstandene Ethanol wird anschließend von den Zellen an die Umgebung abgegeben.
Die Oxidation von Ethanol zu Acetaldehyd dagegen findet beispielsweise bei der Entgiftung von Ethanol in der Leber statt. Acetaldehyd ist giftig und neben Fuselölen die Hauptursache für Kopfschmerz und Übelkeit nach heftigem Alkoholgenuss (der sogenannte „Kater“). Acetaldehyd wird vom Enzym Acetaldehyddehydrogenase zu Essigsäure oxidiert.
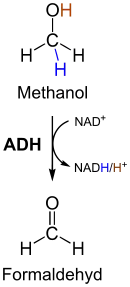
Nebenprodukte
Bei der alkoholischen Gärung durch Hefen entstehen als unerwünschte Nebenprodukte Methanol und Begleitalkohole wie Butanol, Amylalkohol und Hexanol. Ihre Bildung verläuft nicht auf dem hier beschriebenen Stoffwechselweg, sondern zum Beispiel über den Abbau von Aminosäuren, Methanol aus der Spaltung von Pektinen. Im Körper wird Methanol vom Enzym Alkoholdehydrogenase zum giftigen Formaldehyd oxidiert. Trinkt man Alkohol mit hohem Methanolgehalt, so entsteht im Körper entsprechend viel Formaldehyd, welches schnell über Aldehyddehydrogenase in Ameisensäure überführt wird. Diese wird in der Folge zu Kohlenstoffdioxid und Wasser verstoffwechselt. Da der Abbau der Ameisensäure langsamer erfolgt als die Bildung, kommt es im Körper zu einer Akkumulation von Ameisensäure und in deren Folge zu einer metabolischen Azidose, die neben der Schädigung des Sehnervs schließlich zum Tod führen kann.[12] Bei den bekannten Fällen von Methanolvergiftung handelte es sich fast ausschließlich um Fälle, die durch den Genuss von mit Methanol versetzten Alkoholika verursacht wurden.
Regulation
Die Regulation, also das Umschalten zwischen aerober Zellatmung und anaerober Gärung, ist ein aktuelles Forschungsthema. Es kann kein generelles Regulationsschema nach dem System 'Schalter umlegen, wenn es an X mangelt' aufgestellt werden. Unterschiede zwischen einzelnen Hefe-Stämmen sind vorhanden, und weitere Abläufe bei Pflanzen und Bakterien. Forscher sind dabei, die unterschiedlichen Reaktionswege zu klären.[13] Eine Hauptrolle spielen der Sauerstoffgehalt und der Glucosespiegel.
Außerdem gibt es beispielsweise in S. cerevisiae zwei Gene für das cytosolische Enzym Alkoholdehydrogenase und dadurch zwei leicht unterschiedliche Enzyme, ADH1 und ADH2. Beide Enzyme können Acetaldehyd in Ethanol umsetzen und umgekehrt. Durch kleine Unterschiede in ihrer Molekularstruktur geschieht dies mit unterschiedlicher Geschwindigkeit. ADH1 kann schneller Ethanol aufbauen, während ADH2 schneller Ethanol abbaut. Das Vorhandensein der Enzyme wird durch Transkriptionsfaktoren reguliert, die das Ablesen des jeweiligen Gens steuern.[14] ADH1 für den Ethanolaufbau ist ständig vorhanden. Fällt der Glucosespiegel drastisch ab, so wird das Enzym ADH2 hergestellt, das Ethanol (wenn Sauerstoff vorhanden ist) zur Energiegewinnung abbauen kann und damit die Hefe am Leben erhält. Hefe kann Ethanol aufbauen, wenn genügend Zucker vorhanden ist, und dieses Ethanol später selbst wieder abbauen, wenn sie dringend Energie benötigt. Evolutionär gesehen hat sie damit einen Vorteil: sie vergiftet alle Nahrungskonkurrenten mit Ethanol und verarbeitet diesen anschließend selbst wieder. Die Entstehung der beiden Gene für ADH1 und ADH2 ist vermutlich auf Genduplikation eines gemeinsamen Ursprungsgenes zurückzuführen. In anderen Spezies gibt es auch mehr als zwei Alkoholdehydrogenasen.
Energiebilanz
Da unter anoxischen Bedingungen die Zellatmung mit Atmungskettenphosphorylierung von ADP zu ATP nicht abläuft, ist die einzige Energiequelle für Hefe unter diesen Bedingungen die Glykolyse mit ATP-Bildung durch Substratphosphorylierung. Sie liefert pro Molekül Glucose zwei Moleküle ATP. Im Vergleich dazu würde die Zellatmung 32 Moleküle ATP produzieren.
Würde der Abbau von Glucose beim Pyruvat stoppen, so käme der Prozess bald zum Erliegen, da durch den NAD+-Verbrauch in der Glykolyse ein NAD+-Mangel eintreten würde. NAD+ liegt in der Zelle nur in Spuren vor und muss ständig regeneriert werden. Dazu wird in der alkoholischen Gärung Pyruvat decarboxyliert und der dadurch entstandene Acetaldehyd mit NADH zu Ethanol reduziert, wobei NADH zu NAD+ oxidiert wird. Nimmt man die gesamte Reaktionsfolge von der Glucose bis zum Ethanol, so entsteht kein energiereiches NADH. Betrachtet man den Kohlenstoff, so verändert sich bei einem Drittel seine Oxidationszahl von 0 (in Glucose) zu +4 (Kohlenstoffdioxid) und bei zwei Dritteln zu −2 (Ethanol). Damit ist die alkoholische Gärung eine Disproportionierung als Sonderfall der Redoxreaktionen.
Die Änderung der Freien Energie beträgt unter Standardbedingungen, jedoch pH 7 statt 0, bei der alkoholischen Gärung ΔG0' = – 218 kJ je Mol Glucose, bei der Zellatmung – 2822 kJ je Mol Glucose. Als Standardbedingungen wurden vereinbart: Temperatur 25 °C, Druck 1,013 bar, Konzentration der an der Umsetzung beteiligten Stoffe (Reaktanten) 1 mol/L mit Ausnahme der von Wasser, für die 55,6 mol/L (reines Wasser) vereinbart ist, und der von Gasen, für die eine Konzentration im Lösungsgleichgewicht mit einem Partialdruck von 1 bar in der Gasphase vereinbart ist. Bei biologischen Systemen wird allerdings für die H+-Ionen-Konzentration nicht die von Lebewesen nicht tolerierte Konzentration 1 mol/L entsprechend pH 0, sondern 10−7 mol/L entsprechend pH 7 vereinbart. Weichen die tatsächlichen Bedingungen von diesen Standardbedingungen ab, so ist der Betrag der Änderung der Freien Energie ein anderer, er kann erheblich vom Standardwert abweichen. In lebenden Systemen sind Standardbedingungen in der Regel nicht gegeben und ändern sich oft auch während der Stoffumsetzung. Der Betrag der Änderung der Freien Energie unter Standardbedingungen bietet also bei Lebewesen lediglich einen Anhaltspunkt für die bei einer chemischen Stoffumsetzung frei werdende Energie.
Andere Substrate
Neben Glucose können auch andere Einfachzucker durch die Glykolyse und damit durch die alkoholische Gärung verarbeitet werden. Jedoch haben die meisten Hefen eine besondere Affinität zu Glucose (sie sind „glucophil“), so dass bei der alkoholischen Gärung von Traubenmost, der Glucose und Fructose in gleichen Teilen enthält, bevorzugt die Glucose abgebaut wird. Ist der fertige Wein dann noch restsüß, weil nicht aller Zucker zu Alkohol abgebaut worden ist, so besteht der Großteil des verbliebenen Zuckers aus Fructose. Dies ist insbesondere für Diabetiker von Interesse.
D-Fructose kann zum einen von einer Hexokinase, dem ersten Enzym der Glykolyse, ebenso wie Glucose phosphoryliert und damit in die Glykolyse eingeschleust werden. Auf einem alternativen Weg wird die Fructose von dem Enzym Fructosekinase zu Fructose-1-phosphat umgesetzt, welches von der Fructose-1-phosphataldolase weiter zu Dihydroxyacetonphosphat abgebaut wird. Dieses findet wiederum direkt in der Glykolyse Verwendung.
D-Galactose kann über die Zwischenstufen Galactose-1-phosphat und UDP-Galactose in Glucose-6-phosphat umgewandelt werden, die wie gewohnt in die Glykolyse fließt.
Neben Einfachzuckern können auch Zweifachzucker verarbeitet werden, sofern Enzyme vorhanden sind, die sie in ihre Bestandteile aufspalten. So wird Saccharose von der Invertase in ihre Bestandteile Glucose und Fructose zerlegt, die wie beschrieben in die Glykolyse eingehen. Ebenso geschieht es mit Lactose, die von dem Enzym β-Galactosidase in Galactose und Glucose gespalten wird. Gleiches gilt für Polysaccharide. Um etwa Stärke aus Getreide zu nutzen, werden die Samen zum Keimen gebracht. Das pflanzeneigene Enzym Amylase spaltet die Stärke in Maltose, welche wiederum von der Hefe verarbeitet werden kann.
Alternativer Weg
Das Bakterium Zymomonas mobilis ist ebenfalls in der Lage, aus Glucose Ethanol zu produzieren. Es nutzt dafür nur einen Teil des oben beschriebenen Stoffwechselwegs. Statt durch Glykolyse wird die Glucose hier durch den Entner-Doudoroff-Weg zu Pyruvat und Glycerinaldehyd-3-phosphat abgebaut.[15] Das Glycerinaldehyd-3-phosphat kann in die Glykolyse eingeleitet und ebenfalls zu Pyruvat abgebaut werden. Die letzten beiden Schritte der alkoholischen Gärung entsprechen denen bei Hefen. Aus einem Molekül Glucose kann nur ein Molekül ATP gewonnen werden. Die Gärung läuft auf diesem Weg aber schneller als über den von Hefen genutzten und erzielt eine höhere Ausbeute. Z. mobilis wird zur Herstellung von Pulque aus Agavensaft eingesetzt.
Gärungsnebenprodukte
Gärungsnebenprodukte oder alkoholische Begleitstoffe entstehen neben Ethanol und Kohlendioxid bei der alkoholischen Gärung. Einige dieser Nebenprodukte werden als Fuselöle bezeichnet.[16] Sie können auch bei Vergären einer reinen Glucoselösung festgestellt werden. Beim Bierbrauen zeigt der Geschmacksunterschied zwischen Würze und Jungbier oder Bier an, dass Gärungsnebenprodukte entstanden sind. Sie enthalten beispielsweise höhere Alkohole wie n-Propanol, Isobutanol, 2-Methylbutanol, 3-Methylbutanol und aromatische Alkohole wie 2-Phenylethanol, Tyrosol oder Tryptophol. Daneben treten Ester wie Ethylacetat, Phenylacetat und i-Amylacetat auf. Carbonylverbindungen wie Aldehyde, beispielsweise Acetaldehyd, Propanal, Butanal oder Furfural, sowie Ketone und Diketone. Schwefelverbindungen wie H2S, SO2, Ethylmercaptan und Methylmercaptan treten in kleinen Mengen auf.
Weiterhin werden auch Organische Säuren wie Essigsäure, Milchsäure, Brenztraubensäure, 2-Acetomilchsäure und Fettsäuren (C4-C12) gebildet. Auch mehrwertige Alkohole wie Glycerin, 2,3-Butandiol und 2,3-Pentandiol kommen als Gärungsnebenprodukte vor. Bei den aufgeführten Stoffen handelt es sich um die wichtigsten Vertreter der einzelnen Gruppen.
Natürliches Auftreten

Überall in der Natur findet man Mikroorganismen. So ist auch Obst überzogen mit Bakterien und Hefen, die man durch einfaches Waschen nicht komplett entfernen kann. Liegt Obst nach der Ernte länger in warmer Umgebung, vermehren sich diese Mikroorganismen. Sie bauen Zellstrukturen ab und dringen ins Innere der besiedelten Frucht ein. Sichtbar wird dies beispielsweise als weiche Stelle oder brauner Fleck auf einem Apfel. Während dieser Zersetzungsprozesse kann es stellenweise, besonders im Inneren der Frucht, zu Sauerstoffmangel kommen. Die dort lebenden Hefezellen stellen ihren Stoffwechsel auf alkoholische Gärung um. Auf diese Weise ist es möglich, dass verdorbene Früchte einen erheblichen Anteil Alkohol enthalten können.
Bis Mitte des 19. Jahrhunderts war gänzlich unbekannt, dass sich die natürlicherweise auf der Frucht siedelnden Wildhefen vermehren und aus dem Zucker der Flüssigkeit Alkohol bilden. Bei manchen Winzern wird es bis heute so gehandhabt, dass sich nach dem Pressen von Trauben zu Maische alle zufällig auf den Schalen siedelnden Hefestämme in der Flüssigkeit vermehren sollen. Dies wird als Spontangärung bezeichnet. Erst im 20. Jahrhundert wurden bei der Weinherstellung Zuchthefen verwendet. Ohne Zusatz von Reinzuchthefe dauert es etwas länger, da die Konzentration der natürlichen Hefen anfangs sehr gering ist. Auch bleibt das Resultat weitgehend dem Zufall überlassen, der Wein erhält durch die verschiedenen Wildhefen eine individuellere Note. Diese Hefestämme können sich zudem je nach Anbaugebiet der Trauben unterscheiden, weshalb auf diese Weise hergestellte Weine geschmacklich eher einem Anbaugebiet zugeordnet werden können. Häufig vorkommende Hefearten sind Kloeckera apiculata und Saccharomyces exiguus. Verlassen sich Winzer auf die natürlichen Hefen, laufen sie Gefahr, dass sich auch unerwünschte auf der Traubenschale lebende Hefen und Bakterien während des Herstellungsprozesses vermehren. Nehmen sie überhand, verdirbt die Maische. Seit langem werden deswegen besonders geeignete Hefestämme gezüchtet, um die gewünschten Weinaromen zu erzeugen. Diese Reinzuchthefen bestehen nur aus einem Hefestamm und sind oft auf eine Traubensorte spezialisiert. Seit die Gefriertrocknung zur Konservierung von Hefen nutzbar ist, sind solche Reinzuchthefen ohne weiteres in großen Mengen käuflich, viele Monate haltbar und einfach zu handhaben. Setzt man sie zu Anfang der Gärung in ausreichender Menge zu, so steigt der Alkoholspiegel schnell an und die unerwünschten Wildhefen sterben ab.
Nutzung durch den Menschen
Reinzuchthefen
Zur alkoholischen Gärung nutzt man heute zumeist Reinzuchthefen. Je nach Gärungsbedingungen wird ein geeigneter Hefestamm gewählt, um das gewünschte Ergebnis zu erhalten. Zum Schutz hitzesensibler Inhaltsstoffe kann die Gärung durch Kaltgärhefe bei niedrigen Temperaturen (15–20 °C) durchgeführt werden. Für Portwein und Sherry werden alkoholtolerante Hefen eingesetzt, damit diese Getränke einen Alkoholgehalt bis 16 % erreichen. Zum Abschluss der Gärung wird mit Neutralalkohol der endgültige Alkoholgehalt eingestellt. Neu auf dem Markt sind „Turbohefen“. Sie haben eine noch höhere Alkoholtoleranz und schaffen unter optimalen Bedingungen bis zu 20 % Alkoholgehalt. Getränke mit einem noch höheren Alkoholgehalt erhalten diesen durch Destillation („Brennen“), durch Zusatz von Neutralalkohol, der wiederum durch Destillation aus vergorenen Rohstoffen entstand, oder durch Ausfrieren von Wasser.
Für Alkoholgehalte oberhalb von etwa 15–16 % reicht der Zuckergehalt reiner Fruchtsäfte nicht aus, sondern es muss Zucker zugesetzt werden.[17][18] Turbohefen werden meist eingesetzt, um bei der Gärung relativ hohe Alkoholanteile ohne nennenswerten Geschmack zu erzeugen, die durch anschließende Destillation weiter erhöht werden. Ihr Einsatz bei der Herstellung von Wein oder Obstbränden ist nicht möglich, da laut Gesetz dem Fruchtsaft für diese Produkte kein Zucker zugesetzt werden darf.
Getränke
Es gibt eine Vielzahl alkoholischer Getränke, deren Alkoholgehalt auf alkoholische Gärung zurückgeht. Voraussetzung ist in jedem Fall ein zuckerhaltiger Ausgangsstoff.
Bier

Beim Bier ist der Ausgangsstoff Stärke, zumeist aus Getreide, die in einem ersten Schritt in Zucker aufgespalten wird (Verzuckerung). Das heute beim Bierbrauen häufigste Verfahren zur Verzuckerung der Stärke ist, dass zunächst durch Mälzen Enzyme im Braugetreide aktiviert werden, die dann beim Maischen die Stärke in Maltose (Malzzucker) spalten. Beim Zubereiten der Würze wird der Zucker gelöst. Die abgekühlte Würze wird mit Hefe versetzt und dadurch zum Gären gebracht. Dabei wird die Maltose von der Brauhefe (z. B. S. cerevisiae, Saccharomyces uvarum = obergärig, Saccharomyces carlsbergensis = untergärig) zu Ethanol und Kohlenstoffdioxid abgebaut.
Wein

Als Grundstoff für die Herstellung von Wein dient zuckerhaltiger Traubensaft. Die Weinhefe kann bei einer Zuckerkonzentration bis 250 g pro Liter gären, darüber hinaus ist der osmotische Druck zu groß und das Wasser wird aus den Hefezellen gezogen. Um das Wasser möglichst lange in den Zellen zu halten, produziert die Hefe kompatible Solute, hauptsächlich Glycerin. Die Hefe kann Zucker nur bis zu einem bestimmten Alkoholgehalt vergären; bei höheren Gehalten stirbt sie ab. Der genaue Grenzwert ist abhängig von der Hefe und liegt zwischen 5 % und 23 %. Der Ethanolgehalt schützt den Wein schon während der Gärung vor Schimmelpilzen und anderen unerwünschten Mikroorganismen. Gegen Ende wird die Gärung oft unter Luftabschluss in reduktivem Zustand gehalten, damit Acetaldehyd in Ethanol und Kohlenstoffdioxid hydriert wird. Dabei soll eine Oxidation der Aromen und die Weiteroxidation des Ethanol zu Essigsäure durch Bakterien verhindert werden. Hierbei entweicht Kohlenstoffdioxid.[19] Saisonal wird in Gärung befindlicher Traubenmost als Neuer Wein („Federweißer“) im Handel angeboten.
Schaumwein
Bei der Herstellung von Schaumwein wird ein Grundwein mit Restzuckergehalt von höhervergärenden Hefestämmen (Saccharomyces bayanus), die auch als Nachgär-, Sekt- oder Champagnerhefen bezeichnet werden, in einem Druckbehälter (z. B. in der Flasche), weiter vergoren. Dadurch wird das Entweichen des entstehenden Kohlendioxids verhindert.[20]
Backwaren

Eine der wichtigsten Anwendungsgebiete der Gärung ist die Herstellung von Backwaren. Backhefe (Saccharomyces cerevisiae) wird bei der Herstellung beinahe aller Brot- und Brötchensorten sowie von traditionellem Kuchen mit Hefeteig zur Teigauflockerung verwendet. Während der Teig „geht“, entsteht durch alkoholische Gärung das Gas Kohlenstoffdioxid. Dieses verteilt sich fein im Teig und kann dessen Volumen beträchtlich vergrößern. Das entstandene Ethanol verdampft beim anschließenden Backprozess,[21] zu dessen Beginn die Hefe auf Grund der hohen Temperaturen abstirbt. Toastbrot kann trotzdem bis zu 2,8 Vol.% Alkohol enthalten, wenn nach dem Backprozess Alkohol als Konservierungsmittel zugefügt wurde.[22]
Weitere Lebensmittel

Ein alkoholhaltiges Lebensmittel ist der aus Milch gewonnene Kefir. Zu seiner Herstellung dienen Kefirknollen, eine Mischung aus verschiedenen Arten symbiotisch lebender Hefen und Bakterien. Die in der Milch enthaltene Lactose wird von den Bakterien über Milchsäuregärung zu Milchsäure und von den Hefen über alkoholische Gärung zu Ethanol abgebaut. Der Alkoholgehalt kann je nach Gärdauer 0,2 bis etwa 2 % betragen. Bei asiatischen Steppenvölkern wird traditionell Kumys, vergorene Stutenmilch, getrunken.
Industrie

Ethanol wird auch als Fahrzeugtreibstoff verwendet. Außerdem wird er in vielen technischen Verfahren benutzt, ist Ausgangsstoff für chemische Synthesen oder dient zur Desinfektion. Dieser Ethanol wird ebenfalls durch alkoholische Gärung von Hefe hergestellt. Grundstoffe sind billiges Getreide oder Kartoffeln, deren Stärke durch großtechnisch hergestellte Enzyme zu Zucker gespalten wird. Auch hier kann durch Gärung ein maximaler Alkoholgehalt von 23 % nicht überschritten werden. Die anschließende Kolonnen-Destillation liefert einen Gehalt von 96 % (Azeotrop). Da auf diese Weise hergestellter Alkohol genießbar wäre, unterliegt er in Deutschland ebenfalls der Branntweinsteuer. Eine Ausnahme macht der zur Treibstoffproduktion eingesetzte Ethanol, der strengsten behördlichen Kontrollen unterliegt. Ebenfalls keine Branntweinsteuer muss auf vergällten Ethanol gezahlt werden. Zum Vergällen werden in geringem Umfang Methylethylketon und andere Stoffe zugesetzt. Er wird dadurch ungenießbar und dies schließt den Verbrauch in Lebensmitteln und Getränken aus.
Literatur
- Gerolf Annemüller, Hans-Jürgen Manger, Peter Lietz: Die Hefe in der Brauerei. Hefemanagement, Kulturhefe – Hefereinzucht, Hefepropagation im Bierherstellungsprozess. Versuchs- und Lehranstalt für Brauerei (VLB), Berlin 2005, ISBN 3-921690-50-1.
- Ernst E. Bruchmann: Angewandte Biochemie. Lebensmittelchemie, Gärungschemie, Agrarchemie. Ulmer, Stuttgart 1976, ISBN 3-8001-2301-0 (etwas veraltet).
- Helmut Hans Dittrich, Manfred Großmann: Mikrobiologie des Weines. 3. Auflage. Ulmer, Stuttgart 2005, ISBN 3-8001-4470-0.
- Adam Maurizio: Geschichte der gegorenen Getränke. Reprint. Sändig, 1993, ISBN 3-253-02199-8.
- Lubert Stryer: Biochemie. 6. Auflage. Spektrum, Heidelberg 2007, ISBN 978-3-8274-1800-5.
Einzelnachweise
- E. Racker: History of the Pasteur effect and its pathobiology. In: Mol Cell Biochem. 5(1–2), 1974, S. 17–23. PMID 4279327. doi:10.1007/BF01874168
- Eduard Buchner: Alkoholische Gärung ohne Hefezellen. In: Berichte der deutschen chemischen Gesellschaft. 30, 1897, S. 1110–1113, doi:10.1002/cber.189703001215.
- E. Negelein, H. J. Wulff: Diphosphopyridinproteid, Alkohol, Acetaldehyd. In: Biochemische Zeitschrift. Springer, Berlin 293, 1937, S. 352–389.
- Klaus Koschel: Die Entwicklung und Differenzierung des Faches Chemie an der Universität Würzburg. In: Peter Baumgart (Hrsg.): Vierhundert Jahre Universität Würzburg. Eine Festschrift. (= Quellen und Beiträge zur Geschichte der Universität Würzburg. Band 6). Degener & Co. (Gerhard Gessner), Neustadt an der Aisch 1982, ISBN 3-7686-9062-8, S. 703–749; hier: S. 729.
- W. Furey u. a.: Structure-function relationships and flexible tetramer assembly in pyruvate decarboxylase revealed by analysis of crystal structures. In: Biochimica et Biophysica Acta (BBA). Springer, Berlin 1385, 2, 1998, S. 253–270. PMID 9655915.
- H. Eklund u. a.: Crystallographic investigations of alcohol dehydrogenases. In: EXS. Birkhäuser, Berlin 71, 1994, S. 269–277. PMID 8032158.
- P. C. Hinkle: P/O ratios of mitochondrial oxidative phosphorylation. In: Biochimica et Biophysica Acta (BBA). Springer, Berlin 706, 1–2, 2005, S. 1–11. PMID 15620362.
- J. P. van Dijken, R. A. Weusthuis, J. T. Pronk: Kinetics of growth and sugar consumption in yeasts. In: Antonie Van Leeuwenhoek. In: International journal of general and molecular microbiology. Springer, Dordrecht 63, 3–4, 1993, S. 343–352. PMID 8279829.
- K. Tonomura: Ethanol fermentation in bacteria. In: Seikagaku. The journal of Japanese Biochemical Society. Gakkai, Tokyo 59, 10, 1987, S. 1148–1154. ISSN 0037-1017
- T. W. Kimmerer, R. C. McDonald: Acetaldehyde and Ethanol Biosynthesis in Leaves of Plants. In: Plant Physiology. Rockville Md 84, 4, 1987, S. 1204–1209, PMC 1056752 (freier Volltext, PDF).
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 378–379.
- E. Oberdisse, E. Hackenthal, K. Kuschinsky: Pharmakologie und Toxikologie. Springer, 2002, Berlin, Heidelberg, New York, ISBN 978-3-642-62634-0, S. 791.
- J. Piskur u. a.: How did Saccharomyces evolve to become a good brewer? In: Trends in Genetics. Elsevier, Amsterdam 22, 4, 2006, S. 183–186. PMID 16499989.
- J. Blom, M. J. De Mattos, L. A. Grivell: Redirection of the Respiro-Fermentative Flux Distribution in Saccharomyces cerevisiae by Overexpression of the Transcription Factor Hap4p. In: Applied and Environmental Microbiology. Washington DC 66, 5, 2000, S. 1970–1973, Volltext als pdf.
- T. Conway: The Entner-Doudoroff pathway, history, physiology and molecular biology. In: Federation of European Microbiological Societies. Blackwell, Oxford 9, 1, 1992, S. 1–27. PMID 1389313.
- Lebensmittel-Lexikon, herausgegeben von Waldemar Ternes. books.google.de, abgerufen am 19. November 2009.
- mondovino.ch: Steigender Alkoholgehalt bei Wein
- weinimwww.de: Wie hoch soll der Alkoholgehalt eines Weines sein – und was sagt er aus?
- Helmut Hans Dittrich, Manfred Großmann: Mikrobiologie des Weines. 3. Auflage. Verlag Eugen Ulmer, Stuttgart 2005, S. 39.
- Helmut Hans Dittrich, Manfred Großmann: Mikrobiologie des Weines. 3. Auflage. Verlag Eugen Ulmer, Stuttgart 2005, S. 22 und 42
- focus.de
- Untersuchung des Kantonalen Labors der Gesundheitsdirektion in Zürich cleankids.de