Saccharose
Saccharose [zaxaˈroːzə] (zu lateinisch saccharum bzw. altgriechisch σάκχαρον sákcharon, „Zucker“), umgangssprachlich Haushaltszucker, Kristallzucker oder einfach Zucker genannt, ist ein Disaccharid und Kohlenhydrat. Andere Bezeichnungen für Saccharose sind Rohrzucker, Rübenzucker, Raffinadezucker oder raffinierter Zucker, brauner Zucker (im karamellisierten raffinierten Zustand), Rohzucker (im zwar auch oft braunen, aber nicht damit zu verwechselnden unraffinierten Zustand) und Sukrose oder Sucrose.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Kristallsystem |
monoklin-sphenoidisch | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Saccharose | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H22O11 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser kristalliner Feststoff mit süßem Geschmack[2][3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 342,30 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,57 g·cm−3 (30 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser (4,87 g je g Wasser bei 100 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||

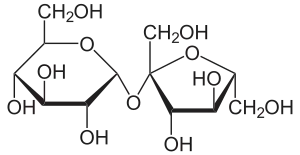
Vor allem Zuckerrübe, Zuckerrohr und Zuckerpalme enthalten dieses Disaccharid in wirtschaftlich nutzbaren Mengen. In Saccharose sind je ein Molekül α-D-Glucose und β-D-Fructose über eine α,β-1,2-glycosidische Bindung verbunden.
Die Konstitution wurde von Walter Norman Haworth aufgeklärt.[4]
Vorkommen, Gewinnung und Bedeutung in Pflanzen


Saccharose wird von vielen Pflanzen mittels Photosynthese gebildet, für die Gewinnung des Haushaltszuckers sind vor allem Zuckerrüben, Zuckerrohr und Zuckerpalme (vornehmlich in Indonesien) von Bedeutung. In kleineren Mengen wird Saccharose auch aus dem Saft des Zuckerahorns gewonnen. Zudem bildet der ausschließlich oder überwiegend Saccharose enthaltende Phloemsaft vieler Pflanzen die Grundlage der Honigproduktion – indem die Bienen entweder direkt pflanzliche Absonderungen wie Nektar oder aber die Honigtau genannten Ausscheidungen von Phloemsaft saugenden Insekten (v. a. Schnabelkerfen wie Blattläusen, Schildläusen, Blattflöhen, Mottenschildläusen sowie verschiedener Zikaden) sammeln.[6]
Biosynthese
Die Biosynthese von Saccharose erfolgt im Cytoplasma von Pflanzenzellen aus den Hexose-Intermediaten UDP-Glucose und Fructose-6-phosphat. Die beiden Monosaccharide werden aus Triosephosphaten gebildet, die als Nettogewinn bei der Kohlenstoffassimilation der Photosynthese (Calvin-Zyklus) im Chloroplasten entstehen. Die beiden Triosephosphate Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat werden entweder im Chloroplasten zur Synthese von Stärke (Speicherstärke) verwendet oder aus dem Chloroplasten ins Cytosol exportiert, wo daraus Hexosen entstehen, die der Synthese von Saccharose (oder weiteren Kohlenhydraten oder Aminosäuren) dienen.
Dazu wird zuerst Fructose-1,6-Bisphosphat durch eine Kondensationsreaktion zwischen Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat gebildet, das dann durch Dephosphorylierung zu Fructose-6-P umgesetzt wird. Aus Fructose-6-P wird durch Isomerisierung auch Glucose-6-P gebildet, das durch anschließende Reaktion (nach voriger Umisomerisierung zu Glucose-1-phosphat) mit Uridintriphosphat (UTP) zu Uridindiphosphat-Glucose (UDP-Glucose) aktiviert wird.
Die folgende Kondensation von UDP-Glucose und Fructose-6-P zu Saccharose-6-phosphat wird von dem Enzym Saccharose-phosphat-Synthase katalysiert. Die dafür nötige Energie bringt die Abspaltung von Uridindiphosphat (UDP). Zuletzt wird der Phosphatrest in einer irreversiblen Reaktion durch das Enzym Saccharose-phosphat-Phosphatase abgespalten, sodass Saccharose entsteht.
Bedeutung als Transportzucker
Saccharose ist der wichtigste Transportzucker in Pflanzen. Dazu eignet sie sich besser als freie Hexosen, da sie als nicht-reduzierendes Disaccharid chemisch inert ist. Die durch die Photosynthese in grünen Pflanzenzellen bei Licht entstehende Saccharose gelangt durch passiven Transport in den Apoplasten und anschließend durch aktiven Transport in das assimilatleitende Phloem der pflanzlichen Leitgewebe. Im Phloem wird sie zu anderen, nicht-photosynthetischen Geweben, wie z. B. Wachstumszonen oder Speichergeweben, transportiert.
Andere Transportzucker sind in manchen Pflanzenfamilien (z. B. Kürbisgewächse, Walnussgewächse) Raffinosen.
Abbau und Verwertung
Für den Saccharose-Abbau in den Zielgeweben gibt es unterschiedliche Möglichkeiten.
In Wachstumszonen wie Spross- und Wurzelspitze (Meristeme) wird Saccharose aus dem Phloem symplasmatisch durch Plasmodesmata transportiert. In den Zellen wird sie in Umkehr der Synthesereaktion durch das Enzym Saccharose-Synthase mit UDP zu UDP-Glucose und Fructose gespalten. Die beiden Hexosen können zu Glucose-6-P umgeformt und z. B. zur Energiegewinnung in die Glycolyse eingeführt werden.
In Speichergeweben wird Saccharose apoplastisch aus dem Phloem zu den Zielzellen transportiert. Sie kann durch aktiven Transport in die Zelle aufgenommen werden und dort von der Saccharose-Synthase abgebaut werden. Der Großteil wird jedoch in der Zellwand von Invertasen in Glucose und Fructose gespalten. Die beiden Monosaccharide können durch Symporter von der Zelle aufgenommen werden, wo sie als Glucose-6-P in den Chloroplasten transportiert und zur Synthese von Speicherstärke verwendet werden.
Eigenschaften
Chemische Eigenschaften
Die Saccharose gehört wie andere Zuckerarten zu den Kohlenhydraten. Sie ist ein Disaccharid (Zweifachzucker). Saccharose entsteht unter Wasserabspaltung aus je einem Molekül α-D-Glucose (Pyranoseform) und β-D-Fructose (Furanoseform). Diese beiden Moleküle sind über eine α,β-1,2-glycosidische Bindung miteinander verbunden (Glucose α1-2 Fructose).
Saccharose ist ein nicht-reduzierendes Disaccharid. Nicht-reduzierende Disaccharide sind über ihre beiden anomeren C-Atome O-glycosidisch miteinander verknüpft, ihre chemische Bezeichnung endet mit -sid. Dies bedeutet, dass im Saccharose-Molekül die beiden Komponenten so miteinander verbunden vorliegen, dass keine Aldehydgruppe unter Ringöffnung (weder vom Glucose- noch vom Fructose-Molekül) gebildet werden kann. Diese nicht-reduzierenden Atomgruppierungen nennt man Acetale. Acetale sind im Gegensatz zu Halbacetalen vergleichsweise stabil in basischem und neutralem Milieu. Sie sind nur durch Säurekatalyse zu öffnen, wobei das Disaccharid z. T. in Monosaccharide gespalten wird, es entsteht Invertzucker (stoffmengengleiche Teile Glucose und Fructose). Saccharose zeigt aufgrund der in neutralem Milieu unterbleibenden Ringöffnung fast keine Mutarotation.
Saccharose zeigt daher bei der Fehling-Probe eine negative Nachweisreaktion.
Erhitzung und Verbrennung

Beim Erhitzen von Saccharose auf 185 °C schmilzt sie und bildet unter Zersetzung eine braun werdende Schmelze (Karamell).
Die spezifische Wärmekapazität von Saccharose beträgt etwa 1,24 kJ / (kg K).[7]
Wasserlöslichkeit
Saccharose ist in Wasser sehr gut löslich. Die Löslichkeit ist, wie bei den meisten Feststoffen, temperaturabhängig:
| Temperatur in °C | ω Saccharose / % | g Saccharose / kg Wasser | Dichte in g / cm³ |
|---|---|---|---|
| 0 | 64,18 | 1792 | 1,31490 |
| 5 | 64,87 | 1847 | 1,31920 |
| 10 | 65,58 | 1905 | 1,32353 |
| 15 | 66,30 | 1970 | 1,32804 |
| 20 | 67,09 | 2039 | 1,33272 |
| 25 | 67,89 | 2114 | 1,33768 |
| 30 | 68,70 | 2195 | 1,34273 |
| 35 | 69,55 | 2284 | 1,34805 |
| 40 | 70,42 | 2381 | 1,35353 |
| 45 | 71,32 | 2487 | 1,35923 |
| 50 | 72,25 | 2604 | 1,36515 |
| 55 | 73,20 | 2731 | 1,37124 |
| 60 | 74,18 | 2873 | 1,37755 |
| 65 | 75,18 | 3029 | 1,38404 |
| 70 | 76,22 | 3205 | 1,39083 |
| 75 | 77,27 | 3399 | 1,39772 |
| 80 | 78,36 | 3621 | 1,40493 |
| 85 | 79,46 | 3868 | 1,41225 |
| 90 | 80,61 | 4157 | 1,41996 |
| 95 | 81,77 | 4486 | 1,42778 |
| 100 | 82,87 | 4872 | 1,43594 |
Bei 20 °C erhält man eine Lösung mit 67 % Massenanteil (ω) (Dichte 1,33 kg/l), bei 100 °C dagegen eine 83 Gew.-%ige gesättigte Lösung mit 83 % Massenanteil (ω) (Dichte 1,44 kg/l), die beim Abkühlen jedoch keine Kristalle mehr ausscheidet („gehinderte Kristallisation“). Anzumerken sei noch, dass eine Lösung mit 60 % Massenanteil (ω) bei 105 °C, eine Lösung mit 80 % Massenanteil (ω) bei 113 °C und eine Lösung mit 90 % Massenanteil (ω) bei 132 °C siedet. (Letztere Werte entnommen aus dem Phasendiagramm von Saccharose und Wasser bei 100 kPa).
Drehung von polarisiertem Licht
Saccharose ist chiral und daher optisch aktiv: In wässriger Lösung dreht Saccharose polarisiertes Licht im Uhrzeigersinn (spezifischer Drehwinkel α = +66,5°·ml·dm−1·g−1[9]). Durch Spaltung von Saccharose entsteht ein Gemisch (Invertzucker), das halb aus Glucose und halb aus Fructose besteht. Diese Mischung dreht polarisiertes Licht gegen den Uhrzeigersinn (spezifischer Drehwinkel α = −20°·ml·dm−1·g−1), man beobachtet also eine Umkehrung der Drehungsrichtung („Inversion“); das 1:1-Gemisch aus Fructose und Glucose wird daher auch als Invertzucker bezeichnet.[10]
Analytik
Die zuverlässige qualitative und quantitative Bestimmung der Saccharose gelingt nach angemessener Probenvorbereitung in Urin und Blutplasma durch Kopplung der Hochleistungsflüssigkeitschromatographie mit der Massenspektrometrie.[11][12] Zur Bestimmung in pflanzlichem Material kann auch die Kopplung der Gaschromatographie mit der Massenspektrometrie eingesetzt werden. Dabei werden die zu bestimmenden Zucker in flüchtige Trimethylsilylderivate umgewandelt.[13]
Süßkraft
Die Süßkraft ist eine dimensionslose Größe, welche die relative Süße eines Stoffes angibt. Die Werte der Süßkraft beziehen sich dabei auf Saccharose, welcher eine Süßkraft von 1 zugeordnet wird.[14] Die Süßkraft dient einem halbquantitativen Vergleich insbesondere zu anderen natürlichen oder künstlichen Süßungsmitteln. Süßungsmittel können eine mehrere hundert- oder tausendfache Süßkraft gegenüber Saccharose aufweisen. Interessanterweise gehört ein Derivat der Saccharose, D-(+)-Saccharoseoctaacetat, zu den bittersten bekannten Verbindungen.
Verwendung von Zucker als Lebensmittel
Saccharose wird traditionell in vielfältiger Form als Lebensmittel und Lebensmittelzusatz verwendet.
| Nahrungsmittel | Gesamtkohlenhydrate inkl. Ballaststoffe |
Gesamtzucker | Fructose | Glucose | Saccharose | Fructose/ Glucose Verhältnis |
Saccharose in % des Gesamtzuckers |
|---|---|---|---|---|---|---|---|
| Früchte | |||||||
| Apfel | 13,8 | 10,4 | 5,9 | 2,4 | 2,1 | 2,0 | 19,9 |
| Aprikose | 11,1 | 9,2 | 0,9 | 2,4 | 5,9 | 0,7 | 63,5 |
| Banane | 22,8 | 12,2 | 4,9 | 5,0 | 2,4 | 1,0 | 20,0 |
| Feige, getrocknet | 63,9 | 47,9 | 22,9 | 24,8 | 0,9 | 0,93 | 0,15 |
| Trauben | 18,1 | 15,5 | 8,1 | 7,2 | 0,2 | 1,1 | 1 |
| Orange | 12,5 | 8,5 | 2,25 | 2,0 | 4,3 | 1,1 | 50,4 |
| Pfirsich | 9,5 | 8,4 | 1,5 | 2,0 | 4,8 | 0,9 | 56,7 |
| Birne | 15,5 | 9,8 | 6,2 | 2,8 | 0,8 | 2,1 | 8,0 |
| Ananas | 13,1 | 9,9 | 2,1 | 1,7 | 6,0 | 1,1 | 60,8 |
| Pflaume | 11,4 | 9,9 | 3,1 | 5,1 | 1,6 | 0,66 | 16,2 |
| Gemüse | |||||||
| Rote Beete | 9,6 | 6,8 | 0,1 | 0,1 | 6,5 | 1,0 | 96,2 |
| Karotte | 9,6 | 4,7 | 0,6 | 0,6 | 3,6 | 1,0 | 77 |
| Paprika | 6,0 | 4,2 | 2,3 | 1,9 | 0,0 | 1,2 | 0,0 |
| Zwiebel | 7,6 | 5,0 | 2,0 | 2,3 | 0,7 | 0,9 | 14,3 |
| Süßkartoffel | 20,1 | 4,2 | 0,7 | 1,0 | 2,5 | 0,9 | 60,3 |
| Yamswurzel | 27,9 | 0,5 | Spuren | Spuren | Spuren | – | Spuren |
| Zuckerrohr | 13–18 | 0,2 – 1,0 | 0,2 – 1,0 | 11–16 | 1,0 | hoch | |
| Zuckerrübe | 17–18 | 0,1 – 0,5 | 0,1 – 0,5 | 16–17 | 1,0 | hoch | |
| Getreide | |||||||
| Mais | 19,0 | 6,2 | 1,9 | 3,4 | 0,9 | 0,61 | 15,0 |
Wirkung von Zuckerkonsum auf den Organismus
Bis zur industriellen Revolution im 19. Jahrhundert war reiner Zucker breiten Bevölkerungsschichten in Mitteleuropa kaum zugänglich. Zucker wurde dem Körper hauptsächlich beim Genuss von Gemüse und Obst sowie von Honig zugeführt. Erst seit der Züchtung der Zuckerrübe um 1800 und dem Beginn der industriellen Raffination von Saccharose wurde der Organismus mit größeren Mengen von Zucker konfrontiert.
Hoher Zuckerkonsum kann, vor allem, wenn es sich um „freien“ Zucker (englisch: free sugars) handelt – gemeint sind Mono- und Disaccharide, die den Lebensmitteln vom Hersteller, Koch oder Verbraucher zugesetzt werden, und natürlicherweise in Honig, Sirup und Fruchtsäften enthaltener Zucker – zu Übergewicht und damit zu einem erhöhten Krankheitsrisiko für Diabetes mellitus führen.
Studien von John Yudkin legen nahe, dass zwischen der Aufnahme von Zucker und der Häufigkeit von Herzinfarkten ein Zusammenhang besteht. Es wird diskutiert, ob Zucker die Entstehung von Krebs fördert, und ob eine zuckerfreie Nahrung das Wachstum von Krebs behindern kann. Diese These hat einige Anhänger auch unter Ärzten, wird aktiv erforscht, und es gibt Initiativen für eine Krebsdiät, die auf zuckerfreier oder zuckerarmer Ernährung basiert.[16][17][18][19][20]
Fehlende oder ungenügende Zahnpflege nach dem Konsum von zuckerhaltigen Nahrungsmitteln führt zur Bildung von Zahnkaries. Viele Zuckerarten können von Bakterien im Mund zu zahnschädigenden Säuren umgewandelt werden. Insbesondere wird Saccharose vom Bakterium Streptococcus mutans zu Dextranen verarbeitet, mit deren Hilfe diese sich besonders hartnäckig an Zähne heften können.
Die Weltgesundheitsorganisation empfiehlt, dass der sogenannte freie Zucker höchstens 10 % der täglichen menschlichen Energieaufnahme ausmachen sollte, und idealerweise auf 5 % reduziert werden sollte.[21][22] Dies wird in Industriestaaten zumeist überschritten.
Weblinks
Einzelnachweise
- Eintrag zu SUCROSE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Mai 2020.
- Eintrag zu Saccharose in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. August 2015. (JavaScript erforderlich)
- Eintrag zu Saccharose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 1221.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 340.
- Helmut Horn, Cord Lüllmann: Das große Honigbuch. 3. Auflage. Kosmos, Stuttgart 2006, ISBN 3-440-10838-4, S. 29–30.
- Kontinuierliche Zuckerlöser. Abgerufen am 12. November 2020.
- C. A. Browne: Handbook of Sugar Analysis. John Wiley and Sons, New York 1912.
- Brockhaus ABC Chemie. Verlag Harry Deutsch, Frankfurt/ Zürich 1965.
- Adalbert Wollrab: Organische Chemie: Eine Einführung für Lehramts- und Nebenfachstudenten. Springer, 2014, ISBN 978-3-642-45144-7, S. 845.
- M. K. Miah, U. Bickel, R. Mehvar: Development and validation of a sensitive UPLC-MS/MS method for the quantitation of [(13)C]sucrose in rat plasma, blood, and brain: Its application to the measurement of blood-brain barrier permeability. In: J Chromatogr B Analyt Technol Biomed Life Sci. 1015-1016, 15. März 2016, S. 105–110. PMID 26919445
- P. Kubica, A. Kot-Wasik, A. Wasik, J. Namieśnik, P. Landowski: Modern approach for determination of lactulose, mannitol and sucrose in human urine using HPLC-MS/MS for the studies of intestinal and upper digestive tract permeability. In: J Chromatogr B Analyt Technol Biomed Life Sci. 907, 15. Oct 2012, S. 34–40. PMID 22985725
- S. Moldoveanu, W. Scott, J. Zhu: Analysis of small carbohydrates in several bioactive botanicals by gas chromatography with mass spectrometry and liquid chromatography with tandem mass spectrometry. In: J Sep Sci. 38(21), Nov 2015, S. 3677–3686. PMID 26315495
- Eintrag zu Süßstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Dezember 2012.
- Search the USDA National Nutrient Database for Standard Reference. Nal,usda,gov, abgerufen am 10. Dezember 2014.
- Ethan B. Butler, Yuhua Zhao, Cristina Muñoz-Pinedo, Jianrong Lu, Ming Tan: Stalling the engine of resistance: Targeting cancer metabolism to overcome therapeutic resistance. In: Cancer Research. Bd. 73, Nr. 9, 2013, S. 2709–2717, doi:10.1158/0008-5472.CAN-12-3009. Abgerufen am 13. März 2014.
- Linda C. Nebeling, Edith Lerner: Implementing a ketogenic diet based on medium-chain triglyceride oil in pediatric patients with cancer. In: Journal of the American Dietetic Association. Bd. 95, Nr. 6, 1995, S. 693–697, doi:10.1016/S0002-8223(95)00189-1. Abgerufen am 13. März 2014.
- U. Schroeder, B. Himpe, R. Pries, R. Vonthein, S. Nitsch, B. Wollenberg: Decline of Lactate in Tumor Tissue After Ketogenic Diet: In vivo microdialysis study in patients with head and neck cancer. In: Nutrition and Cancer. Bd. 65, Nr. 6, 2013, S. 843–849, doi:10.1080/01635581.2013.804579. Abgerufen am 13. März 2014.
- Ashraf Virmani, Luigi Pinto, Zbigniew Binienda, Syed Ali: Food, nutrigenomics, and neurodegeneration-neuroprotection by what you eat! In: Molecular Neurobiology. Bd. 48, Nr. 2, 2013, S. 353–362, doi:10.1007/s12035-013-8498-3. Abgerufen am 13. März 2014.
- Lisa Schönhaar: Wer Weniger Zucker zu sich nimmt entzieht Krebszellen die Nahrung – Studie zeigt: Ihr könnt jetzt schon eine kleine Veränderung in eurer Ernährung vornehmen, um später Krebs zu vermeiden. In: Business Insider. 16. Oktober 2017, abgerufen am 31. Mai 2019.
- Diet, Nutrition and the Prevention of Chronic Diseases (= WHO Technical Report Series. 916) table 6 auf S. 56.
- WHO guideline: sugar consumption recommendation. In: Weltgesundheitsorganisation. 4. März 2015, abgerufen am 31. Mai 2019 (englisch).