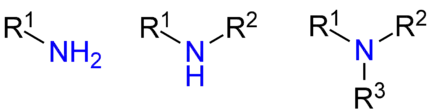
Aminogruppe
Als Aminogruppe wird in der organischen Chemie die funktionelle Gruppe (–NH2) der primären Amine und der meisten Aminosäuren verstanden.[1] Genauer betrachtet werden Amine in drei Kategorien eingeteilt: primäre, sekundäre und tertiäre Amine.[2] Sie unterscheiden sich durch die Anzahl der Kohlenstoff-Atome, die an das zentrale Stickstoff-Atom gebunden sind. Primäre Amine haben ein C-Atom gebunden, sekundäre zwei und tertiäre drei. Auch vier C-Atome am zentralen N-Atom sind möglich. Es handelt sich dann jedoch nicht mehr um ein Amin, sondern um ein quartäres Ammonium-Ion.
Die Aminogruppe ist eine basische funktionelle Gruppe, da das freie Elektronenpaar am Stickstoff-Atom – analog zu dem im Ammoniak-Molekül – ein Proton von einer Säure HA aufnehmen kann. Dadurch geht sie in ein Ammoniumsalz über.
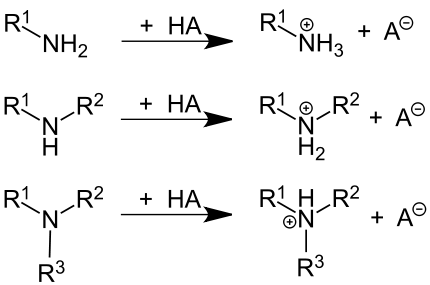
Viele Arzneistoffe sind Ammoniumsalze (Hydrofluoride, Hydrochloride, Hydrobromide, Hydroiodide, Maleate, Acetate etc.), da diese stabiler (länger lagerfähig) und häufig besser resorbierbar sind als die freien Amine.
Ein Nachweis für Aminogruppen ist der Kaiser-Test.
Einzelnachweise
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1–505, 1982, ISBN 3-527-25892-2.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 487–502, ISBN 3-342-00280-8.