Zellkontakt
Als Zellkontakte oder Zellverbindungen (engl. Cell junctions) werden die direkten Berührungsstellen von Zellen in Geweben bezeichnet. Alle mehrzelligen Lebewesen bilden vorübergehende oder dauerhafte Zellkontakte. Die Zellkontakte werden im Wesentlichen durch Proteine gebildet, den Zelladhäsionsmolekülen, welche einerseits aus den Zelloberflächen herausragen und andererseits als intrazelluläre Ankerproteine eine cytoplasmatische Plaque bilden. Sie haben die Aufgabe, das Gewebe zusammenzuhalten und die Kommunikation von Zellen miteinander zu ermöglichen. Viele der Zelladhäsionsmoleküle sind Transmembranproteine, die auf beiden Seiten, innen und außen, über die Zellmembran hinausragen. Diese Proteine können Signale von außen, beispielsweise von anderen Zellen, ins Innere weiterleiten, oder Signale von der Zelle an die Nachbarzellen weitergeben. Zelladhäsionsmoleküle vermitteln sowohl Kontakte zwischen Zellen als auch zwischen Zellen und der extrazellulären Matrix. Eine Besonderheit sind die Kanäle bildenden Transmembranproteine der Gap junctions, die Connexine und Innexine. Der Zellkontakt erzeugt ab einer bestimmten Zelldichte die Zellkontakthemmung. Zellkontakte können über einen Zelladhäsionstest nachgewiesen werden.
Unterscheidung von Zellkontakten
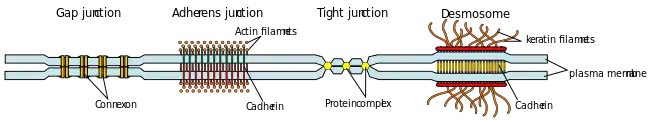
Zellkontakte können nach ihrer Aufgabe grob in haftende, verschließende oder verbindende Kontakte unterschieden werden.
Verschließende Verbindungen
Verschließende Verbindungen (engl.: Occluding junctions), auch Barrierenkontakte[1] oder undurchlässige Verbindungen, bringen die Zellzwischenräume in engen Kontakt und kontrollieren den Fluss von Ionen und Molekülen durch den Zellzwischenraum.
- Zonula occludens oder Tight junction (vorwiegend bei Vertebraten)
- Septate junction (vorwiegend bei Invertebraten)
- Macula occludens
- Fascia occludens
Haftende Verbindungen
Haftende Verbindungen, auch Adhäsions-Verbindungen (engl.: Adhering junctions), Adhäsionskontakte[1] oder Ankerverbindungen (engl.: Anchoring junctions), verbinden die Zellen mechanisch. Sie erlauben so den interzellulären Zusammenhalt, auch (Zell-)Kohärenz genannt. Zwei funktionale Gruppen werden unterschieden:
- Zell-Zell-Kontakte (Desmosom im weiteren Sinn)
- Macula adhaerens (Fleckdesmosom = Desmosom im engeren Sinn)
- Adhärenzverbindungen (engl.: Adherens junctions)
- Zonula adhaerens (Gürteldesmosom)
- Punctum adhaerens (Punktdesmosom)
- Fascia adhaerens (Streifendesmosom)
- Complexus adhaerens[2]
- Zell-Matrix-Kontakte
Kommunizierende Verbindungen
Kommunizierende Verbindungen (engl.: Communicating junctions) oder Kommunikationskontakte[1] ermöglichen den freien Durchfluss von chemischen oder elektrischen Signalen (Ionen und kleinerer Moleküle). Unterschieden werden:
- Gap junction (Nexus)
- Synapse
- Plasmodesmos (bei Pflanzen)
Aufgabe und Funktion
Der Zusammenhalt und die Kommunikation zwischen Zellen sind die Grundvoraussetzung für die Entstehung von komplexeren Organismen. Erst dadurch wird eine Differenzierung der Zellen und damit eine Spezialisierung von Geweben zu Organen ermöglicht. Die Lipiddoppelschichten der Biomembranen sind dünn und können deshalb die großen Kräfte, die auf einen Zellverband ausgeübt werden, nicht weiterleiten. Zellverankerungen (engl.:Anchoring junctions) lösen dieses Problem, indem sie das Cytoskelett im Inneren einer Zelle mit dem anderer Zellen oder mit der extrazellulären Matrix verbinden.
Beteiligte Proteine
Die Zellkontakte werden unter anderem durch Zelladhäsionsmoleküle vermittelt. Dazu gehören die Selectine, die Cadherine, die Integrine und die Immunoglobulin-Superfamilie.[3] Neben den Zelladhäsionsmolekülen kommen in Zellkontakten auch Ankerproteine wie Claudine und Kanalproteine wie Connexine vor.
Selectine sind bei verschiedenen Entzündungsprozessen beteiligt,[4] wie das Rollen der Neutrophilen entlang einer Gefäßwand. Es gibt drei Selectine: L-Selectin, P-Selectin and E-Selectin. L-Selectin kommt auf Lymphozyten, Monozyten und Neutrophilen vor, P-Selectin auf Blutplättchen und Endothelzellen und E-selectin auf Endothelzellen. Ihre extrazelluläre Proteindomäne besteht aus einem N-terminalen Lektin, gefolgt von einem EGF-artigen Bereich und kurzen Wiederholungseinheiten für die Bindung an andere Proteine.[5]
Cadherine sind Calcium-abhängige homophile (gleichbindende) Zelladhäsionsmoleküle, die im Komplex mit Catenin an die Aktin-Mikrofilamente des Zytoskeletts binden, Adherens junctions bilden und der Embryonalentwicklung dienen.[6][7]
Integrine sind neben ihrer Funktion in der Zelladhäsion auch Rezeptoren mit folgender Signaltransduktion.[8]
Die Immunoglobulin-Superfamilie bindet sowohl homophil an andere Proteine der Familie als auch heterophil an Integrine.[9]
Einzelnachweise
- Detlev Drenkhahn und Wolfgang Zenker (Hrsg.): Benninghoff Anatomie Band 1. 15. Auflage, Urban und Schwarzenberg, Wien/München/Baltimore 1994,; S. 25–32, ISBN 3-541-00245-X
- Schmelz, M. & Franke, W. W.: „Complexus Adhaerentes, A New Group of Desmoplakin-Containing Junctions in Endothelial-Cells - the Syndesmos Connecting Retothelial Cells of Lymph-Nodes.“ In: European Journal of Cell Biology 61, 1993, S. 274–289
- Lodish et al.: Molecular Cell Biology, 6th. Auflage, W. H. Freeman and Company, 2007, ISBN 1429203145, S. 803.
- Tedder TF, Steeber DA, Chen A, Engel P: The selectins: vascular adhesion molecules. In: FASEB J.. 9, Nr. 10, July 1995, S. 866–73. PMID 7542213.
- Bevilacqua MP, Nelson RM: Selectins. In: J. Clin. Invest.. 91, Nr. 2, February 1993, S. 379–87. doi:10.1172/JCI116210. PMID 7679406. PMC 287934 (freier Volltext).
- Rowlands TM, Symonds JM, Farookhi R, Blaschuk OW: Cadherins: crucial regulators of structure and function in reproductive tissues. In: Rev. Reprod.. 5, Nr. 1, January 2000, S. 53–61. PMID 10711736.
- Brembeck FH, Rosário M, Birchmeier W: Balancing cell adhesion and Wnt signaling, the key role of β-catenin. In: Curr. Opin. Genet. Dev.. 16, Nr. 1, February 2006, S. 51–9. doi:10.1016/j.gde.2005.12.007. PMID 16377174.
- Hynes RO: Integrins: bidirectional, allosteric signaling machines. In: Cell. 110, Nr. 6, September 2002, S. 673–87. doi:10.1016/S0092-8674(02)00971-6. PMID 12297042.
- Wai Wong C, Dye DE, Coombe DR: The role of immunoglobulin superfamily cell adhesion molecules in cancer metastasis. In: Int J Cell Biol. 2012, 2012, S. 340296. doi:10.1155/2012/340296. PMID 22272201. PMC 3261479 (freier Volltext).
Literatur
- Alberts, B. et al.: Molecular Biology of the Cell. Garland Science, 4. Auflage, 2002. ISBN 0815340729.
- Detlev Drenkhahn und Wolfgang Zenker (Hrsg.): Benninghoff Anatomie Band 1. 15. Auflage, Urban und Schwarzenberg, Wien/München/Baltimore 1994. ISBN 3-541-00245-X
Weblinks
- Elektronenmikroskopische Bilder von Zellkontakten
- Université de Fribourg, Département de Médecine: Interzelluläre Verbindungen (mit Zeichnungen)