Cellobiose
Cellobiose ist ein natürlich vorkommendes Disaccharid, welches aus zwei β-1,4-glycosidisch verknüpften Glucosemolekülen besteht.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
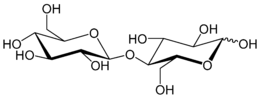 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cellobiose | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H22O11 | |||||||||||||||||||||
| Kurzbeschreibung |
geschmack-, geruch- und farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 342,3 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
0,6 g·cm−3 (Schüttdichte)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser (111 g·l−1 bei 15 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften und Vorkommen
Als natürlich verkommend, wurde Cellobiose im Endosperm von Mais[5] (Zea mays), in den Nadeln der Kiefer[6] (Pinus) sowie in Honig[7][8] nachgewiesen. In verarbeiteten Lebensmitteln konnte Cellobiose als Reversionsprodukt in hydrolysierten Stärkesirupen identifiziert werden.[9][10]
Ein weiterer Entstehungsweg ist der natürliche Zerfall von Cellulose wie bspw. während des Zersetzungsprozesses von Holz durch in der Natur vorkommende Pilzenzyme.[11] Die meisten Bakterien, Pilze und höheren Lebewesen sind jedoch aufgrund fehlender Enzyme nicht in der Lage, Cellobiose in Glucose-Untereinheiten aufzuspalten[12]; lediglich einige wenige Protozoen und Pilze wie Aspergillus-, Penicillium- und Fusarium-Arten besitzen die notwendigen β-1,4-Glucosidasen (Cellobiasen).[11] Manche holzzersetzenden Pilze wie Ceriporiopsis subvermispora können Cellobiose auch über die Cellobiosedehydrogenase (CDH), ein extrazelluläres Hämoflavoenzym, oxidativ abbauen. Dabei entsteht anstelle der Glucose Gluconsäure.[13]
Herstellung
Biotechnologische Produktion
Die biotechnologische Herstellung von Cellobiose kann durch enzymatische Hydrolyse von Cellulose oder mittels enzymatischer Verfahren z. B. aus Saccharose technisch realisiert werden. Letzteres erfolgt unter Anwesenheit von Phosphat, wobei eine Phosphorylierung von Saccharose zu Glucose-1-Phosphat (G-1-P) und Fructose durch Saccharose-Phosphorylase (EC 2.4.1.7) katalysiert wird. Die hergestellte Fructose kann in einer zweiten Reaktion durch Glucose-Isomerase (EC 5.3.1.5) zu Glucose invertiert werden. Das aus der ersten Reaktion vorhandene G-1-P und die in der zweiten Reaktion produzierte Glucose werden in der dritten Reaktion durch Cellobiose-Phosphorylase (EC 2.4.1.20) unter Abgabe von Phosphat zu Cellobiose katalysiert.[14]
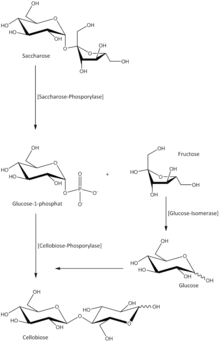
In der wässrigen Saccharidlösung liegen neben der Disaccharid-Hauptverbindung Cellobiose die Monosaccharide Glucose und Fructose sowie weitere Rückstände an Phosphat, G-1-P und Salzen vor. Mittels Elektrodialyse wird die Saccharidlösung entsalzt.[15][16] Durch anschließende Kristallisation, gefolgt von einer physikalischer Separation (bspw. Zentrifugation) kann die Cellobiose aus mehrkomponentigen Saccharidlösungen mit Reinheiten von über 99,5 % gewonnen werden.[17]
Hydrolyse ohne Enzyme
Cellobiose kann auf chemischen Wege sowohl in sauer, in neutraler, als auch in alkalischer wässriger Lösung in zwei Glucoseeinheiten gespalten werden. Dabei unterscheiden sich die notwendigen Aktivierungsenergien nur geringfügig, die notwendigen Temperaturen dagegen stark. Am leichtesten läuft eine saure Hydrolyse mit Salzsäure, verdünnter Schwefel- oder Phosphorsäure – schon ab 18 °C – ab; für die alkalische Spaltung werden zumindest 60 °C benötigt, für den hydrothermalen Abbau gar 180 °C.[18]
Aktivierungsenergien für die Hydrolyse ohne Enzyme[18] Hydrolyse-Typ notwendige Temp.
in °CAktivierungsenergie
in kJ/Molsauer 18–99,5 125,4 alkalisch 60–80 ≈ 120 neutral 180–249 136
Durch Behandlung von Cellulose mit Essigsäure oder Essigsäureanhydrid entsteht das schwer wasserlösliche Cellobiose-Octaacetat (Essigsäureester).
Verwendung
Einer Nutzung von Cellulose aus beliebigen pflanzlichen Fasern zur Produktion von Glucose und daraus von brennbaren niederen Alkoholen (wie etwa Butanolen) steht entgegen, dass sehr viele einfach zu gewinnende Cellulasen (meist aus den Schlauchpilzen Trichoderma viride und T. reesei) Cellobiose nicht abbauen können. Daher wird in Testanlagen aus Aspergillus niger gewonnene β-1,4-Glucosidase (Novozym) zugesetzt.[19]
Nachweis und Bestimmung
Cellobiose kann durch enzymatische Spaltung mit β-Glucosidasen und darauffolgendem papierchromatographischen Nachweis des Spaltprodukts Glucose detektiert werden.[20] Zum eindeutigen Nachweis und zur quantitativen Bestimmung von Cellobiose sind in der instrumentellen Analytik chromatographische Verfahren etabliert. So lässt sich die Cellobiose nach einer Derivatisierung mit bspw. Silylierungsreagenzien in flüchtige Verbindungen überführen, welche sich wiederum mittels der Gaschromatographie in Gegenwart von weiteren Zuckerverbindungen in verschiedenen Matrices zweifelsfrei identifizieren und zuverlässig quantifizieren lassen.[21][22]

Darüber hinaus ist das Verfahren der High-Performance Anion-Exchange Chromatography in Verbindung mit einer Pulsed Amperometric Detection (HPAEC-PAD) sehr gut anwendbar, welches bei stark alkalischen Chromatographiebedingungen die Saccharide deprotoniert, sodass diese an einem starken Anionenaustauscher als Stationärphase in Abhängigkeit ihres Molekülbaus unterschiedlich stark retardiert werden. Dabei wird die Cellobiose ohne vorherige Derivatisierungsreaktionen von weiteren anwesenden Mono-, Di- oder sonstigen Oligosacchariden getrennt, sodass eine qualitative sowie quantitative Bestimmung zuverlässig durchgeführt werden kann.[23]
Nasschemisch lässt sich Cellobiose durch Bildung eines roten Farbstoffes bei der Wöhlk-Reaktion, bei Fearon’s Test und beim 1,6-Diaminohexan-Verfahren nachweisen, wobei allerdings andere 1,4-verknüpfte Disaccharide wie z. B. Lactose oder Maltose ausgeschlossen werden müssen, da sie in gleicher Weise reagieren.[24]
Weblinks
Einzelnachweise
- Datenblatt Cellobiose (PDF) bei Merck, abgerufen am 14. Dezember 2010.
- Datenblatt D-(+)-Cellobiose, for microbiology, ≥99.0% bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- Eintrag zu Cellobiose in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Josef Schormüller: Lehrbuch der Lebensmittelchemie. Springer Verlag, 1961, S. 161.
- E. Gentinetta, M. Zambello, F. Salamini: Free sugar in developing maize grain. In: Cereal Chemistry. Band 56, Nr. 2, S. 81–83.
- B. O. Fraser-Reid, K. Tatsuta, J. Thiem: Glycoscience: Chemistry and Chemical Biology I-III. Springer Verlag, 2001, ISBN 3-540-67764-X, S. 1441.
- Omotayo O. Erejuwa, Siti A. Sulaiman, Mohd S. Ab Wahab: Honey - A Novel Antidiabetic Agent. In: International Journal of Biological Sciences. Band 8, Nr. 6, S. 913–934.
- Jose M. Alvarez-Suarez, Francesca Giampieri, Maurizio Battino: Honey as a source of dietary antioxidants: structures, bioavailability and evidence of protective effects against human chronic diseases. In: Current Medicinal Chemistry. Band 20, Nr. 5, 2013, S. 621–638.
- A. Thompson, K. Anno, M. L. Wolfrom, M. Inatome: Acid Reversion Products from D-Glucose. In: Journal of the American Chemical Society. Band 76, Nr. 5, 1954, S. 1309–1311.
- Sabine M. Bergler: Transglycosidierungsprodukte während der Invertierung von Saccharose. In: Technische Universität Berlin / Institut für Lebensmitteltechnologie und Lebensmittelchemie (Hrsg.): Wissenschaftliche Abschlussarbeit. Berlin, S. 17.
- Martin Weidenbörner: Lexikon der Lebensmittelmykologie. Springer-Verlag, Berlin / Heidelberg 2000, ISBN 3-540-65241-8, S. 34.
- R. Erdmann: Biochemie / Mikrobiologie. Praktikumsscript der Ruhr-Universität Bochum.
- E. Duenhofen: Fermentation, purification and characterization of cellobiose dehydrogenase from Ceriporiopsis subvermispora. Diplomarbeit an der Universität für Bodenkultur Wien, 2005.
- Ching-Tsang Hou, Jei-Fu Shaw: Biocatalysis and Biotechnology for Functional Foods and Industrial Products. Hrsg.: CRC press. 2007, ISBN 0-8493-9282-9.
- M. Makina: Technologie zur Herstellung kristalliner Dextrose und Fruktose. In: Zuckerindustrie. Band 129, Nr. 4, 2004, S. 238–239.
- S. Ouiazzane, B.Messnaoui, S. Abderafi, J. Wouters, T. Bounahmidi: Modeling of sucrose crystallization kinetics: The influence of glucose and fructose. In: Journal of Crystal Growth. Band 310, Nr. 15, 2008, S. 3498–3503.
- Marcel Lesch: Entwicklung eines Kristallisationsverfahrens zur Gewinnung eines Disaccharids aus mehrkomponentigen Saccharidlösungen. In: Hochschule Niederrhein / Fachbereich Oecotrophologie (Hrsg.): Master Thesis. Mönchengladbach 2015, S. 88.
- S. Dumitriu: Polysaccharides: Structural Diversity and Functional Versatility. S. 906, CRC Press, 2004, ISBN 978-0-8247-5480-8.
- B. Rodriguez, P. Dueritas, A. El-Hadj, R. Requena: The Influence of pH on the Hydrolysis of Cellobiose with β-1,4-Glucosidases from Aspergillus Niger. In: 1st World Conference on Biomass for Energy and Industry: Proceedings of the Conference Held in Sevilla, Spain, 5-9 June 2000, Earthscan, 2001, ISBN 978-1-902916-15-6.
- H. Reznik: Über den Histochemischen Nachweis der an der Verholzung Beteiligten β-Glucosidasen. In: Planta. Band 45, Nr. 5, 1955, S. 455–469, doi:10.1007/BF01937867.
- I. Boldizsár, K. Horváth, G. Szedlay, I. Molnár-Perl: Simultaneous GC-MS quantitation of acids and sugars in the hydrolyzates of immunostimulant, water-soluble polysaccharides of basidiomycetes. In: Chromatographia. Band 47, Nr. 2, 1998, S. 413–419.
- I. Molnár-Perl, K. Horváth: Simultaneous quantitation of mono-, di-and trisaccharides as their TMS ether oxime derivatives by GC-MS: I. In model solutions. In: Chromatographia. Band 45, Nr. 1, 1997, S. 321–327.
- Tim Wichmann: Entwicklung einer HPLC-Multimethode zur Bestimmung von Mono-, Di-, Tri- und Tetrasacchariden. In: Fachhochschule Aachen (Hrsg.): Bachelor-Thesis. Jülich 2012, S. 12–29.
- Klaus Ruppersberg: Nachweis von Lactose (und Maltose) im Kontext Schule (Dissertation, Europa-Universität Flensburg). In: Zentrale Hochschulbibliothek Flensburg (ZHB). 1. November 2021, abgerufen am 5. Dezember 2021 (deutsch).