Lyxose
Lyxose ist ein Monosaccharid mit fünf Kohlenstoff-Atomen. Dieser Zucker gehört zur Gruppe der Aldopentosen.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
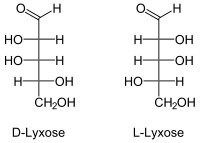 | |||||||
| Fischer-Projektion, offenkettige Darstellung | |||||||
| Allgemeines | |||||||
| Name | D-(−)-Lyxose, L-(+)-Lyxose | ||||||
| Andere Namen |
| ||||||
| Summenformel | C5H10O5 | ||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 150,13 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
sehr gut löslich in Wasser (586 g/l bei 25 °C, L-Lyxose)[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Etymologie
Der Pionier der Chemie der Kohlenhydrate, Emil Fischer, erkannte, dass ein weiteres Isomer der Arabinose und Xylose existieren müsse. Der zunächst hypothetischen Verbindung der Summenformel C5H10O5 gab er den Kunstnamen Lyxose, erzeugt durch Vertauschen des ersten mit dem dritten Buchstaben von Xylose.
Synthesen
Fischer und Bromberg gelang die erste Synthese des unbekannten Zuckers.[4] Für die Aufklärung der Konfiguration waren die Methoden zur Verkürzung der Kohlenstoffkette von Hexosen, Abbau genannt, entscheidend. Ausgehend von D-Galactose (aus Milchzucker) wurde durch Wohl-Abbau D-Lyxose erhalten. Der Ruff-Abbau (oxidative Decarboxylierung von D-Galactonsäure mit Wasserstoffperoxid und Eisen(II)/Eisen(III)-Salzen) sei hier in Fischer-Formeln skizziert.[5]
Vorkommen
Sowohl die D-Lyxose als auch die L-Lyxose kommen in der Natur nicht in freier Form vor, sie ist auch nur äußerst selten – wie zum Beispiel beim Mycobacterium phlei/Mycobacterium smegmatis – am Aufbau von Zellmembranen beteiligt.[6] Wenn in diesem Text oder in der wissenschaftlichen Literatur „Lyxose“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist D-Lyxose gemeint.
Eigenschaften
Durch eine intramolekulare Halbacetalbildung erhält man die beiden cyclischen Konstitutionsisomere Lyxofuranose und Lyxopyranose. Da bei der Halbacetalbildung ein weiteres Asymmetriezentrum entsteht, resultieren jeweils zwei Diastereomere, die α- und β-Lyxofuranose, bzw. die α- und β-Lyxopyranose. Die α- und β-Furanose- bzw. α- und β-Pyranosepaare werden auch als Anomere bezeichnet.
In wässriger Lösung stehen die anomeren Lyxofuranosen und Lyxopyranosen über die instabile offenkettige Aldehydform miteinander im Gleichgewicht. Das Gleichgewicht wird zu 71 % von der α-Lyxopyranose dominiert, gefolgt von der β-Lyxopyranose mit 29 %. Der Anteil beider Lyxofuranosen liegt zusammen bei <1 %.[7] Die Einstellung des Gleichgewichts wird als Mutarotation bezeichnet.
D-Lyxose – Schreibweisen Keilstrichformel Haworth-Schreibweise 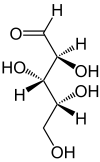
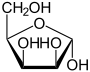
α-D-Lyxofuranose
<1 %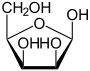
β-D-Lyxofuranose
<1 %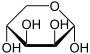
α-D-Lyxopyranose
71 %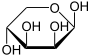
β-D-Lyxopyranose
29 %
Einzelnachweise
- Datenblatt L-Lyxose bei Sigma-Aldrich, abgerufen am 21. Dezember 2019 (PDF).
- Datenblatt L-Lyxose, 99% bei AlfaAesar, abgerufen am 11. Januar 2020 (PDF) (JavaScript erforderlich).
- Datenblatt D-Lyxose bei Sigma-Aldrich, abgerufen am 21. Dezember 2019 (PDF).
- Fischer und Bromberg, In: Berichte der Deutschen Chemischen Gesellschaft. Jg. 1886, Bd. 29, 581, zitiert von Otto Ruff und Gerhard Ollendorf, Berichte der Deutschen Chemischen Gesellschaft. Jg. 1900, Bd. 33, 1798.
- Otto Ruff, Gerhard Ollendorf: Abbau von d-Galactose und von Milchzucker (d-Lyxose und Galactoarabinose). In: Berichte der Deutschen Chemischen Gesellschaft. Jg. 1900, Bd. 33, 1798.
- K. H. Khoo, R. Suzuki, A. Dell, H. R. Morris, M. R. McNeil, P. J. Brennan, G. S. Besra: Chemistry of the lyxose-containing mycobacteriophage receptors of Mycobacterium phlei/Mycobacterium smegmatis. In: Biochemistry. Band 35, Nummer 36, September 1996, S. 11812–11819, doi:10.1021/bi961055+, PMID 8794763.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 851 (eingeschränkte Vorschau in der Google-Buchsuche).
