Purine
Die Purine bilden in der Chemie eine Stoffgruppe von organischen Verbindungen, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie leiten sich von der Stammverbindung Purin ab.
Purine sind neben Pyrimidinen wichtige Bausteine der Nukleinsäuren. Sie sind nicht essentiell, sondern werden vom menschlichen Körper selbst gebildet. Lebensmittel tierischer Herkunft enthalten wegen der hohen Konzentrationen in Haut und Innereien viele Purine. Nach dem Verzehr werden beim Menschen die Purine zu Harnsäure abgebaut und über die Nieren ausgeschieden; bei verschiedenen anderen Tierarten erfolgt ein weitergehender Abbau (beispielsweise zu Allantoin bei Rindern). Daher leitet sich auch der Name von lat. purus = rein und acidum uricum = Harnsäure ab, da es das „reine“ Grundgerüst der Harnsäure ist, die 1898 von Emil Fischer erstmals synthetisiert wurde.
Übersicht
Werden die Wasserstoffatome in den Positionen 2, 6 und 8 durch andere Reste ersetzt, ergeben sich verschiedene substituierte Purine:
| Name | Grundstruktur | R6 | R2 | R8 |
|---|---|---|---|---|
| Purin |  | –H | –H | –H |
| Adenin | –NH2 | –H | –H | |
| Guanin | –OH | –NH2 | –H | |
| Harnsäure | –OH | –OH | –OH | |
| Hypoxanthin | –OH | –H | –H | |
| 6-Purinthiol | –SH | –H | –H | |
| 6-Thioguanin | –SH | –NH2 | –H | |
| Xanthin | –OH | –OH | –H | |
| Isoguanin | –NH2 | –OH | –H |
Dabei werden alle Purine, die als normale Bausteine in DNS und RNS vorkommen, also Adenin (2) und Guanin (3), als Purinbasen bezeichnet. Durch Modifizierung kann es passieren, dass auch Hypoxanthin und Xanthin zeitweilig Teil von RNS oder DNS sind, sie werden durch Reparaturenzyme jedoch wieder ausgewechselt. 7-Methylguanin ist Teil der Cap-Struktur.
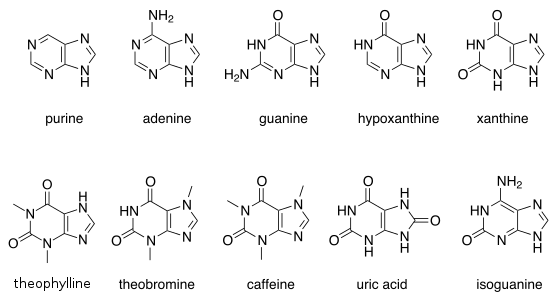
Weitere bedeutende Purine sind Hypoxanthin, Xanthin, Theophyllin, Theobromin, Coffein, Harnsäure und Isoguanin.
Tautomerie

Auf Grund der Molekül-Abschnitte mit dem Grundmuster N=C–X–H (mit X = O, S oder NH) besteht die Möglichkeit der Tautomerie (siehe Lactam-Lactim-, Thiolactam-Thiolactim- und Imin-Enamin-Tautomerie):
Biologische Bedeutung
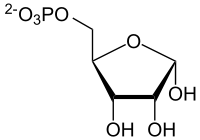
- Sind Adenin und Guanin in Position 9 mit dem C-1-Atom der Ribose (bei der DNA mit Desoxyribose) verknüpft, ergeben sich die Nukleoside Adenosin und Guanosin. Durch Veresterung der Ribose mit Phosphat entstehen die Nukleotide, die Bausteine zahlreicher physiologisch wichtiger Moleküle sind. (Siehe dazu auch: Riboflavin sowie AMP, ADP, ATP, RNA, DNA, cAMP, NADPH, NADH, FAD, Coenzym A, Succinyl-Coenzym A.)
- Durch Salpetrige Säure (HNO2) wird die Amino-Gruppe in eine Hydroxygruppe umgewandelt. Dadurch entsteht aus Adenin Hypoxanthin und aus Guanin Xanthin. Wirkt Salpetrige Säure auf die DNA (als Mutagen) ein, führt diese Änderung dazu, dass es bei der Vermehrung der DNA (Reduplikation) zu fehlerhaften Basenpaarungen und damit zu einer veränderten Basensequenz kommt, die zu veränderten Proteinen und damit zu einem veränderten Phänotyp führen kann.
- In der tRNA finden sich auch ungewöhnliche Purinbasen (Langbasen): A+ entsteht durch Anlagerung eines Protons an Position 7, dadurch wird das Stickstoffatom an dieser Stelle positiv geladen. Die Stickstoffe des Ringsystems können methyliert sein, wodurch sie ebenfalls positiv geladen sind. Beispiele: 1-Methyladenin (m1A), 7-Methyladenin (m7A), 7-Methylguanin (m7G). Bei 2′-O-Methylguanosin (m2’G) ist das C-2-Atom der Ribose methyliert. Die entsprechenden Basen werden erst nach der Transkription modifiziert und beeinflussen die Genauigkeit der Translation sowie die Aktivität und Stabilität der tRNA (siehe auch Nukleoside).
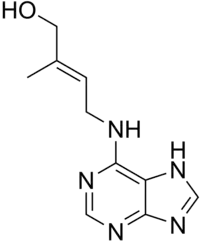
- trans-Zeatin (N6-(Δ2’-Isopentenyl)-aminopurin) ist ein natürlich vorkommendes Cytokinin.
- Die Harnsäure ist das Abbauprodukt des Purinstoffwechsels.
Stoffwechsel
Von dem Heterocyclus Purin leiten sich die Purinnukleotide AMP, ADP, ATP, GTP, GDP und GMP ab, deren gemeinsame Vorstufe in der Biosynthese das Inosinmonophosphat (IMP) ist. Viele weitere Stoffe dienen als Zwischenprodukte und bilden ein Netzwerk, in dem jedes der Nukleotide aus einem der Zwischenprodukte hergestellt, von Grund auf neu (de-novo) synthetisiert oder zu Harnsäure abgebaut werden kann (siehe Abbildung).
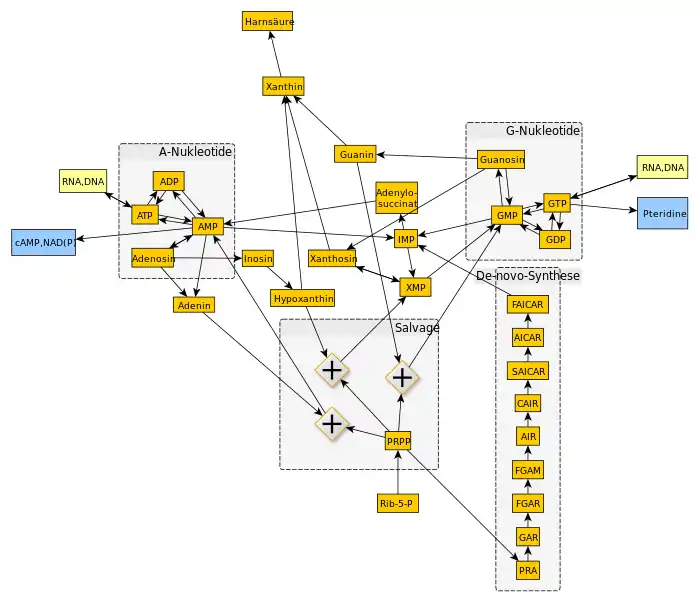
De-novo-Biosynthese von IMP
Die Purine werden im Organismus nicht als freie Moleküle synthetisiert, sondern stets als Nukleotide. Ausgangsmolekül ist das α-D-Ribose-5-phosphat, ein Zwischenprodukt des Pentosephosphatzyklus. Darauf wird das Grundgerüst des Purins schrittweise aufgebaut, wobei verschiedene Moleküle die einzelnen Bestandteile liefern. Das Endprodukt dieser Synthesekette ist das Inosinmonophosphat (IMP), das Nukleotid des Hypoxanthins, welches in weiteren Schritten zu den Nukleotiden des Adenosins oder des Guanosins umgebaut wird.
AMP-Biosynthese (de novo)
Die Synthese von AMP setzt an die von IMP an und benötigt in allen Lebewesen zwei Schritte:
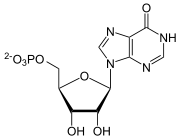 +
+ ![]() + GTP GDP + Pi +
+ GTP GDP + Pi + 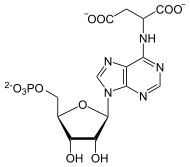
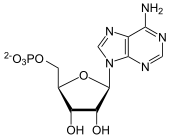 +
+ ![]()
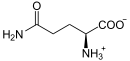
IMP und Aspartat werden unter Verbrauch von GTP ligiert, katalysiert von der Adenylosuccinat-Synthase. Vom Zwischenprodukt wird mithilfe der Adenylosuccinat-Lyase Fumarat abgespalten, es entsteht AMP.
IMP aus AMP
Das Enzym AMP-Desaminase erleichtert die Umwandlung von AMP zu IMP. Dadurch ist es Eukaryoten möglich, IMP über den Salvage-Weg aus Purinbasen zu gewinnen.[1]
 + H2O
+ H2O  + NH3
+ NH3
AMP wird zu IMP umgesetzt; Wasser wird verbraucht, Ammoniak entsteht.
GMP-Biosynthese (de novo)
Wie bei der ATP-Synthese wird GMP aus IMP in zwei Schritten gewonnen. Den ersten Schritt, die Oxidation von IMP und XMP, katalysiert die IMP-Dehydrogenase.[2]
 + NAD+ + H2O
+ NAD+ + H2O 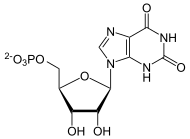 + NADH/H+
+ NADH/H+
IMP wird zu XMP oxidiert. Der zweite Schritt geschieht mittels der GMP-Synthase.
 +
+  + ATP + H2O
+ ATP + H2O  +
+ ![]() + AMP + PPi
+ AMP + PPi
Aus XMP, ATP und Glutamin entstehen GMP, AMP und Glutaminsäure.
IMP aus GMP
Die Rückreaktion von IMP aus GMP in einem Schritt ist mittels der GMP-Reduktase möglich. Dies trägt zur AMP/GMP-Balance in der Zelle bei.
 + NADPH/H+
+ NADPH/H+
 + NH3 +
NADP+
+ NH3 +
NADP+
Von GMP wird Ammoniak abgespalten und IMP entsteht. Die Reaktion ist irreversibel.
Wiederverwertung der Basen (Salvage-Pathway)
Beim Abbau der RNA entstehen neben den Mononukleotiden auch freie Basen und Nukleoside. Die Mononukleotide können dadurch wieder zurückgewonnen werden, dass die Purinbasen mit phosphorylierter Ribose und die Nucleoside durch Kinasen ihre Phosphatgruppe wieder erhalten.
Abbau
Von den Nukleotiden wird Phosphat abgetrennt (mithilfe des Enzyms Nukleotidase) und von den entstehenden Nukleosiden werden als Nächstes die Basen abgespalten, katalysiert von der Purin-Nukleosidase. Guanin wird mithilfe der Guanin-Desaminase zu Xanthin desaminiert. Xanthin wird zu Harnsäure oxidiert. Diese ist bei Landreptilien, Vögeln, vielen Insekten und Primaten das Endprodukt, das über den Harn ausgeschieden wird. Andere Tiere, sowie Pflanzen bilden aus der Harnsäure Allantoin, Harnstoff oder Ammoniak, der bei Stickstoffbedarf als Ammonium wieder aufgenommen wird.[3]
Rezeptoren
Purine binden an spezifische Rezeptoren in der Zellmembran, sog. purinerge Rezeptoren. Es gibt ionotrope und metabotrope purinerge Rezeptoren. Der physiologische Agonist dieser Rezeptoren ist ATP.[4]
Medizinische Bedeutung
Krankheiten
Je nach Ort der Störung im Purin-Stoffwechsel ergeben sich verschiedene Krankheitsbilder:
- Das Lesch-Nyhan-Syndrom ist auf einen Mangel eines Enzyms (Hypoxanthin-Guanin-Phosphoribosyltransferase, HGPRT) innerhalb der Wiederverwertung der Basen (Salvage-Pathway) zurückzuführen. In dessen Folge häufen sich die Substrate 5-P-Ribosyl-PP sowie die Purine Hypoxanthin u. Guanin an, wobei letztere damit auch zu einer Anhäufung von Harnsäure führen. Diese verursacht Gicht, geistige Behinderung und Verhaltensauffälligkeiten.[5]
- Die Gicht ist eine Folge von Hyperurikämie, einer erhöhten Konzentration von Harnsäure im Blut (387 µmol/l). Unterhalb dieser Konzentration stehen im Blut genügend Eiweiße zur Verfügung, um die in Wasser schwerlösliche Harnsäure zu transportieren und ihre Ausfällung zu verhindern. Ist der Harnsäure-Wert zu hoch, reicht dieses Schutz-System nicht mehr aus und es kommt zu Ablagerungen in Gelenken, Sehnenscheiden und Nierenmark.[6][7]
- SCID (schwerer kombinierter Immundefekt) ist auf eine 50-fache Erhöhung der dATP-Konzentration zurückzuführen. Dadurch ist die empfindliche Balance in der Konzentration der DNA-Bausteine gestört und es kommt zu Störungen der DNA-Synthese, die vor allem die Zellen des Immunsystems (T- und B-Zellen) betrifft.[8]
- Adenylosuccinase-Mangel, eine seltene Erbkrankheit, die zu geistiger Behinderung führen kann und oft schon im Kindesalter tödlich verläuft. Betroffenes Enzym ist die Adenylosuccinat-Lyase.[9]
Arzneistoffe
Purin-Derivate und Purin-Analoga spielen als Antimetaboliten eine Rolle: Azathioprin unterdrückt das Immunsystem, 8-Azaguanin, 6-Purinthiol und 6-Thioguanin werden gegen bestimmte Krebsformen eingesetzt, Allopurinol gegen Gicht. N-Hydroxy-Purin und Purin-N-Oxide wirken karzinogen (krebserregend).[10][11]
Literatur
- Gerhard Heidelmann: Geschichte und Begriffsbestimmung der Störungen des Purinstoffwechsels. In: Gerhard Heidelmann, Peter Thiele (Hrsg.): Das Gichtsyndrom. Arthritis, Nephropathie, Harnsäure-Nephrolithiasis, Diabetes mellitus, Hyperlipoproteinämie, Adipositas, Hypertonie, Herzinfarkt, Arterienverschluß. Dresden 1974, S. 1–5.
Einzelnachweise
- C. R. Hancock, J. J. Brault, R. L. Terjung: Protecting the cellular energy state during contractions: role of AMP deaminase. In: Journal of physiology and pharmacology : an official journal of the Polish Physiological Society. Band 57 Suppl 10, November 2006, S. 17–29, PMID 17242488. (Review).
- H. N. Jayaram, D. A. Cooney u. a.: Consequences of IMP dehydrogenase inhibition, and its relationship to cancer and apoptosis. In: Current medicinal chemistry. Band 6, Nummer 7, Juli 1999, S. 561–574, PMID 10390601. (Review).
- A. K. Werner, C. P. Witte: The biochemistry of nitrogen mobilization: purine ring catabolism. In: Trends in plant science. Band 16, Nummer 7, Juli 2011, S. 381–387, doi:10.1016/j.tplants.2011.03.012. PMID 21482173. (Review).
- B. B. Fredholm: Adenosine receptors as drug targets. In: Experimental Cell Research. Band 316, Nummer 8, Mai 2010, S. 1284–1288, doi:10.1016/j.yexcr.2010.02.004. PMID 20153317. PMC 2866745 (freier Volltext). (Review).
- R. J. Torres, J. G. Puig: Hypoxanthine-guanine phosophoribosyltransferase (HPRT) deficiency: Lesch-Nyhan syndrome. In: Orphanet Journal of Rare Diseases. Band 2, 2007, S. 48, doi:10.1186/1750-1172-2-48. PMID 18067674. PMC 2234399 (freier Volltext). (Review).
- E. B. Gonzalez: An update on the pathology and clinical management of gouty arthritis. In: Clinical Rheumatology. Band 31, Nummer 1, Januar 2012, S. 13–21, doi:10.1007/s10067-011-1877-0. PMID 22069122. PMC 3249158 (freier Volltext). (Review).
- P. L. Riches, A. F. Wright, S. H. Ralston: Recent insights into the pathogenesis of hyperuricaemia and gout. In: Human Molecular Genetics. Band 18, R2Oktober 2009, S. R177–R184, doi:10.1093/hmg/ddp369. PMID 19808794. (Review).
- J. Chinen, W. T. Shearer: Advances in basic and clinical immunology in 2010. In: Journal of Allergy and Clinical Immunology. Band 127, Nummer 2, Februar 2011, S. 336–341, doi:10.1016/j.jaci.2010.11.042. PMID 21281863. PMC 3057129 (freier Volltext). (Review).
- E. K. Spiegel, R. F. Colman, D. Patterson: Adenylosuccinate lyase deficiency. In: Molecular Genetics and Metabolism. Band 89, Nummer 1–2, 2006 Sep-Oct, S. 19–31, doi:10.1016/j.ymgme.2006.04.018. PMID 16839792. (Review).
- M. Samsel, K. Dzierzbicka: Therapeutic potential of adenosine analogues and conjugates. In: Pharmacological Reports Band 63, Nummer 3, 2011, S. 601–617, PMID 21857072. (Review).
- T. Robak, E. Lech-Maranda u. a.: Purine nucleoside analogs as immunosuppressive and antineoplastic agents: mechanism of action and clinical activity. In: Current Medicinal Chemistry. Band 13, Nummer 26, 2006, S. 3165–3189, PMID 17168705.
Weblinks
- MedizInfo.de Lebensmitteltabellen für Purine und Harnsäure
- PurinTabelle.de Lebensmitteltabellen für Purine und Harnsäure