Fructose
Fructose (oft auch Fruktose, von lateinisch fructus „Frucht“, veraltet Lävulose, umgangssprachlich Fruchtzucker) ist eine natürlich vorkommende chemische Verbindung. Fructose gehört als Monosaccharid (Einfachzucker) zu den Kohlenhydraten. Sie kommt in mehreren isomeren (anomeren) Formen vor. In diesem Artikel betreffen die Angaben zur Physiologie allein die D-Fructose. L-Fructose ist praktisch bedeutungslos.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
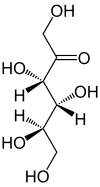
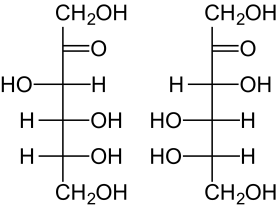 | ||||||||||||||||
| D-Fructose (links) L-Fructose (rechts) Fischer-Projektion, offenkettige Darstellung | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fructose | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H12O6 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, sehr süß schmeckende Prismen oder Nadeln[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
V06DC02 | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,59 g·cm−3 (20 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Die Bezeichnung Fructose wurde 1857 von William Allen Miller erwähnt,[4] als Allusion auf lat. fructus ‚Frucht‘ und -ose als Suffix für Kohlenhydrate.
Eigenschaften
Fructose ist eine farb- und geruchlose, leicht wasserlösliche, sehr süß schmeckende Verbindung, die prismen- oder nadelförmige, stark hygroskopische Kristalle bildet.[2] Bei 60 % Luftfeuchtigkeit nimmt sie innerhalb einer Stunde 0,28 % Wasser auf, innerhalb von 9 Tagen 0,6 %.[5] Das Monosaccharid ist optisch aktiv und kommt in zwei spiegelbildlichen Isomeren, den sogenannten Enantiomeren vor. Fructose gehört wegen ihrer sechs Kohlenstoffatome zur Gruppe der Hexosen und wegen der Ketogruppe zu den Ketosen (Ketohexosen). In kristalliner Form liegt sie als Sechsring (Fructopyranose) vor, gelöst teilweise als Fünfring (Fructofuranose). Fructose hat einen Brennwert von 3,75 Kilokalorien pro Gramm.[6] Fructose ist ein reduzierender Zucker.[6] Sie neigt daher zur Reaktion mit Aminogruppen (Glykation).[6][7] Die Glasübergangstemperatur von Fructose liegt bei 5 °C und die Gordon-Taylor-Konstante (eine experimentell ermittelte Konstante zur Vorhersage der Glasübergangstemperatur bei verschiedenen Massenanteilen eines Gemischs aus zwei Stoffen)[8] liegt bei 3,8.[9]
Die α- und β-Anomere der jeweiligen Ringformen können in wässriger Lösung ineinander umgewandelt werden und stehen untereinander in einem Gleichgewicht. Bei 20 °C liegt in Wasser gelöste D-Fructose zu 76 % in der β-Pyranoseform, zu 4 % in der α-Furanoseform und zu 20 % in der β-Furanoseform vor.[10]
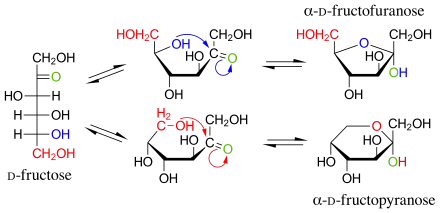
| Keilstrichformel | Haworth-Schreibweise | |
|---|---|---|
 |
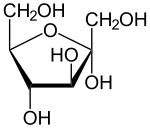 α-D-Fructofuranose |
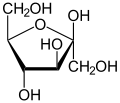 β-D-Fructofuranose |
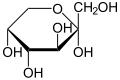 α-D-Fructopyranose |
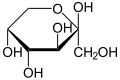 β-D-Fructopyranose | |
Vorkommen
Fructose als Einfachzucker kommt in der Natur vor allem in Kernobst (in Äpfeln und Birnen zu je etwa 6 g/100 g),[2] Beeren (beispielsweise Weintrauben zu 7,5 g/100 g)[11] sowie in exotischen Früchten (Granatapfel und Kaki) und im Honig (35,9–42,1 g/100 g)[12] und in Kunsthonig vor. Haushaltszucker (Saccharose, auch Rohrzucker, wenn aus Zuckerrohr, oder Rübenzucker, wenn aus Zuckerrüben hergestellt) ist ein Zweifachzucker, der sich aus je einem Molekül Glucose (Traubenzucker) und Fructose zusammensetzt. Ein bedeutsamer Anteil bei der Zuckeraufnahme kommt aus industriell gefertigten Nahrungsmitteln, die Fructose-Glucose-Sirup (high-fructose corn syrup, HFCS) enthalten.
| Nahrungsmittel | Gesamtkohlenhydrate inkl. Ballaststoffe |
Gesamtzucker | Fructose | Glucose | Saccharose | Fructose/ Glucose Verhältnis |
Saccharose in % des Gesamtzuckers |
|---|---|---|---|---|---|---|---|
| Früchte | |||||||
| Apfel | 13,8 | 10,4 | 5,9 | 2,4 | 2,1 | 2,0 | 19,9 |
| Aprikose | 11,1 | 9,2 | 0,9 | 2,4 | 5,9 | 0,7 | 63,5 |
| Banane | 22,8 | 12,2 | 4,9 | 5,0 | 2,4 | 1,0 | 20,0 |
| Feige, getrocknet | 63,9 | 47,9 | 22,9 | 24,8 | 0,9 | 0,93 | 0,15 |
| Trauben | 18,1 | 15,5 | 8,1 | 7,2 | 0,2 | 1,1 | 1 |
| Orange | 12,5 | 8,5 | 2,25 | 2,0 | 4,3 | 1,1 | 50,4 |
| Pfirsich | 9,5 | 8,4 | 1,5 | 2,0 | 4,8 | 0,9 | 56,7 |
| Birne | 15,5 | 9,8 | 6,2 | 2,8 | 0,8 | 2,1 | 8,0 |
| Ananas | 13,1 | 9,9 | 2,1 | 1,7 | 6,0 | 1,1 | 60,8 |
| Pflaume | 11,4 | 9,9 | 3,1 | 5,1 | 1,6 | 0,66 | 16,2 |
| Gemüse | |||||||
| Rote Beete | 9,6 | 6,8 | 0,1 | 0,1 | 6,5 | 1,0 | 96,2 |
| Karotte | 9,6 | 4,7 | 0,6 | 0,6 | 3,6 | 1,0 | 77 |
| Paprika | 6,0 | 4,2 | 2,3 | 1,9 | 0,0 | 1,2 | 0,0 |
| Zwiebel | 7,6 | 5,0 | 2,0 | 2,3 | 0,7 | 0,9 | 14,3 |
| Süßkartoffel | 20,1 | 4,2 | 0,7 | 1,0 | 2,5 | 0,9 | 60,3 |
| Yamswurzel | 27,9 | 0,5 | Spuren | Spuren | Spuren | – | Spuren |
| Zuckerrohr | 13–18 | 0,2 – 1,0 | 0,2 – 1,0 | 11–16 | 1,0 | hoch | |
| Zuckerrübe | 17–18 | 0,1 – 0,5 | 0,1 – 0,5 | 16–17 | 1,0 | hoch | |
| Getreide | |||||||
| Mais | 19,0 | 6,2 | 1,9 | 3,4 | 0,9 | 0,61 | 15,0 |
Industrielle Erzeugung
Fructose wird industriell aus pflanzlichen Stärken wie beispielsweise Maisstärke gewonnen. Durch Zugabe des Enzyms Amylase wird aus gelöster Maisstärke zuerst Maissirup und in einer weiteren Reaktion durch Zugabe von Glucoseisomerase wird High-fructose corn syrup (HFCS) erzeugt, z. B. HFCS-42 (mit 42 % Fructose und 53 % Glucose in der Trockenmasse) und HFCS-55 (mit 55 % Fructose und 41 % Glucose in der Trockenmasse, zweite Generation HFCS ab 1976).[14][15] Seit etwa 1972 werden die Enzyme immobilisiert, wodurch die Produktionskosten von HFCS in den USA unter die Importkosten von Saccharose fielen.[14] Gleichzeitig war dies auch die erste großtechnische Anwendung der Immobilisierung von Enzymen[14] und sie stellt die mengenmäßig weltweit größte technische Nutzung immobilisierter Enzyme dar.[15] Daneben wird per Chromatographie noch HFCS-90 mit 90 % Fructoseanteil erzeugt, das zur Herstellung von HFCS-55 durch Verdünnung mit HFCS-42 verwendet wird.[14] Die meisten Softdrinks in den USA verwenden HFCS-55, während die meisten anderen HFCS-gesüßten Lebensmittel HFCS-42 verwenden.[16]
In den USA wird fast ausschließlich Mais (genauer: Maissirup) als Glucosequelle zur Produktion von Isoglucose eingesetzt, die eine Mischung von Glucose und Fructose ist, da Fructose eine höhere Süßkraft bei gleichem physiologischen Brennwert von 374 Kilokalorien pro 100 g aufweist. Die jährliche weltweite Produktionsmenge von Isoglucose beträgt acht Millionen Tonnen (Stand 2011).[17] Glucosesirup wird mit Hilfe immobilisierter Glucose-Isomerase zur Herstellung von HFCS verwendet.[18] Die dabei verwendete Glucose-Isomerase (genauer Xylose-Isomerase) stammt aus Bacillus coagulans,[15] Streptomyces rubiginosus[15] oder Streptomyces phaeochromogenes.[15] Die Reaktion wird bei einem pH-Wert von 7,5–8,2 und einer Temperatur von 55–60 °C durchgeführt.[19] Der aus Stärke erzeugte Glucosesirup wird nach einer Entfernung von Calciumionen zur Erzeugung von Fructose verwendet, da Calciumionen zwar Cofaktoren der Amylase bei der enzymatischen Herstellung des Glucosesirups sind, aber Hemmstoffe der Xylose-Isomerase bei der nachfolgenden Umwandlung zu Fructose – dabei sind Magnesiumionen die Cofaktoren.[20] In geringerem Umfang wird Invertzucker hergestellt, als Mischung von Glucose und Fructose durch Hydrolyse von Saccharose.
Industrielle Verwendung

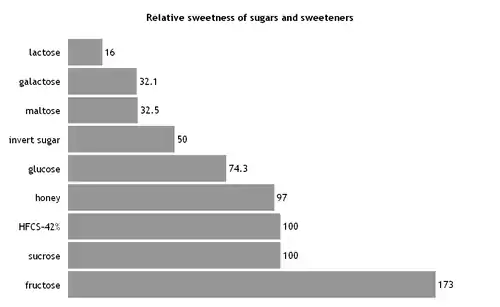
Aufgrund niedrigerer Produktionskosten und höherer Süßkraft wird anstelle von Saccharose (Haushaltszucker) zunehmend Fructose als industrielles Süßungsmittel verwendet.[22]
Verwendung zum Süßen
Lange Zeit – bis Anfang der 2000er-Jahre – wurde Fruchtzucker zum Süßen diätetischer Lebensmittel empfohlen.[23] Bezogen auf Haushaltszucker hat eine 10-prozentige D-Fructoselösung eine Süßkraft von 114 Prozent.[24] Die Angaben variieren zwischen 1,14 (gelöste Form) und 1,8 (kristalline Form).[25][26][27][28] Die Süßkraft von Fructose wirkt synergistisch mit anderen Verbindungen, die zum Süßen verwendet werden.[27][29] Die Pyranoseform der Fructose wirkt süßer als Saccharose, während die Furanoseform etwa gleich süß wirkt.[29] Im kristallinen Zustand liegt nur die süßer wirkende Pyranoseform der Fructose vor.[29] Erwärmen von Fructoselösungen begünstigt die Furanoseform.[25][30] Durch Erhitzen wird die Pyranoseform in die Furanoseform umgewandelt, weshalb HFCS vor allem in Kaltgetränken als Süßungsmittel eingesetzt wird.[31] Fructose ist hygroskopischer als andere Zucker und ist in Wasser besser löslich. Daher sind Zuckermischungen mit Fructose weicher,[32] was zu einem angenehmeren Mundgefühl führen kann.[25] Die aufgrund der vergleichsweise niedrigen Molmasse stärkere Gefrierpunktserniedrigung kann allerdings bei tiefgekühlten Nahrungsmitteln Schwierigkeiten bereiten.[25]
In den USA stieg die kommerzielle Verwendung von Fructose in den 1970er-Jahren drastisch an – der Verzehr von High Fructose Corn Syrup (HFCS), einer besonders fructosereichen Version des Maissirups, von 0,23 kg pro Person im Jahr 1970 auf 28,4 kg pro Person im Jahr 1997.[33] HFCS wird in den USA vor allem in Softdrinks eingesetzt, wobei der Fructosegehalt auf bis zu 55 % (HFCS-55) gesteigert wird. Dieses Süßungsmittel ist für den Hersteller besonders kostengünstig, da in den USA die Maisproduktion subventioniert wird, wohingegen der Zuckerimport verzollt werden muss. Diese signifikante Änderung in der Zusammensetzung der Zuckerzusätze zu Lebensmitteln wurde vorgenommen, ohne dass die möglichen Wirkungen auf den menschlichen Stoffwechsel zuvor umfassend untersucht wurden.[33]
Das Bundesinstitut für Risikobewertung (BfR) kam jedoch bei der Auswertung vorliegender Studien zum Schluss, dass die Verwendung von Fructose als Zuckeraustauschstoff in Diabetiker-Lebensmitteln nicht sinnvoll ist, da sich eine erhöhte Fructoseaufnahme ungünstig auf den Stoffwechsel auswirke und die Entwicklung von Fettleibigkeit sowie des metabolischen Syndroms begünstigt werde.[34] Außerdem kann die erhöhte Zufuhr von Fructose das Risiko für Bluthochdruck steigern.[35]
Die in der EU-Verordnung geregelten Quoten für die Fructoseproduktion sind am 30. September 2017 ausgelaufen.[36] Bis dahin hatte die Fructose in Deutschland folgende[37] Bedeutung in Glukose-Fructose- bzw. Fructose-Glukosesirup:
- Glukose-Fruktose-Sirup
- 8–30 % Fructose vorwiegende Verwendung
- 42 % Fructose kaum Verwendung
- Fruktose-Glukose-Sirup
- 55 % Fructose keine Produktion und Verwendung
- 90 % Fructose keine Produktion und Verwendung
Es ist zu erwarten, dass sich die Fructoseproduktion mit dem Wegfall der Zuckerquote erhöht (mehr als verdreifacht).[38]
Biochemie
Aufnahme
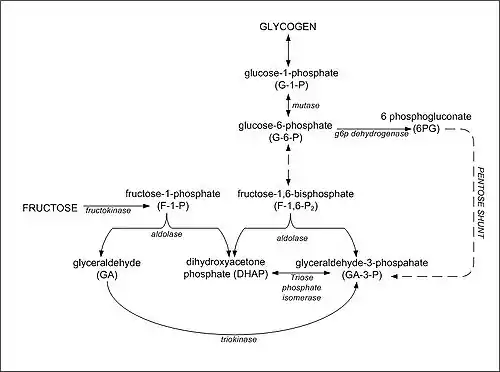
Im Dünndarm wird Fructose von Menschen unterschiedlich gut, vor allem langsamer als Glucose resorbiert. Dies liegt am passiven Transport der Fructose durch spezielle Proteine,[39][40] zum einen durch das so genannte GLUT5 (Fructose-Transporter,[6] apikal, d. h. an der dem Darmlumen zugewandten Zelloberfläche), das der Fructose Zutritt zu den Darmzellen (Enterocyten) gewährt, und zum anderen durch GLUT2 (Fructose- und Glucose-Transporter,[6] basolateral, d. h. dem Blutkreislauf zugewandt), das der Fructose erlaubt, von den Darmzellen ins Blut zu gelangen. Daneben werden GLUT5 und GLUT2 auch von Nierenzellen gebildet, wodurch diese Zellen ebenfalls Fructose aufnehmen können.[41] Die Michaelis-Menten-Konstante für die Aufnahme von Fructose liegt für GLUT5 bei etwa 6 mM und für GLUT2 bei etwa 11 mM.[41]
Glucose und Galactose hingegen werden schneller sekundär-aktiv (SGLT1, apikal), also unter Energieverbrauch, in die Zelle gepumpt.[42] Dies geschieht reguliert über eine rückgekoppelte Hemmung. Im Gegensatz dazu fließt Fructose unreguliert ohne Energieaufwand entlang ihres Konzentrationsgradienten. Dies führt dazu, dass Fructose niemals vollständig aus der Nahrung aufgenommen wird. Vor allem bei Kleinkindern besteht daher die Gefahr, dass es bei zu hohen Fructosemengen in der Nahrung zu osmotischer Diarrhoe kommt. Neben Fructose werden unter den Monosacchariden nur noch Glucose und Galactose direkt in den Blutkreislauf aufgenommen. Niedrige Dosen an Fructose unter 1 g/kg Körpergewicht werden vollständig im Dünndarm aufgenommen und dort verstoffwechselt.[43] Nach Einnahme größerer Mengen von Fructose nimmt die Konzentration dennoch im Blut kaum zu, da die Fructose vollständig von der Leber aufgenommen wird.[6] Ohne körperliche Betätigung wird Fructose in Glucose und Fettsäuren umgewandelt.[6] Die Glucose wird in Glykogen gespeichert, in Fettsäuren und dann in Fette umgewandelt und auch an den Blutkreislauf zur Aufrechterhaltung des Blutzuckerspiegels abgegeben.[44]
D-Fructose wird bei der Fructolyse in Zellen der Leber durch das Enzym Ketohexokinase C in D-Fructose-1-phosphat umgewandelt – so kann sie die Zelle nicht mehr verlassen.[6] Andere Zelltypen besitzen als mögliche Transporter GLUT1, GLUT3 und GLUT4, die nur eine geringe Affinität für Fructose aufweisen – ebenso wie die Hexokinase in diesen Zellen.[6] Der Vorrat an energiereichen Phosphaten wird durch die Ketohexokinase verbraucht: ATP → ADP → AMP und die AMP-Desaminase hochreguliert. Es fällt IMP an, das über den Purinabbau die Konzentration der Harnsäure ansteigen lässt. Fructose bindet beim Menschen an den Rezeptor für den Süßgeschmack auf der Zunge, dessen Aktivierung allgemein mit positiven Stimmungsveränderungen (Affekten) assoziiert ist.[6] Hohe Dosen an Fructose verzögern den Eintritt der Sättigung.[45] Fructose wird im Kraftsport gleichzeitig mit Glucose eingenommen, um eine schnellere Regeneration des Blutzuckerspiegels durch die Bildung von Laktat zu erreichen.[46][47]
Biosynthese
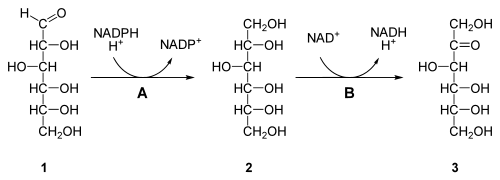
A=Aldosereduktase, B=Sorbitoldehydrogenase
Fructose wird in Pflanzen im Calvin-Zyklus durch Photosynthese aus Kohlenstoffdioxid und Wasser aufgebaut.
In Körperzellen (außer der Leber – dort fehlt dieser Stoffwechselweg) entsteht Fructose aus Glucose über den Polyolweg,[48] bei dem zunächst Glucose durch Aldosereduktase zu Sorbitol reduziert wird; dabei wird das Cosubstrat NADPH zu NADP+ oxidiert. Sorbitoldehydrogenase oxidiert Sorbitol dann zu Fructose, wobei das Cosubstrat NAD+ zu NADH reduziert wird.[49] Der daraus resultierende Verlust von NADPH wird, neben der erhöhten Protein-Glykation, für einen Teil der Langzeitfolgen eines chronisch erhöhten Blutzuckerspiegels (z. B. bei Diabetes mellitus) verantwortlich gemacht, da NADPH auch als Cosubstrat von Glutathionreduktase von der Zelle zur Entgiftung gefährlicher Oxidationsprodukte reaktiver Sauerstoffverbindungen benötigt wird. Bei erhöhtem Blutglucosespiegel wird mehr Glucose über den Polyolweg unter erhöhtem NADPH-Verbrauch zu Fructose umgewandelt. Durch das Überangebot an Glucose fällt außerdem die Aldosereduktase für ihre eigentliche Entgiftungsaufgabe zunehmend aus. Zudem sammeln sich Fructose und Sorbitol in den Zellen an, was diese zum einen osmotisch schädigt, zum anderen können wesentliche Enzyme durch hohe Konzentrationen dieser beiden Zucker gehemmt werden.
Abbau
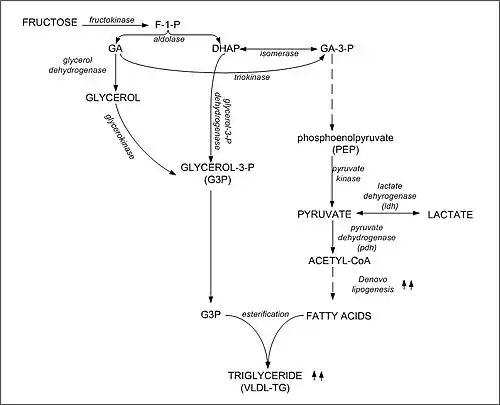
Fructose wird durch die Fructokinase phosphoryliert und wird dann als Fructose-1-phosphat in der Glykolyse verstoffwechselt. Die Fructolyse wird durch Insulin aktiviert und durch cAMP gehemmt.[50] Dabei wird Fructose-1-phosphat durch die Aldolase B in Glycerinaldehyd und Dihydroxyacetonphosphat gespalten.[6] Das Glycerinaldehyd wird durch die Triokinase zu Glycerinaldehyd-3-phosphat phosphoryliert. Dihydroxyacetonphosphat und Glycerinaldehyd-3-phosphat können sowohl in weiteren Abbauwegen wie dem Citratzyklus als auch zum Aufbau von Glucose per Gluconeogenese verwendet werden. Mit Hilfe von Hexokinase entstandenes Fructose-6-Phosphat wird daneben über eine reversible Reaktion mit Glucose-6-Phosphat-Isomerase in Glucose-6-Phosphat umgewandelt oder mit L-Glutamin-D-Fructose-6-Phosphat-Transamidase für die Bildung von Hexosaminen verwendet.[51] Bedeutsamer ist der Abfluss der Zerfallsprodukte in die Triacylglyceridsynthese. Triacylglyceride lagern sich als Depotfett an, aber auch als Fetttröpfchen zwischen den Myofibrillen der Muskulatur. Im Fettgewebe kann Fructose auch als Fructose-6-phosphat in die Glykolyse eintreten, wenn die Glycogenreserven erschöpft sind. Weiterhin aktiviert Fructose das Carbohydrate Response Element Binding Protein (ChREBP), wodurch wiederum Enzyme für die Lipogenese (Fettbildung) und die Gluconeogenese induziert werden.[52][53]
Pathobiochemie
Gendefekte
Beim Menschen führen Störungen der Fructose-Aufnahme im Darm oder des Fructose-Stoffwechsels in der Leber zu Krankheitssymptomen. Verschiedene Gendefekte des Fructosestoffwechsels wurden beschrieben: die benigne Fructosurie aufgrund einer Fructokinase-Defizienz, die hereditäre Fructoseintoleranz und die Fructose-1,6-bisphosphatase-Defizienz.[54] Klinische Bedeutung haben die häufige Fructosemalabsorption (auch intestinale Fructoseintoleranz genannt), bei der ein gestörter Fruchtzucker-Transport durch die Darmzellen angenommen wird,[55][56] und die seltene, aber zu ernsten Symptomen führende hereditäre Fructoseintoleranz (HFI), die durch eine erbliche Störung des Fructosestoffwechsels in der Leber bedingt ist und bei der Fructose nicht oder nicht in ausreichenden Mengen abgebaut werden kann.[57] Bei der hereditären Fructoseintoleranz wird in der Leber anstatt der Aldolase B die Aldolase A gebildet, die Fructose langsamer umsetzt.[58] Durch die Anhäufung von Fructose-6-Phosphat und Fructose-1,6-Bisphosphat wird die Fructose-1,6-bisphosphatase und die Aldolase A gehemmt, wodurch die Glykolyse und die Gluconeogenese gehemmt wird.[58] Daher folgt bei der hereditären Fructoseintoleranz eine Unterzuckerung auf den Konsum Fructose-haltiger Nahrung.[58]
Bei der benignen Fructosurie (1:130.000, autosomal-rezessiv) liegt ein Mangel der Fructokinase vor.[59] Fructose wird dabei vermehrt mit dem Urin ausgeschieden.[59]
Geschätzte 30–40 % der Mitteleuropäer weisen die Fructosemalabsorption auf, wobei etwa die Hälfte Symptome zeigt.[60] Die Störung tritt vorwiegend im Kindesalter auf.[61] Nichtresorbierter Fruchtzucker wird von den Bakterien der Darmflora vorwiegend anaerob zu Kohlenstoffdioxid, Wasserstoff und kurzkettigen Fettsäuren abgebaut. Diese erzeugen Reizdarmsymptome wie Blähungen, Bauchschmerzen, breiigen, teils übelriechenden Stuhl und Durchfall.[62] Die hereditäre Fructoseintoleranz ist sehr viel seltener; auf etwa 130.000 gesunde Menschen kommt ein von der HFI Betroffener.[63] Diese Form der Fructoseintoleranz bewirkt über eine Störung des Glucosestoffwechsels eine gefährliche Unterzuckerung (Hypoglykämie).
Metabolisches Syndrom bei übermäßigem Konsum
Eine übermäßige Zufuhr von Kalorien in Form von Fructose führt zum metabolischen Syndrom, zu Übergewicht und teilweise auch zu Diabetes mellitus Typ II,[64][65] nicht aber der Konsum von Fructose innerhalb einer normalen Kalorienzufuhr.[66] Weiterhin kann bei übermäßigem Konsum von Fructose eine nichtalkoholische Fettleberhepatitis entstehen.[64] Fructose wird vom Körper schneller in Körperfett umgewandelt als Glucose.[67] Zudem scheint die Verwendung von Fructose zu einem geringeren Sättigungsgefühl zu führen, da diese keine Insulin-Ausschüttung induziert und Insulin auch zu den Sättigungshormonen gehört.[68] Der Anstieg des Fructosekonsums wird mit der Zunahme des metabolischen Syndroms in Zusammenhang gebracht, eines Risikofaktors für koronare Herzkrankheiten.[33][69]
Geringe Mengen Fructose verbessern sowohl bei gesunden Menschen als auch bei Patienten mit Diabetes mellitus Typ 2 die Glucose-Toleranz und die glykämische Antwort ohne gesteigerte Insulinsekretion.[70] Die Datenlage ist momentan nicht ausreichend (Stand 2017), um den Konsum von Fructose eindeutig mit einer Häufung von Diabetes mellitus Typ II im Menschen zu assoziieren.[71][72] Fructose führt im Vergleich zu Glucose oder Saccharose zu einem geringeren Anstieg der Insulin- und Triglycerid-Spiegel im Blut.[73]
Fettleber
Der übermäßige Konsum fructosehaltiger Getränke wie Limonaden und anderen gesüßten Softdrinks können zu Schädigungen der Leber bis hin zur Fettleber (Steatosis hepatis) mit einhergehender krankhafter Vermehrung des Bindegewebes (Fibrose) führen.[74] Der in den letzten Jahren rapide ansteigende Fructosekonsum spielt damit nicht nur eine wichtige Rolle bei der Entstehung des metabolischen Syndroms, sondern stellt nach Untersuchungen aus 2008 einen eigenständigen Risikofaktor für nicht alkoholbedingte Fettlebererkrankungen (nonalcoholic fatty liver disease) dar.[75]
Gicht
Der übermäßige Konsum von Fructose wird mit einem erhöhten Risiko für Gicht (Urikopathie) assoziiert.[76][77][78] Durch die vermehrte Synthese von ATP wird auch vermehrt AMP zu Harnsäure abgebaut, welche wenig löslich ist und bei Kristallisation in den Gelenken zu Gicht führen kann. Auch fructosereiche Früchte und Fruchtsäfte scheinen das Risiko zu erhöhen, an Gicht zu erkranken, während von Diätlimonaden diesbezüglich keine Gefahr ausgeht.[79][80][81]
Rechtslage
§ 12 der Verordnung über diätetische Lebensmittel (sogenannte Diätverordnung) regelte einst die Zusammensetzung spezieller Produkte für Diabetiker. Seit dem 1. Oktober 2010 ist dieser Artikel gestrichen, da der Forschungsstand zu Diabetikerdiäten und Zuckerersatzstoffen zeigt, dass diese Patienten keine derartigen Produkte benötigen und dass ein erhöhter Fructosekonsum sogar schädliche Einflüsse auf die Gesundheit haben kann (siehe Text). Fructose ist die gesetzlich geschützte Bezeichnung einer Zuckerart.
Die EU führte eine Bewertung der Effekte des Fructosekonsums durch.[82] Das Scientific Advisory Committee on Nutrition im Vereinigten Königreich befand 2015, dass die Effekte von Fructose auch durch andere Zucker entstehen.[83]
Analytik
Chromatographische Verfahren
In komplexem Untersuchungsmaterial kann Fructose nach hinreichender Probenvorbereitung durch die Kopplung der HPLC oder Gaschromatographie mit der Massenspektrometrie sicher qualitativ und quantitativ nachgewiesen werden.[84][85][86][87] Fructose in kohlensäurehaltigen Getränken kann per HPLC getrennt und nachgewiesen werden.[88]
Fehling-Probe
Als α-Hydroxyketon wirkt Fructose reduzierend, daneben kann sie im Zuge der Fehling-Reaktion im alkalischen Milieu in Mannose und Glucose umgewandelt werden (siehe Ketol-Endiol-Tautomerie), so dass ein Gleichgewicht zwischen all diesen Isomeren vorliegt.
Seliwanow-Probe
Die Seliwanow-Reaktion ist ein Nachweis für Ketohexosen in der Furanose-Ringform. Da sie im sauren Milieu abläuft, kommt es nicht zur Ketol-Endiol-Tautomerie. Mit Glucose fällt die Probe deshalb negativ aus.
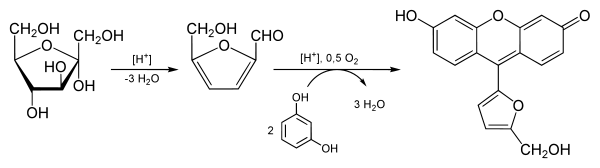
Zunächst wird die Fructose mit Salzsäure erhitzt. Dadurch entsteht das 5-Hydroxymethylfurfural. Dieses reagiert dann mit Resorcin zu einem roten Niederschlag.
Literatur
- M. R. Laughlin: Normal roles for dietary fructose in carbohydrate metabolism. In: Nutrients, Band 6, Nummer 8, August 2014, S. 3117–3129, doi:10.3390/nu6083117, PMID 25100436, PMC 4145298 (freier Volltext).
- M. B. Vos, J. E. Lavine: Dietary fructose in nonalcoholic fatty liver disease. In: Hepatology, Band 57, Nummer 6, Juni 2013, S. 2525–2531, doi:10.1002/hep.26299, PMID 23390127.
- Duncan Tappy, Kim-Anne Le: Metabolic Effects of Fructose and the Worldwide Increase in Obesity. In: Physiological Reviews, 90, 2010, S. 23–46; thexporterpundit.com (PDF; 746 kB).
Weblinks
Einzelnachweise
- Eintrag zu FRUCTOSE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu D-Fructose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. März 2018.
- Eintrag zu Fructose in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. März 2018. (JavaScript erforderlich)
- William Allen Miller: Elements of chemistry pt. 3 1857. J.W. Parker and Son, 1857, S. 57.
- Waldemar Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. Behr, Hamburg 2008, ISBN 978-3-89947-423-7, S. 159.
- L. Tappy: Fructose-containing caloric sweeteners as a cause of obesity and metabolic disorders. In: The Journal of experimental biology, Band 221, Pt Suppl 1, März 2018, doi:10.1242/jeb.164202, PMID 29514881.
- G. Suárez, R. Rajaram, A. L. Oronsky, M. A. Gawinowicz: Nonenzymatic glycation of bovine serum albumin by fructose (fructation). Comparison with the Maillard reaction initiated by glucose. In: Journal of Biological Chemistry, Band 264, Nummer 7, März 1989, S. 3674–3679, PMID 2537288.
- Patrick F. Fox: Advanced Dairy Chemistry Volume 3: Lactose, water, salts and vitamins, Springer, 1992. Band 3, ISBN 978-0-412-63020-0. S. 316.
- Benjamin Caballero, Paul Finglas, Fidel Toldrá: Encyclopedia of Food and Health. Academic Press, 2016, ISBN 978-0-12-384953-3, Band 1, S. 76.
- Hans-Dieter Belitz, Werner Grosch und Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin 2008, ISBN 978-3-540-73201-3, S. 259.
- Eintrag zu Weintraube. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Mai 2012.
- Eintrag zu Honig. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Mai 2012.
- Search the USDA National Nutrient Database for Standard Reference. (Nicht mehr online verfügbar.) Nal,usda,gov, archiviert vom Original am 3. März 2015; abgerufen am 10. Dezember 2014.
- Byong H. Lee: Fundamentals of Food Biotechnology. John Wiley & Sons, 2014, ISBN 978-1-118-38491-6, S. 332.
- Andreas Liese: Industrial Biotransformations. John Wiley & Sons, 2008, ISBN 978-3-527-61417-2, S. 388.
- High Fructose Corn Syrup: Questions and Answers. (Nicht mehr online verfügbar.) US Food and Drug Administration, 5. November 2014, archiviert vom Original am 25. Januar 2018; abgerufen am 18. Dezember 2017.
- Thomas Becker, Dietmar Breithaupt, Horst Werner Doelle, Armin Fiechter, Günther Schlegel, Sakayu Shimizu, Hideaki Yamada: Biotechnology, in: Ullmann’s Encyclopedia of Industrial Chemistry, 7. Auflage, Wiley-VCH, 2011. ISBN 978-3-527-32943-4. Band 6, S. 48.
- Atsuo Tanaka: Industrial Application of Immobilized Biocatalysts. CRC Press, 1992, ISBN 978-0-8247-8744-8, S. 185.
- Benjamin Caballero, Paul Finglas, Fidel Toldrá: Encyclopedia of Food and Health. Academic Press (2016). ISBN 978-0-12-384953-3, Band 3, S. 608.
- Ashok Pandey: Industrial Biorefineries and White Biotechnology. Elsevier, 2015, ISBN 978-0-444-63464-1, S. 488.
- Oregon State University: Sugar (Memento vom 18. Juli 2011 im Internet Archive), abgerufen am 28. Juni 2018.
- University of California Television (UCTV): Sugar: The Bitter Truth auf YouTube, 31. Juli 2009, abgerufen am 18. September 2021 (Englisch).
- Zuckerfreie Alternativen: Lebensmitteltechnologische Eigenschaften von Zuckeraus. In: Deutsche Apotheker Zeitung, 39/1998: „Zuckeralkohole erhöhen den Blutglucosespiegel nicht und erfüllen daher, ebenso wie Fructose, die Anforderungen an Lebensmittel für Diabetiker.“
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin 2008, ISBN 978-3-540-73201-3, S. 263.
- L. M. Hanover, J. S. White: Manufacturing, composition, and applications of fructose. Archiviert vom Original am 14. April 2016. In: The American Journal of Clinical Nutrition. 58, Nr. 5, 1. November 1993, S. 724S–732S. Abgerufen am 7. Februar 2017.
- Oregon State University: Sugar Sweetness (Memento vom 16. Mai 2008 im Internet Archive)
- Thomas D. Lee: Sweeteners. In: John Wiley & Sons, Inc. (Hrsg.): Kirk-Othmer Encyclopedia of Chemical Technology. 1. Januar 2000. doi:10.1002/0471238961.19230505120505.a01.pub2.
- A.H. Jana, N.S.S. Joshi: Sweeteners for frozen [desserts success – a review] Archiviert vom Original am 8. Februar 2017. In: Australian Journal of Dairy Technology. 49, November 1994. Abgerufen am 7. Februar 2017.
- Lyn O’Brien-Nabors: Alternative Sweeteners, Third Edition, Revised and Expanded. CRC Press, 2001, ISBN 978-0-8247-0437-7, S. 371–375.
- R.S. Shallenberger: Taste Chemistry. Chapman and Hall, 1994, ISBN 978-0-7514-0150-9.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry. 7. Auflage, Springer-Verlag, 2010, ISBN 978-1-4292-2936-4, S. 324.
- Margaret McWilliams: Foods: Experimental Perspectives, 4th Edition. Upper Saddle River, NJ: Prentice Hall, 2001, ISBN 0-13-021282-2.
- K. Berneis: Süss durch Fructose: Sinn oder Unsinn? (Nicht mehr online verfügbar.) Schweizerische Diabetes-Gesellschaft, archiviert vom Original am 27. April 2015; abgerufen am 31. Oktober 2010.
- Erhöhte Aufnahme von Fruktose ist für Diabetiker nicht empfehlenswert. Stellungnahme Nr. 041/2009 des BfR vom 6. März 2009. (PDF; 52 kB) Bundesinstitut für Risikobewertung, 6. März 2009, abgerufen am 31. Oktober 2010.
- High fructose intake from added sugars: An independent association with hypertension. ScienceDaily, 29. Oktober 2009, abgerufen am 29. Mai 2014.
- Verordnung (EU) Nr. 1308/2013 des Europäischen Parlaments und des Rates vom 17. Dezember 2013 über eine gemeinsame Marktorganisation für landwirtschaftliche Erzeugnisse und zur Aufhebung der Verordnungen (EWG) Nr. 922/72, (EWG) Nr. 234/79, (EG) Nr. 1037/2001 und (EG) Nr. 1234/2007. 32013R1308, 20. Dezember 2013 (europa.eu [abgerufen am 3. September 2019]).
- Isoglukose und das Ende der EU-Zuckerquote. Abgerufen am 3. September 2019.
- Johanna Kapitza: EU-Zuckerquote aufgehoben. 11. Oktober 2017, abgerufen am 3. September 2019.
- Hartmut Hoffmann: Zucker und Zuckerwaren. Behr’s Verlag DE, 2002, ISBN 978-3-86022-937-8, S. 19.
- D. T. McQuade, M. B. Plutschack, P. H. Seeberger: Passive fructose transporters in disease: a molecular overview of their structural specificity. In: Organic & biomolecular chemistry, Band 11, Nummer 30, August 2013, S. 4909–4920, doi:10.1039/c3ob40805a, PMID 23784005.
- V. Douard, R. P. Ferraris: The role of fructose transporters in diseases linked to excessive fructose intake. In: The Journal of Physiology, Band 591, Nummer 2, Januar 2013, S. 401–414, doi:10.1113/jphysiol.2011.215731, PMID 23129794, PMC 3577529 (freier Volltext).
- N. Harada, N. Inagaki: Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. In: Journal of diabetes investigation, Band 3, Nummer 4, August 2012, S. 352–353, doi:10.1111/j.2040-1124.2012.00227.x, PMID 24843589, PMC 4019254 (freier Volltext).
- C. Jang, S. Hui, W. Lu, A. J. Cowan, R. J. Morscher, G. Lee, W. Liu, G. J. Tesz, M. J. Birnbaum, J. D. Rabinowitz: The Small Intestine Converts Dietary Fructose into Glucose and Organic Acids. In: Cell Metabolism, Band 27, Nummer 2, Februar 2018, S. 351–361.e3, doi:10.1016/j.cmet.2017.12.016, PMID 29414685.
- V. C. Campos, L. Tappy: Physiological handling of dietary fructose-containing sugars: implications for health. In: International Journal of Obesity, Band 40 Suppl 1, März 2016, S. S6–11, doi:10.1038/ijo.2016.8, PMID 27001645.
- Theodoros Varzakas, Athanasios Labropoulos, Stylianos Anestis: Sweeteners. CRC Press, 2012, ISBN 978-1-4398-7672-5, S. 5.
- J. T. Gonzalez, C. J. Fuchs, J. A. Betts, L. J. van Loon: Glucose Plus Fructose Ingestion for Post-Exercise Recovery-Greater than the Sum of Its Parts? In: Nutrients, Band 9, Nummer 4, März 2017, S. , doi:10.3390/nu9040344, PMID 28358334, PMC 5409683 (freier Volltext).
- L. Tappy, R. Rosset: Fructose Metabolism from a Functional Perspective: Implications for Athletes. In: Sports medicine, Band 47, Suppl 1, März 2017, S. 23–32, doi:10.1007/s40279-017-0692-4, PMID 28332117.
- U Satyanarayana: Biochemistry. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7, S. 279.
- H. Robert Horton: Biochemie. 4. Auflage. Pearson Deutschland, 2008, ISBN 978-3-8273-7312-0, S. 492.
- Jan Koolman: Taschenatlas Biochemie des Menschen. Georg Thieme Verlag, 2009, ISBN 978-3-13-150934-5, S. 129.
- M. M. Adeva-Andany, N. Pérez-Felpete, C. Fernández-Fernández, C. Donapetry-García, C. Pazos-García: Liver glucose metabolism in humans. In: Bioscience reports, Band 36, Nummer 6, 12 2016, S. , doi:10.1042/BSR20160385, PMID 27707936, PMC 5293555 (freier Volltext).
- B. Geidl-Flueck, P. A. Gerber: Insights into the Hexose Liver Metabolism-Glucose versus Fructose. In: Nutrients, Band 9, Nummer 9, September 2017, S. , doi:10.3390/nu9091026, PMID 28926951, PMC 5622786 (freier Volltext).
- K. Iizuka: The Role of Carbohydrate Response Element Binding Protein in Intestinal and Hepatic Fructose Metabolism. In: Nutrients, Band 9, Nummer 2, Februar 2017, S. , doi:10.3390/nu9020181, PMID 28241431, PMC 5331612 (freier Volltext).
- C. Tran: Inborn Errors of Fructose Metabolism. What Can We Learn from Them? In: Nutrients, Band 9, Nummer 4, April 2017, S. , doi:10.3390/nu9040356, PMID 28368361, PMC 5409695 (freier Volltext).
- M. Ledochowski, B. Widner, D. Fuchs: Fruktosemalabsorption. (PDF; 318 kB) In: Journal für Ernährungsmedizin. Ausgabe für Österreich. Wien 2.2000,3, S. 10–14.
- L. Putkonen, C. K. Yao, P. R. Gibson: Fructose malabsorption syndrome. In: Current opinion in clinical nutrition and metabolic care, Band 16, Nummer 4, Juli 2013, S. 473–477, doi:10.1097/MCO.0b013e328361c556, PMID 23739630.
- P. Karlson u. a.: Karlsons Biochemie und Pathobiochemie. Thieme, Stuttgart 2005, ISBN 978-3-13-357815-8, S. 260.
- Georg Löffler: Biochemie und Pathobiochemie. Springer-Verlag, 2013, ISBN 978-3-662-06062-9, S. 395.
- Denise R. Ferrier: Biochemistry. Lippincott Williams & Wilkins, 2013, ISBN 978-1-4511-7562-2, S. 139.
- Gerald Huether: Tryptophan, serotonin, and melatonin: basic aspects and applications. In Band 467 von Advances in Experimental Medicine and Biology. 2. Auflage, Springer, 1999, ISBN 978-0-306-46204-7, S. 74.
- Dietrich Reinhardt: Therapie der Krankheiten im Kindes- und Jugendalter. 8. Auflage, Springer, 2007, ISBN 978-3-540-71898-7, S. 1115.
- Deutsche Gesellschaft für Ernährung: Fructosemalabsorption. (Memento vom 29. April 2010 im Internet Archive) DGEInfo 12/2005 – Beratungspraxis, 1. Dezember 2005.
- G. Löffler, P. E. Petrides, P. C. Heinrich: Biochemie & Pathobiochemie. 8. Auflage, Springer, Heidelberg 2006, ISBN 978-3-540-32680-9, S. 395.
- T. Jensen, M. F. Abdelmalek, S. Sullivan, K. J. Nadeau, M. Green, C. Roncal, T. Nakagawa, M. Kuwabara, Y. Sato, D. H. Kang, D. R. Tolan, L. G. Sanchez-Lozada, H. R. Rosen, M. A. Lanaspa, A. M. Diehl, R. J. Johnson: Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. In: Journal of Hepatology. [elektronische Veröffentlichung vor dem Druck] Februar 2018, doi:10.1016/j.jhep.2018.01.019, PMID 29408694.
- S. A. Hannou, D. E. Haslam, N. M. McKeown, M. A. Herman: Fructose metabolism and metabolic disease. In: Journal of Clinical Investigation, Band 128, Nummer 2, Februar 2018, S. 545–555, doi:10.1172/JCI96702, PMID 29388924, PMC 5785258 (freier Volltext).
- L. Chiavaroli, R. J. de Souza, V. Ha, A. I. Cozma, A. Mirrahimi, D. D. Wang, M. Yu, A. J. Carleton, M. Di Buono, A. L. Jenkins, L. A. Leiter, T. M. Wolever, J. Beyene, C. W. Kendall, D. J. Jenkins, J. L. Sievenpiper: Effect of Fructose on Established Lipid Targets: A Systematic Review and Meta-Analysis of Controlled Feeding Trials. In: Journal of the American Heart Association, Band 4, Nummer 9, September 2015, S. e001700, doi:10.1161/JAHA.114.001700, PMID 26358358, PMC 4599489 (freier Volltext).
- E. J. Parks et al.: Dietary Sugars Stimulate Fatty Acid Synthesis in Adults. In: J. Nutr., 2008, Band 138, S. 1039–1046, PMID 18492831.
- Kathleen A. Page, MD; Owen Chan, PhD; Jagriti Arora, MS; Renata Belfort-DeAguiar, MD, PhD; James Dzuira, PhD; Brian Roehmholdt, MD, PhD; Gary W. Cline, PhD; Sarita Naik, MD; Rajita Sinha, PhD; R. Todd Constable, PhD; Robert S. Sherwin, MD.: Effects of Fructose vs Glucose on Regional Cerebral Blood Flow in Brain Regions Involved With Appetite and Reward Pathways. In: JAMA. 2013; 309(1): S. 63–70; doi:10.1001/jama.2012.116975.
- Susanne Donner: Die Fruchtzucker-Falle: Süßungsmittel Fruktose schlägt aufs Herz. In: wissenschaft.de, 22. September 2006.
- Mary Courtney Moore, Alan D. Cherrington, Stephnie L. Mann, Stephen N. Davis: Acute Fructose Administration Decreases the Glycemic Response to an Oral Glucose Tolerance Test in Normal Adults. In: The Journal of Clinical Endocrinology & Metabolism Vol. 85, No. 12, S. 4515–4519; PMID 11134101; doi:10.1210/jcem.85.12.7053.
- C. S. Tsilas, R. J. de Souza, S. B. Mejia, A. Mirrahimi, A. I. Cozma, V. H. Jayalath, V. Ha, R. Tawfik, M. Di Buono, A. L. Jenkins, L. A. Leiter, T. M. Wolever, J. Beyene, T. Khan, C. W. Kendall, D. J. Jenkins, J. L. Sievenpiper: Relation of total sugars, fructose and sucrose with incident type 2 diabetes: a systematic review and meta-analysis of prospective cohort studies. In: Canadian Medical Association Journal, Band 189, Nummer 20, Mai 2017, S. E711–E720, doi:10.1503/cmaj.160706, PMID 28536126, PMC 5436961 (freier Volltext).
- W. C. Dornas, W. G. de Lima, M. L. Pedrosa, M. E. Silva: Health implications of high-fructose intake and current research. In: Advances in Nutrition, Band 6, Nummer 6, November 2015, S. 729–737, doi:10.3945/an.114.008144, PMID 26567197, PMC 4642413 (freier Volltext).
- R. A. Evans, M. Frese, J. Romero, J. H. Cunningham, K. E. Mills: Fructose replacement of glucose or sucrose in food or beverages lowers postprandial glucose and insulin without raising triglycerides: a systematic review and meta-analysis. In: The American Journal of Clinical Nutrition, Band 106, Nummer 2, August 2017, S. 506–518, doi:10.3945/ajcn.116.145151, PMID 28592611.
- M. F. Abdelmalek et al.: Increased fructose consumption is associated with fibrosis severity in patients with nonalcoholic fatty liver disease. In: Hepatology. 51, Nr. 6, 2010, S. 1961–1971. PMID 20301112.
- Q. Ouyang et al.: Fructose consumption as a risk factor for non-alcoholic fatty liver disease. In: Journal of Hepatology. 48, Nr. 6, 2008, S. 993–999. PMID 18395287.
- C. Caliceti, D. Calabria, A. Roda, A. F. Cicero: Fructose Intake, Serum Uric Acid, and Cardiometabolic Disorders: A Critical Review. In: Nutrients, Band 9, Nummer 4, April 2017, S. , doi:10.3390/nu9040395, PMID 28420204, PMC 5409734 (freier Volltext).
- J. Jamnik, S. Rehman, S. Blanco Mejia, R. J. de Souza, T. A. Khan, L. A. Leiter, T. M. Wolever, C. W. Kendall, D. J. Jenkins, J. L. Sievenpiper: Fructose intake and risk of gout and hyperuricemia: a systematic review and meta-analysis of prospective cohort studies. In: BMJ open, Band 6, Nummer 10, 10 2016, S. e013191, doi:10.1136/bmjopen-2016-013191, PMID 27697882, PMC 5073537 (freier Volltext).
- R. J. Johnson, T. Nakagawa, L. G. Sanchez-Lozada, M. Shafiu, S. Sundaram, M. Le, T. Ishimoto, Y. Y. Sautin, M. A. Lanaspa: Sugar, uric acid, and the etiology of diabetes and obesity. In: Diabetes, Band 62, Nummer 10, Oktober 2013, S. 3307–3315, doi:10.2337/db12-1814, PMID 24065788, PMC 3781481 (freier Volltext).
- H. K. Choi, G. Curhan: Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. In: BMJ. 336, Nr. 7639, 2008, S. 309–312. PMID 18244959. PMC 2234536 (freier Volltext).
- J. W. Choi et al.: Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey. In: Arthritis Rheum. 59, Nr. 1, 2008, S. 109–116. PMID 18163396.
- A. E. Hak, H. K. Choi: Lifestyle and gout. In: Curr Opin Rheumatol. 20, Nr. 2, 2008, S. 179–186. PMID 18349748.
- EFSA Panel on Dietetic Products, Nutrition and Allergies: Scientific Opinion on the substantiation of health claims related to fructose and reduction of post-prandial glycaemic responses (ID 558) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 Archiviert vom Original am 25. Juni 2016. In: EFSA Journal. 9, Nr. 6, 2011, S. 2223. doi:10.2903/j.efsa.2011.2223.
- Carbohydrates and Health. (PDF) (Nicht mehr online verfügbar.) UK Scientific Advisory Committee on Nutrition, Public Health England, TSO, Williams Lea, Norwich, UK, 2015, archiviert vom Original am 19. März 2016; abgerufen am 1. April 2016.
- H Kawashima, M Suto, N Suto: Determination of carbon isotope ratios for honey samples by means of a liquid chromatography/isotope ratio mass spectrometry system coupled with a post-column pump. In: Rapid Commun. Mass Spectrom., 20. Mai 2018, PMID 29781254
- N Georgelis, K Fencil, CM Richael: Validation of a rapid and sensitive HPLC/MS method for measuring sucrose, fructose and glucose in plant tissues. In: Food Chem., 2018 Oct 1, 262, S. 191–198, PMID 29751908
- S Sun, H Wang, J Xie, Y. Su: Simultaneous determination of rhamnose, xylitol, arabitol, fructose, glucose, inositol, sucrose, maltose in jujube (Zizyphus jujube Mill.) extract: comparison of HPLC-ELSD, LC-ESI-MS/MS and GC-MS. In: Chem Cent J., 2016 Apr 30, 10, S. 25, PMID 27141230
- ALC Velho, E Menezes, T Dinh, A Kaya, E Topper, AA Moura, E Memili: Metabolomic markers of fertility in bull seminal plasma. In: PLoS One, 2018 Apr 10, 13(4), S. e0195279, doi:10.1371/journal.pone.0195279, PMID 29634739
- J. S. White, L. J. Hobbs, S. Fernandez: Fructose content and composition of commercial HFCS-sweetened carbonated beverages. In: International Journal of Obesity, Band 39, Nummer 1, Januar 2015, S. 176–182, doi:10.1038/ijo.2014.73, PMID 24798032, PMC 4285619 (freier Volltext).