Darmflora
Als Darmflora (Syn. Intestinalflora, intestinale Mikrobiota, intestinales Mikrobiom) wird die Gesamtheit der Mikroorganismen bezeichnet, die den Darm von Menschen und Tieren (sogar von Insekten[1]) besiedeln und für den Wirtsorganismus von entscheidender Bedeutung sind. Es besteht somit eine Wechselbeziehung zwischen Lebewesen zweier Arten. Die Darmflora gehört zum Mikrobiom eines Vielzellers.
Die Bezeichnung „Flora“ beruht auf der früher vertretenen Auffassung, Bakterien und viele andere Mikroorganismen gehörten zum Pflanzenreich. Da Bakterien heute eine eigene Domäne bilden, sollte richtigerweise von einer Darmmikroorganismengemeinschaft oder von einer Darmmikrobiota gesprochen werden. Diese Bezeichnungen setzen sich in der Medizin nur langsam durch.
Daneben finden sich im menschlichen Darm eine Vielzahl an – überwiegend harmlosen – Viren, etwa Bakteriophagen, die Bakterien abbauen.[2]
Zusammensetzung
Darmflora des Menschen
Der Darm des Menschen wird von Bakterien, Archaeen und Eukaryoten besiedelt.[3] Er stellt ein komplexes und dynamisches bakterielles Ökosystem dar, das sich innerhalb der ersten Lebensjahre etabliert. Die Besiedlungsdichte des Darms ist anfangs gering und steigt mit zunehmendem Lebensalter stetig an. Während des Geburtsprozesses und kurz danach erfolgt die erste bakterielle Besiedlung des vorher sterilen humanen Verdauungstraktes. Bei natürlich geborenen Kindern beginnt die Kolonisation während der Geburt. Die ersten Mikroorganismen, die nachgewiesen werden können, sind Escherichia coli, Enterobakterien und Streptokokken. Durch Kaiserschnitt geborene Kinder erhalten zunächst eine Darmflora, die der mütterlichen Hautflora entspricht.[4]
Einen besonderen Einfluss auf die Besiedlung hat die Nahrung. Ob ein Kind gestillt wird oder Flaschennahrung bekommt, lässt sich an der Darmflora erkennen. Der Darm gestillter Kinder wird nach den ersten Wochen hauptsächlich von den milchsäureproduzierenden Bakterien (Bifidobakterien und Laktobazillen) bevölkert. Die von ihnen produzierte Milchsäure führt zu einer Ansäuerung des Darmmilieus, die es pathogenen Bakterien erschwert, sich dort anzusiedeln. Im Gegensatz dazu wird bei Flaschenkindern eine erwachsenenähnliche Mikroflora nachgewiesen.
Die Darmflora von erwachsenen Menschen zeichnet sich durch eine Vielzahl von verschiedenen Bakteriengattungen aus. Bei einem gesunden Erwachsenen mittleren Alters besteht dieses Ökosystem aus hauptsächlich anaeroben Bakterien mit einer Gesamtzahl von 10 bis 100 Billionen. Molekulare Analysen der 16S-ribosomalen DNA haben bisherige kulturabhängige Schätzungen von 200 bis 300 Arten auf bis zu 1800 Gattungen mit bis zu 36.000 Arten ansteigen lassen. Die zum Darmkanal gehörende Besiedlung eines Menschen enthält mindestens 500 bis 1000 unterschiedliche Arten.[5][6] Die Mikroorganismen besiedeln das Darmlumen, die Muzinschicht und die mukosalen Oberflächen. Im Gegensatz zum Dünndarm mit 103 bis 107 (zehn Millionen) Individuen je Gramm Kot, ist der Dickdarm mit 1011 (hundert Milliarden) bis 1012 (eine Billion) Individuen je Gramm dicht besiedelt.[7] Die Gesamtmasse der Mikroflora im Darmtrakt eines erwachsenen Menschen beträgt zwischen 1000 und 2000 Gramm, wobei sich über 50 % der mikroskopisch in Stuhlproben beobachtbaren Mikroorganismen nicht kultivieren lassen.[8][9][10]
Die Darmflora besteht zu 99 % aus vier bakteriellen Abteilungen (Phyla = Stämmen): Firmicutes, Bacteroidetes, Proteobacteria und Actinobacteria.[11] Bei Menschen mittleren Alters werden im Dickdarm fast ausschließlich obligate Anaerobier (Bacteroides, Bifidobacterium, Eubacterium, Clostridium, Fusobacterium, Ruminococcus, Roseburia) gefunden, während sich die Dünndarmmikroflora hauptsächlich aus fakultativ anaeroben Bakterien wie beispielsweise Enterococcus- und Lactobacillus-Arten zusammensetzt. Von der Art Escherichia coli gibt es verschiedene Biovare. Einige dieser Biovare sind als Darmbewohner des Menschen völlig harmlos, andere jedoch pathogen: enterohämorrhagische E. coli (EHEC), enteropathogene E. coli (EPEC), enteroinvasive E. coli (EIEC), enterotoxische E. coli (ETEC). Escherichia coli ist einfach zu kultivieren und wird in der Mikrobiologie als Modellorganismus verwendet.
Darmflora des Hundes
Die Darmflora bei Hunden besteht zu 99 % aus fünf bakteriellen Abteilungen. Neben den Firmicutes, Bacteroidetes, Proteobacteria und Actinobacteria wie beim Menschen kommen beim Hund Fusobacteria vor. Im Magen finden sich bei gesunden Hunden Helicobacter spp., die die Magenschleimhaut einschließlich der Magendrüsen invasiv besiedeln. Im Dünndarm überwiegen Clostridia, Milchsäurebakterien und Proteobacteria, im Dickdarm Clostridiales, Bacteroides, Prevotella und Fusobacteria. Dabei ist zu beachten, dass jedes Tier ein individuelles intestinales Mikrobiom besitzt.[12]
Nutzen, Funktion, Bedeutung
Im Darm befinden sich rund 1,3-mal so viel Mikroorganismen, wie der Organismus des Menschen Zellen enthält.[13] Im Dickdarm befinden sich sehr viel mehr Mikroorganismen als im Dünndarm. Die Intestinalmikroflora ist an der Abwehr von Krankheitserregern (Kolonisationsresistenz) beteiligt und beeinflusst das Immunsystem, wobei nicht ganz klar ist, ob sich für den Wirt insgesamt ein Vorteil ergibt. Experimente mit von Mikroorganismen freien und normalen Mäusen haben gezeigt, dass verschiedene Bakterien und Amöben durch die Anwesenheit der Darmflora erst pathogen werden, hingegen werden die negativen Auswirkungen von einigen anderen eukaryotischen Einzellern und Saugwürmern verringert.[14] Die Konstanz der Milieubedingungen im Darm und die Vielseitigkeit der in Form der Nahrung zugeführten Substrate begünstigen die Entwicklung einer an Individuen- und Arten-Zahl und Aktivitäten äußerst komplexen Mikroorganismengesellschaft. Nahrungsbestandteile und vom menschlichen Organismus gebildete Stoffe dienen den Mikroorganismen als Nährstoff- und Energiequelle. Die Mikroorganismen haben verschiedene Wirkungen auf den Menschen wie
- Immunmodulation[15]
- Abwehr und Bekämpfung von pathogenen Erregern,
- Versorgung mit Vitaminen (Thiamin, Riboflavin, Pyridoxin, B12, K)
- Unterstützung der Verdauung von Nahrungsbestandteilen[16]
- Versorgung der Darmepithelschicht mit Energie (Butyrat)[16]
- Anregung der Darmperistaltik
- Produktion von kurzkettigen Fettsäuren (Butyrat, Essigsäure, Propionsäure)[16]
- Detoxifizierung von Xenobiotika[17]
- Verbesserung der Hitzeresistenz[18]
- Verbesserung der Ausdauer-Leistungsfähigkeit[19]
Während des mikrobiellen Abbaus unverdaulicher Kohlenhydrate (Ballaststoffe) werden im menschlichen Darm kurzkettige Fettsäuren (hauptsächlich Essig-, Propion- und Buttersäure) und Gase gebildet, wie Wasserstoff (H2), Kohlenstoffdioxid (CO2) und Methan (CH4). Darmepithelzellen nehmen die Fettsäuren auf und verstoffwechseln sie; die Gase werden ausgeschieden (Flatulenz). Unter den kurzkettigen Fettsäuren wird besonders der Buttersäure auf Grund ihrer physiologischen Effekte eine besondere Bedeutung zugesprochen. Beispielsweise wurde bei Darmkrebs eine verminderte intestinale Buttersäurekonzentration beobachtet.[16] Eine weitere Funktion der kurzkettigen Fettsäuren ist die Anregung der Darmperistaltik, der kontraktiven Bewegung des Darms zur Beförderung von Nahrungsbrei in Richtung Enddarm.
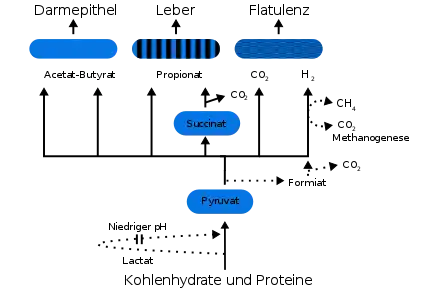
Bei der anaeroben Verstoffwechselung von Proteinen werden kurzkettige, aber auch verzweigtkettige Fettsäuren gebildet (iso-Valeriansäure, iso-Buttersäure). Daneben können noch Produkte wie Thiole (Mercaptane), Indole, Amine und Schwefelwasserstoff (H2S) gebildet werden. Im geringen Maße wird auch Stickstoff (N2) gebildet. Fette werden unter anoxischen Bedingungen im Darm nicht verstoffwechselt.
Die Darmflora beeinflusst das Körpergewicht und spielt eine Rolle bei der Fettsucht (Adipositas). Aus Experimenten an „dicken“ (englisch obese) Mäusemutanten (ob/ob), denen der Fettsäureregulator Leptin fehlt, ist bekannt, dass sich die Darmflora von dicken und schlanken Mäusen hinsichtlich der Zusammensetzung des Verhältnisses von Bakterien der Gattung Bacteroides und des Stamms (Abteilung) der Firmicutes unterscheidet, wobei dicke Mäuse einen größeren Anteil an Firmicutes aufweisen. Auch die Darmflora des Menschen hat Einfluss auf das Körpergewicht. Im Darm von gesunden Menschen finden sich Firmicuten- und Bacteroideten-Stämme in einem Verhältnis von 1:1 bis 3:1. Bei übergewichtigen Patienten finden sich häufig verschobene Verhältnisse zu Gunsten der Firmicutes von 3:1 auf bis 25:1 (in Extremfällen bis 200:1). Eine Dominanz der Firmicutes führt zu einem besseren Abbau von Ballaststoffen und der Gewinnung von zusätzlicher Energie. Übergewichtigkeit ist deshalb auch ein Resultat einer verbesserten Energieversorgung durch übermäßig stark ausgeprägte Firmicutes.[20] Bei einer Gewichtsreduktion verschiebt sich das Verhältnis von Firmicutes zu Bacteroides hin. Die gegenseitige Beeinflussung der Zusammensetzung der Darmflora und des Körpergewichtes wird mit der Energieaufnahme in Zusammenhang gebracht, weil durch die Zusammensetzung der Darmflora die Verdauung von Fettsäuren und Polysacchariden beeinflusst wird. Dies geht aus Experimenten hervor, in denen die Darmflora (aus dem Caecum) von dicken Mäusen in Mikroorganismen-freie Mäuse transplantiert wurde, und diese anschließend, trotz Verringerung der Nahrungszufuhr, an Gewicht zunahmen.[21][22][23][24]
Es wird diskutiert, inwiefern die Zusammensetzung der Darmflora bei Mäusen, wie bei Menschen, einen Einfluss auf das emotionale Verhalten und den Umgang mit Stress hat.[25]
In ihrer Funktion als Kommensalen verhindern die Mikroorganismen durch ihre bloße Menge ein Überwuchern von pathogenen Mikroorganismen, wie dies durch Clostridium difficile bei der pseudomembranösen Kolitis geschieht. Umgekehrt kann durch die Verabreichung von Stuhl eines gesunden Spenders durch einen Einlauf (über das Rektum oder eine liegende Nasoduodenalsonde) eine therapieresistente pseudomembranöse Kolitis in der Mehrzahl der Fälle ausgeheilt werden, wie Studien[26] zeigten. Über Erfolge bei anderen chronisch-entzündlichen Darmerkrankungen wurde ebenfalls berichtet.
Mit etwa 30 % der Trockenmasse ist die Darmflora ein wesentlicher Bestandteil der Fäzes.
Fehlbesiedelung des Darms
Veränderungen der Darmflora können in einer Unter- oder Überbesiedelung und in einer Veränderung ihrer Zusammensetzung bestehen. Es können Fehlbesiedelungen entweder im Dick- oder im Dünndarm oder bei beiden gleichzeitig auftreten. Die optimale Zusammensetzung der Darmflora ist wirtsabhängig. Mäuse, die mit einer typischen Darmflora vom Menschen oder von der Ratte ausgestattet werden, weisen gegenüber Mäusen, welche die typische Darmflora für Mäuse besitzen, Schwachstellen in ihrem Immunsystem auf.[27]
Symptome
Diese umfassen allgemein Bauchschmerzen, Blähungen, eine erhöhte Infektanfälligkeit sowie Anfälligkeit für Nahrungsmittelunverträglichkeiten. Bei einer gestörten Dünndarmflora tritt ein Blähbauch ohne abgehende Darmgase auf, der Bauch verflacht über Nacht wieder. Bei einer Fehlbesiedelung des Dickdarms dagegen tritt der Blähbauch mit abgehenden Darmgasen auf. Es sind ebenso Rückwirkungen auf das Immunsystem und Zusammenhänge der gestörten Darmbesiedelung mit dem Nervensystem zu beobachten.[28]
Diagnose
Um auf eine Fehlbesiedelung zu prüfen, wird zuerst zum Ausschluss einer Dünndarmfehlbesiedlung ein Lactulose-H2-Atemtest durchgeführt. Zusätzlich empfiehlt sich ein ausführlicher H2-Atemtest mit Laktose oder Fruktose, da diese Unverträglichkeiten einer bakteriellen Überbesiedelung aufgelagert sein können. Wenn eine Fehlbesiedelung des Dünndarms ausgeschlossen wurde, kann zusätzlich mit Hilfe einer Stuhlprobe der Darmflorastatus ermittelt werden, um auf eine Fehlbesiedelung des Dickdarms zu prüfen.
Forschungsgeschichte
Da entdeckt wurde, dass Bakterien Krankheiten verursachen können, wurde die Existenz der Darmflora nach ihrer Entdeckung für eine Krankheit gehalten, die den Namen „intestinale Toxämie“ erhielt: Sir Arbuthnot Lane, der Chirurg des britischen Königshauses, empfahl seinen Patienten, sich wegen der gefährlichen Eingeweidebewohner den Dickdarm entfernen zu lassen. Darmreinigungen kamen bei Ärzten in Mode. In der weiteren Folge wurde das Thema von der Forschung weitgehend ignoriert. Die anaeroben Mikroorganismen konnten im Labor nicht untersucht werden.
Erst das Aufkommen der Antibiotika, deren bakterientötende Eigenschaft die Darmflora beschädigte, und die Folgen dieser Schädigung brachten das Thema zurück auf die Agenda der Forschung. Letztlich blieben wegen der praktischen Schwierigkeiten zunächst große Fortschritte aus. Dies lag daran, dass mit den klassischen Kulturverfahren nur ein Bruchteil der Darmmikrobiota nachgewiesen werden konnte. Das Bild der Zusammensetzung der Darmflora hat sich seit Einführung molekularer Techniken teilweise grundlegend geändert.[29]
Beeinflussung der Darmflora
Zunächst wird bei einer Vaginalgeburt sofort der Darm des Säuglings besiedelt. Anfänglich sind Enterobakterien und Streptokokken im Stuhl nachweisbar, und bei Muttermilch-Ernährung sind bald Bifidobakterien und Ruminococcus-Arten vorherrschend. Es besteht ein Zusammenhang zwischen mütterlicher Vaginalflora und fetaler Darmflora bei Vaginalgeburten.[30][31][32]
Medizinische Eingriffe
Die Schädigung der Darmflora durch Antibiotika ist eine Nebenwirkung dieser Medikamentengruppe und kann zu einer antibiotika-assoziierten Diarrhoe führen. Normalerweise stellt sich jedoch das ursprüngliche Gleichgewicht innerhalb weniger Wochen wieder ein. Durch intensive und beständige Antibiotikabehandlung kann die Besiedlung mit Mikroorganismen im Darm bleibend gestört werden, insbesondere bei Kindern.[28] Jedes vierte Medikament aus der Humanmedizin beeinflusst die Darmbakterien negativ und kann zu einer Antibiotikaresistenz beitragen.[33][34]
Inwieweit die Darmflora durch die Zuführung von Mikroorganismen, beispielsweise durch Probiotika, beeinflusst werden kann („Symbioselenkung“), ist wissenschaftlich umstritten.
In der Behandlung von Clostridium-difficile-Darminfektionen (antibiotikaassoziierte Kolitis) sowie anderen bakteriell bedingten Darmentzündungen wird seit einigen Jahren mit großem Erfolg die fäkale Bakterien-Therapie in Form der Stuhltransplantation angewendet.[35] Dabei wird Stuhl eines gesunden Spenders in physiologischer Kochsalzlösung aufgelöst, gereinigt und entweder über ein Klistier in den Dickdarm oder über eine nasogastrische Sonde in den Magen des Empfängers gebracht.
Nach den Ergebnissen jüngster Forschungen wird BLIS als mögliche Sanierung empfohlen. In einer Studie wird zudem der positive Einfluss auf den Darmzustand durch Probiotika-Gabe bestätigt.[36]
Da die zugeführten Bakterien nur bei intakter Darmbarriere ihre optimale Wirkung entfalten können[37], ist es sinnvoll, diese zuvor oder gleichzeitig z. B. durch ein Arzneimittel mit Myrrhe zu stabilisieren. Untersuchungen an der Charité Berlin belegen, dass die Arzneipflanze Myrrhe die Darmbarriere stabilisiert und sie vor schädlichen Einflüssen schützt.[38] Forschungen an der Universität Leipzig konnten darüber hinaus zeigen, dass Myrrhe und Kaffeekohle dabei vergleichbar gut wirken wie das häufig verordnete Kortsionpräparat Budesonid.[39]
Siehe auch
Literatur
- Jörg Blech: Leben auf dem Menschen – Die Geschichte unserer Besiedler. Rowohlt-Verlag, 2010, ISBN 978-3-499-62494-0.
- Peter Brookesmith, Karin Prager: Kleine Ungeheuer. Die geheime Welt der winzigen Lebewesen. Gondrom-Verlag, 1999, ISBN 3-8112-1735-6, S. 55–59.
- J. Müller, R. Ottenjann, J. Seifert (Hrsg.): Ökosystem Darm – Morphologie. Mikrobiologie. Immunologie. Springer-Verlag, Berlin 1989, ISBN 3-540-51707-3.
- Rosemarie Blatz: Medizinische Mikrobiologie und Immunologie – systematisch. Uni-Med, Bremen 1999, ISBN 3-89599-139-2.
- Jürgen Schulze u. a.: Probiotika; Mikroökologie, Mikrobiologie, Qualität, Sicherheit und gesundheitliche Effekte. Hippokrates-Verlag, 2008, ISBN 978-3-8304-5356-7.
- B. D. Muegge, J. Kuczynski: Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans. In: Science. Band 332, Nummer 6032, Mai 2011, S. 970–974, ISSN 1095-9203. doi:10.1126/science.1198719. PMID 21596990. PMC 3303602 (freier Volltext).
Weblinks
- Christine Westerhaus: Manuskript: Allerbeste Freunde, Deutschlandfunk – Wissenschaft im Brennpunkt vom 21. Oktober 2012
- Forschung aktuell, 29. April 2016: Welche Faktoren die Darmflora beeinflussen
- Forschung aktuell, Meldungen. 23. Mai 2016: Darm und Hirn sprechen miteinander.; nach: cell.com, Cell Reports: Ly6Chi Monocytes Provide a Link between AntibioticInduced Changes in Gut Microbiota and Adult Hippocampal Neurogenesis. doi:10.1016/j.celrep.2016.04.074
- 25. Mai 2016: Antibiotika kurbeln Produktion von Treibhausgasen an. (über die Veränderung der Darmflora von Rindern)
Einzelnachweise
- https://www.faz.net/aktuell/wissen/leben-gene/nuetzliche-untermieter-auch-im-darm-vieler-insekten-leben-bakterien-16060202.html
- Zensus : 140.000 Virenarten im Darm, orf.at, 5. März 2021, abgerufen 11. März 2021.
- Nature. Band 442, 24. August 2006, S. 851.
- M. G. Dominguez-Bello, E. K. Costello, M. Contreras u. a.: Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. In: Proc. Natl. Acad. Sci. USA. Band 107, Nr. 26, Juni 2010, S. 11971–11975, doi:10.1073/pnas.1002601107, PMID 20566857.
- J. L. Sonnenburg u. a.: Getting a grip on things: how do communities of bacterial symbionts become established in our intestine? In: Nat Immunol. Band 5, Nr. 6, 2004, S. 569–573, PMID 15164016.
- D. N. Frank u. a.: Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. In: Proc Natl Acad Sci USA. 104, 2007, S. 13780–13785.
- M. Wilson: Microbial Inhabitants of Humans. Their Ecology and Role in Health and Disease. Cambridge University Press, Cambridge 2005, ISBN 0-521-84158-5.
- F. Guarner, J. R. Malagelada: Gut flora in health and disease. In: The Lancet. Band 361, Nr. 9356, 2003, S. 512–519, PMID 12583961.
- J. L. Suau u. a.: Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut. In: Appl Environ Microbiol. Band 65, Nr. 11, 1999, S. 4799–4807, PMID 10543789.
- F. Guarner u. a.: Mechanisms of disease: the hygiene hypothesis revisited. In: Nat Clin Pract Gastroenterol Hepatol. Band 3, Nr. 5, 2006, S. 275–284, PMID 16673007.
- P. B. Eckburg, D. A. Relman: The role of microbes in Crohn's disease. In: Clin Infect Dis. 44, 2007, S. 256–262.
- Jan Suchodelski, Kenneth Simpson: Das gastrointestinale Mikrobiom bei gesunden und kranken Hunden. In: Veterinary Focus. 23, 2013, S. 22–28.
- R. Sender u. a.: Revised estimates for the number of human and bacteria cells in the body.
- L. Q. Vieira, M. R. Oliveira, E. Neumann, J. R. Nicoli, E. C. Vieira: Parasitic infections in germfree animals. In: Braz J Med Biol Res. Band 31(1), Januar 1998, S. 105–110.
- S. Rakoff-Nahoum u. a.: Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. In: Cell. 118, 2004, S. 229–241.
- M. J. Wolin, T. L. Miller: Carbohydrate fermentation. In: D. J. Hentges (Hrsg.): Human intestinal microflora in health and disease. Academic Press, New York 1983.
- S. R. Gill u. a.: Metagenomic analysis of the human distal gut microbiome. In: Science. 312, 2006, S. 1355–1359.
- C. M. Shing, J. M. Peake, C. L. Lim u. a.: Effects of probiotics supplementation on gastrointestinal permeability, inflammation and exercise performance in the heat. In: Eur J Appl Physiol. 114(1), Jan 2014, S. 93–103.
- Arnd Krüger: Darm mit Charme. In: Leistungssport. 45, 2015, S. 2, 29; Y. J. Hsu, C. C. Chiu, Y. P. Li u. a.: Effect of intestinal microbiota on exercise performance in mice. In: Journal Strength Cond Res. 29(2), Feb 2015, S. 552–558
- H. Köppen: Darmflora & Mikrobiom. In: Website Praxiszentrum-Leipzig. (praxiszentrum-leipzig.de [abgerufen am 22. Mai 2017]).
- R. E. Ley, P. J. Turnbaugh, S. Klein, J. I. Gordon: Microbial ecology: human gut microbes associated with obesity. In: Nature. 444(7122), 21 Dec 2006, S. 1022–1023.
- P. J. Turnbaugh, R. E. Ley, M. A. Mahowald, V. Magrini, E. R. Mardis, J. I. Gordon: An obesity-associated gut microbiome with increased capacity for energy harvest. In: Nature. 444(7122), 21. Dez 2006, S. 1027–1031.
- F. Bäckhed, J. K. Manchester, C. F. Semenkovich, J. I. Gordon: Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. In: Proc Natl Acad Sci U S A. 104(3), 16. Jan 2007, S. 979–984. Epub 2007 Jan 8.
- F. Bäckhed, H. Ding, T. Wang, L. V. Hooper, G. Y. Koh, A. Nagy, C. F. Semenkovich, J. I. Gordon: The gut microbiota as an environmental factor that regulates fat storage. In: Proc Natl Acad Sci U S A. 101(44), 2. Nov 2004, S. 15718–15723. Epub 2004 Oct 25.
- Emeran A. Mayer u. a.: Gut/brain axis and the microbiota. In: Journal of Clinical Investigation. Band 125, Nr. 3, März 2015, ISSN 0021-9738, S. 926–938, doi:10.1172/JCI76304.
- Thomas J Borody u. a.: Bacteriotherapy Using Fecal Flora: Toying With Human Motions. In: Journal of Clinical Gastroenterology. 2004.
- H. Chung, S. J. Pamp u. a.: Gut immune maturation depends on colonization with a host-specific microbiota. In: Cell. Band 149, Nummer 7, Juni 2012, S. 1578–1593, ISSN 1097-4172. doi:10.1016/j.cell.2012.04.037. PMID 22726443. PMC 3442780 (freier Volltext).
- Joël Doré (INSA): Die Wirkung von Darmbakterien geht über den Verdauungstrakt hinaus. (Memento vom 18. Juni 2012 im Internet Archive) 11. Juni 2012, abgerufen am 16. Juni 2012.
- Deutsches Institut für Ernährungsforschung: Gastrointestinale Mikrobiologie (Memento vom 15. Januar 2014 im Internet Archive)
- C. F. Favier, E. E. Vaughan, W. M. De Vos, A. D. Akkermans: Molecular monitoring of succession of bacterial communities in human neonates. In: Appl. Environ. Microbiol. Band 68, Nr. 1, Januar 2002, S. 219–226, PMID 11772630, PMC 126580 (freier Volltext).
- C. Palmer, E. M. Bik, D. B. DiGiulio, D. A. Relman, P. O. Brown: Development of the human infant intestinal microbiota. In: PLoS Biol. Band 5, Nr. 7, Juli 2007, S. e177, doi:10.1371/journal.pbio.0050177, PMID 17594176, PMC 1896187 (freier Volltext) – (plosjournals.org).
- R. Mändar, M. Mikelsaar: Transmission of mother's microflora to the newborn at birth. In: Biol. Neonate. Band 69, Nr. 1, 1996, S. 30–35, PMID 8777246.
- Viele gängige Medikamente hemmen unsere Darmbakterien. In: embl.de. 19. März 2018, abgerufen am 30. März 2019.
- Lisa Maier, Mihaela Pruteanu, Michael Kuhn, Georg Zeller, Anja Telzerow, Exene Erin Anderson, Ana Rita Brochado, Keith Conrad Fernandez, Hitomi Dose, Hirotada Mori, Kiran Raosaheb Patil, Peer Bork, Athanasios Typas: Extensive impact of non-antibiotic drugs on human gut bacteria. In: Nature. 555, 2018, S. 623, doi:10.1038/nature25979.
- Christian Lodberg Hvas, Simon Mark Dahl Baunwall, Christian Erikstrup: Faecal microbiota transplantation: A life-saving therapy challenged by commercial claims for exclusivity. In: EClinicalMedicine. Band 24, 1. Juli 2020, ISSN 2589-5370, doi:10.1016/j.eclinm.2020.100436, PMID 32642633 (thelancet.com [abgerufen am 13. Juni 2021]).
- Probiotic Escherichia coli Nissle 1917 Inhibits Leaky Gut by Enhancing Mucosal Integrity.
- Woojung Shina, Hyun Jung Kim: Intestinal barrier dysfunction orchestrates the onset of inflammatory host–microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences 115.45 (2018)
- Rita Rosenthal et al.: Myrrh exerts barrier-stabilising and-protective effects in HT-29/B6 and Caco-2 intestinal epithelial cells. Int J Colorectal Dis. 32(5): 623-634 (2017)
- Laura Weber et al.: Anti-Inflammatory and Barrier Stabilising Effects of Myrrh, Coffee Charcoal and Chamomile Flower Extract in a Co-Culture Cell Model of the Intestinal Mucosa. Biomolecules 10, 1033 (2020)